同种异体牙移植的免疫抑制功能研究*
2011-08-17金光春李言君薛江南李升钟金东春
金光春 李言君 周 聪 姜 玲 薛江南 李升钟 金东春
1.滨州医学院,山东烟台 264003;2.韩国延世大学,首尔 120-752;3.延边大学,吉林延吉 133000
异体牙移植免疫排斥反应的存在导致牙根吸收、根管治疗失败、继发感染等并发症,限制了它们的临床应用,是影响移植牙长期存活的重要因素。如何消除或降低异体牙移植后的免疫排斥反应及如何进一步提高异体牙移植的成功率,国内外研究者采用不同的方法处理异体牙,亟待解决并发症等问题。而且报道不尽相同,尚无统一的定论[1]。本研究旨在通过动物实验进行同种异体牙移植的研究,减少免疫排斥反应,为异体牙移植术的临床应用提供理论基础。
1 对象与方法
1.1 实验对象
随机选择14只雄性白鼠(28颗上颌左右第1磨牙)为异体牙供者,体重16~24 g。随机选择14只雌性白鼠(28颗上颌左右第1磨牙)为移植牙受体者,体重16~22 g。分成具有相同抗原性和不同抗原性两类。所有白鼠均经过血液抗原性确认,均为4周龄的Sprague-Dawley系,由韩国延世大学口腔科学研究所提供。
1.2 保存溶液
Viaspan溶液(Dupont Pharma,Willmington,DE,USA)
1.3 靶细胞
采用Sp-20骨髓瘤细胞。
1.4 生物化学试剂及反应试剂
溴化二苯四偶氮盐[3-(4,5-dimethylthiazol-2-yl)-2.5-diphenylte-trazoliumbrom ede,MTT],兔补体,蛋白水解酶。反应试剂是采用10%二甲基亚砜(dimethyl sulfoxide,DMSO/Sigma Chemical Co.,St.Louis,USA)。
1.5 方法
1.5.1 牙移植术 采用Ketamine(0.1 mL/100 mg, Jaeil Jae Dang,Korea)药物麻醉后,用探针进行牙龈分离,尽量减少对周围组织损伤的情况下,用特制的拔牙钳子拔除异体牙供者的左右上颌第1磨牙,移植于受体。
1.5.2 效应细胞的制备 无菌条件下取出同种异体移植组和接受组白鼠脾脏在骨凿器上磨碎,收集溢出的淋巴细胞,使用60% Pecoll充分分离淋巴细胞。
1.6 组织学观察
牙移植术后分别于1、2、4、8断颈法处死动物(按时间段处死7只),摘除颌骨,10%福尔马林固定24 h,在5%硝酸脱敏溶液中脱敏5 d。以牙齿长轴1 mm的间隔垂直切片,制备5 μm标本,用HE染色并观察牙根吸收程度及周围移植区的免疫排斥反应。
牙根吸收评价基准:①normal periodontium(正常牙周膜);②surface resorption(表面吸收);③inflammatory resorption(炎症吸收);④replacement resorption(复位吸收)。
1.7 ACMC与CMC免疫反应的免疫学观察
标本二甲苯溶液中浸泡30 min,去除石蜡,用95%、90%、70%酒精与蒸馏水按顺序处理,用0.1%胰岛素酶处理,露出抗原部位,并在山羊血清中反应30 min,应用生物素染色(avidin-biotin staining)法免疫组织化学验色,用磷酸盐缓冲盐水(phosphate buffered saline)清洗并DAB kit显色,光学显微镜观察ACMC(宿主主抗体-补体介导细胞杀伤)与CMC(细胞介导的细胞杀伤)免疫反应。观察期为1周,每个时间段的观察点是7只白鼠,分离血清,制备抗体。
1.8 统计学处理
所有数据采用SPSS 11.0进行统计分析,通过Student-Newman-Keuls 法计量数据,计量资料用(± s)表示,P < 0.05为差异有统计学意义,检验水准α=0.05。
2 结果
同种异体移植牙术后1周开始观察大多数牙根吸收及周围移植区的免疫排斥反应,发现牙根周围引流的免疫细胞反应。在牙根周围的单核细胞浸润,以及局部淋巴结内产生淋巴母细胞。移植牙受体区域纤维血管组织长入,根尖周围牙周韧带细胞大量破坏,组织血管吸收、坏死,大量的T淋巴细胞和巨噬细胞浸润的炎症反应。牙骨质呈现大面积的牙根吸收,根吸收区分布着大量破骨细胞。分布于骨质表面,形成骨吸收窝陷。免疫检测发现ACMC和CMC反应水平牙移植术后1周开始明显提高,术后1~2个月可持续增加,见图1。ACMC、CMC与同基因移植牙有统计学意义(P<0.01)。见表1。观察明显的牙根周围吸收,可见大量的破骨细胞分布在牙槽骨吸收陷窝内。
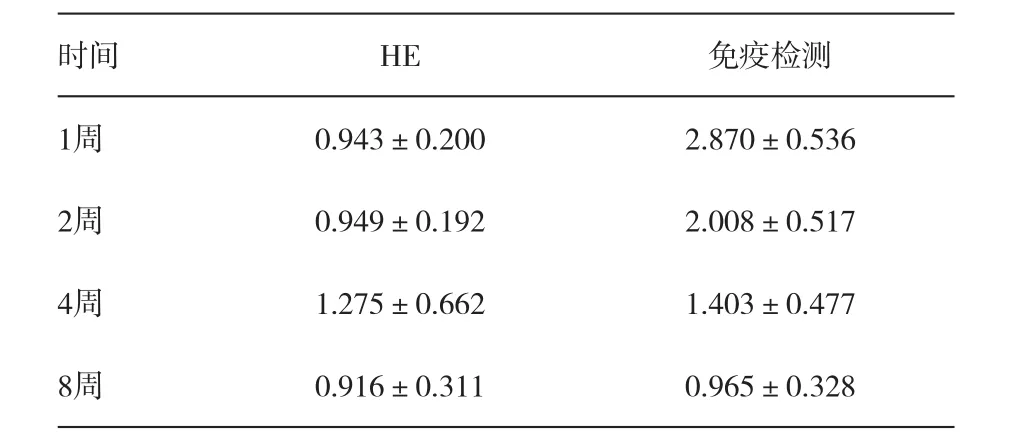
表1 同种异体牙移植术后牙根周围的免疫排斥反应(HE与免疫检测)变化
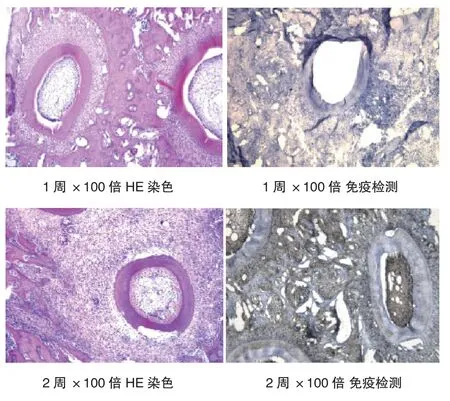
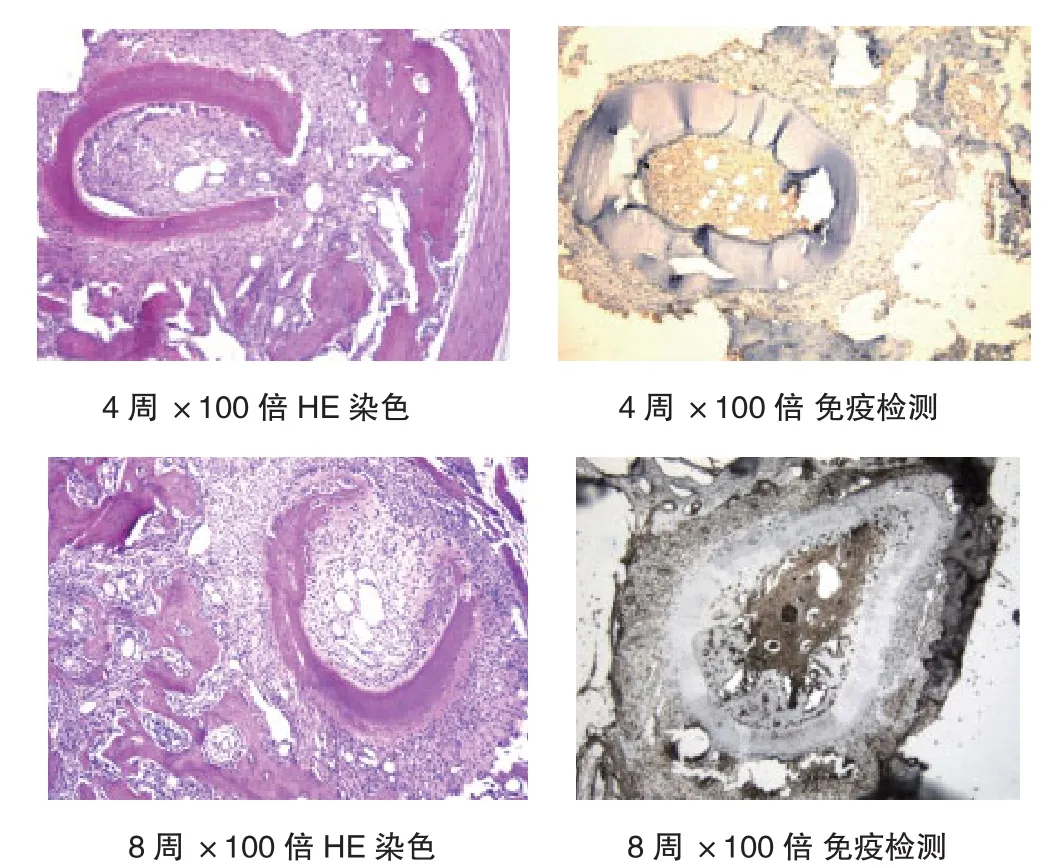
图1 牙根吸收程度及周围移植区的免疫排斥反应
3 讨论
器官移植是指通过外科手段,将他人的具有活力的器官移植给患者以代替其病损的器官的手术。20世纪,器官移植技术随着外科手术、免疫抑制药物、器官和细胞分离保存技术及移植免疫学基础的迅速发展,特别是发达国家现已成为医学领域的一门新兴学科,取得了丰硕的成果和巨大进展。牙移植术是将自体的或异体的牙齿移植到刚拔除的其他牙的牙槽窝内,是修复失牙、恢复咀嚼功能的有效方法之一。异体牙主要包括因移位、阻生、正畸等需要而拔除的正常牙,异体牙移植因其供体来源丰富而具有重要意义[2]。
异体牙移植同样面临的一个难题是移植后的排斥反应。从Vasilchenko等[4-6]报道来看,动物异体牙移植实验或临床异体牙移植病例的成功率约有9.6%~83.0%。对于异体牙移植排异反应的研究,国外学者大多采用非特异性检测方法,主要有:①宿主对来自同一供体的“二次皮肤移植”的加速排斥反应;②受植区域内淋巴结中免疫淋巴母细胞的产生。以往的研究认为异体牙牙周膜组织所导致的移植免疫反应是导致牙根吸收、影响移植牙存活率和存活时间的重要因素[7-8]。
目前人们常通过选择和处理异体牙的组织相容性配型试验来消除或降低异体牙移植的免疫排斥反应。常用的决定受体组织配型方法是ABO血型相容性试验、HLA分型试验及组织相容性交叉试验。Unno等[9]发现供受体组织相容性抗原一致的异体牙在移植后1年存活率为85.0%,而组织相容性抗原不同的异体牙移植后1年存活率只有31.0%。
近年来,学者们移植术后牙根吸收的并发症问题进行深入研究。Nishimura等[10-11]通过未根管处理的异体牙移植比经根管处理的组织学观察,发生的牙根吸收程度进展快速。本研究结果,移植术后1周开始移植区根尖部位有根吸收陷窝出现,有破骨细胞与各种因子协同作用完成,对牙槽骨、牙周膜吸收起诱导作用。由于根吸收发生区域的不确定性和观察部位没有详细定位,无法做定量的统计学分析,但从组织切片上可明显观察到这一趋势。本实验牙移植术后经检测ACMC和CMC反应,各时间段观察细胞杀伤率均为高,移植区比较有高度的显著性差异(P<0.01)。说明异体牙移植具有排斥反应。异体牙的CMC在移植术后2周开始就呈现出杀伤水平,但异体牙的ACMC反应移植术后4周开始明显地高于异体牙供者。这说明:①牙根表面的牙周膜免疫抑制功能的Fas配体的存在性;②细胞免疫对异体牙有免疫排斥反应;③实验中采取的保存溶液、靶细胞、生物化学试剂及反应试剂不能代表牙移植宿主体内实际的免疫反应水平;④异体牙移植具有排斥反应。
异体牙来源丰富,如果找到消除异体牙移植术后并发症的免疫排斥反应,将提高异体牙移植术的成功率,有待今后深层的研究。
[1]Schwartz O,Andreasen JO.Allo-and autotransplantation of mature teeth in monkeys: a sequential time-related histoquantitative study of periodontal and pupla healing[J].Dent Traumatol,2002,18(5)46-261.
[2]Kontalexis S,Papalois A,Bibidakis E,et al.Use of mycophenolate mofetil in the expeimental allo-transplantation of hepatocytes in rats with fulminant hepatic failure[J].Transplant Proc,2004,36(6):1739-1740.
[3]Straffon LH,Pink TC.Trauma to the primary and young permanent dentituons[J].Mich Dent Assoc,2000,82(1):40-45.
[4]Vasilchenko SY,Volkova AI,Ryabova AV,et al.Application of aluminum phthalocyan ine na-noparticles for fluorescent diagnostics in dentistry and skin autotrans- plantology[J]. J Bioph-otonics,2010,3(5-6):336-346.
[5]Cohen AS,Shen TC,Poqrel MA.Transplanting teeth successfully:autografts and allografts that work[J].J Am DentAssoc,1995,126(4):481-485.
[6]Yang ZP,Chang CS.A 3-year follow-up of a homotransplanted tooth from a tooth bank[J].JOE,1990,16(1):34-37.
[7]Bolgül BS,Aakiran E,Celenk S.Autotransplantation of an intruded lateral incisor replacing an avulsed central incisor a case report[J].J Clin Pediatr Dent,2009,34(2):107-111.
[8]Hupp JG, Mesaros SV, Aukhil I,et al.Periodontal ligament vitality and histologic healing of teeth stored for extended periods before transplantation[J]. Endod Dent Traumatol,1998,14(2):79-83.
[9]Unno H,Suzuki H.Pulpal regeneration following allogenic tooth transplant -ation into mouse maxilla[J].Anat Rec,2009,29(4):570-579.
[10]Nishimura K,Amano S,Nakao K,et al.Orthodontic treatment including auto tran- splantation of a mature tooth[J].Angle Orthod,2009,79(2):387-393.
[11]Schwartz O,Andreasen JO.Allo and autotransplantation of mature teeth in monkeys:a sequential time-related histoquantitative study of periodontal and pulpal healing[J].Dent Traumatol,2002,18(5):246-261.
