茄子单性结实候选基因的表达分析
2011-08-14刘富中李香景陈钰辉张振贤方智远
张 映 刘富中 李香景 陈钰辉 张振贤 方智远 连 勇
(1中国农业大学农学与生物技术学院,北京 100193;2中国农业科学院蔬菜花卉研究所,北京100081)
茄子(Solanum melongenaL.)是喜温作物,在温室反季节栽培及春季露地早熟栽培条件下,开花期常由于低温引起授粉受精不良,落花、落果,效益降低。茄子单性结实能克服低温引起的落花落果障碍,坐果能力增强,产量显著提高,同时还可改进果实品质,降低栽培成本(刘富中 等,2005;张映 等,2009)。因此,茄子单性结实特性的研究及单性结实基因的分离与克隆,对指导单性结实品种的育种工作,选育耐低温、适宜保护地和露地早春栽培、优质无籽或少籽的茄子品种,具有重要的意义。目前,国内外研究者先后对茄子单性结实的特性(田时炳 等,1999;刘富中 等,2005)、内源激素的种类和含量变化(武彦荣 等,2009;张伟春 等,2009)、胚胎及果实发育的解剖特点(张伟春 等,2008)、遗传规律(田时炳 等,2003;刘富中 等,2008)、AFLP分子标记(刘富中 等,2008;Shimomura et al.,2010)进行了研究,并通过转入外源嵌合基因DefH9-iaaM获得转基因单性结实茄子(Rotino et al.,1997),但有关茄子单性结实形成的分子机制和单性结实相关基因的分离克隆尚未见报道。
笔者利用SSH技术构建了茄子单性结实果实不同发育时期的抑制差减cDNA文库,含有2 347个阳性克隆,测序、序列拼接后,共获得1 248个高质量的unigenes。本试验对获得的差异表达unigenes在NCBI数据库中进行比对分析,并应用荧光定量PCR技术,研究10个差异表达unigenes在不同结实性果实中的表达特性,以期获得茄子单性结实相关基因,为进一步克隆茄子单性结实基因,深入研究茄子单性结实基因的表达和调控机制及分子机理奠定基础。
1 材料与方法
1.1 试验材料
茄子单性结实自交系D-10:在开花结果期间日最低温度在7~15 ℃之间时,表现单性结实,果实内无种子,果实正常生长发育;当温度适宜后,植株上部果实内产生种子。非单性结实自交系03-2:在开花结果期间日最低温度在7~15 ℃之间时,果实不能正常膨大 (刘富中 等,2005)。试验材料于2009年春定植于中国农业科学院蔬菜花卉研究所试验地内。门茄开花结果期间日最低温度在9~15 ℃之间,单性结实特性完全表达,产生无籽果实,非单性结实品系果实不能正常膨大。四门斗开花结果期间日最低温度在 16~21 ℃之间,单性结实特性不表达,两品系都产生正常有籽果实。分别取两品系低温时期(门茄)和适宜温度时期(四门斗)开花前7 d、开花当天、开花后7 d和开花后20 d 4个时间点的子房或果实,迅速用液氮冷冻处理,置于-80 ℃冰箱中保存备用。
1.2 RNA的提取和cDNA的合成
单性结实品系和非单性结实品系的门茄和四门斗时期各取样时间点均取 3个子房或果实作为一份材料,液氮研磨,用Omega的Plant RNA Kit提取总RNA。用1.0 %变性琼脂糖凝胶电泳检测总RNA的完整性,利用紫外分光光度计法测定其浓度和纯度。将每个时间点检测合格的RNA取5 μg,应用SuperScriptTMⅢ反转录试剂盒(Invitrogen公司)合成cDNA第一链。
1.3 差减文库序列分析
将测序结果去除载体和引物序列以后,使用Phrap软件对Clean ESTs序列进行组装得到unigenes,将unigenes在GenBank数据库进行BLAST序列比对分析,将比对结果E值低于1e-5的unigenes视为已知基因。
1.4 差异表达序列荧光定量PCR分析
以番茄ubiquitin为内参基因(Cooper et al.,2004),选取 F1、Z351、Z358、Z569、Z599、Z603、Z613、Z622、Z626、Z707共10个差异表达unigenes,根据其核苷酸序列,应用Primer Premier5.0软件,设计退火温度为57 ℃左右,引物无错配、二聚体和发卡结构,产物为400 bp以下的基因特异引物,并将其在oligo 6里进行验证。通过PCR扩增产物的琼脂糖凝胶电泳检测引物的有效性和特异性。
反应在LightCycler480荧光定量PCR仪(Roche)上进行,所有PCR都设3次重复。反应体系:总体积20 μL,模板8 μL,上下游引物各1 μL,SYBR Green Master Mix 10 μL。PCR 反应程序:95 ℃ 预变性 10 min,95 ℃ 10 s,57 ℃ 20 s,72 ℃ 30 s,45 个循环后作熔解曲线(95~65 ℃,0.1 ℃·s-1),实验所用的方法为双标法(唐永凯和贾永义,2008)。
标准曲线的制作:将ss cDNA(单链cDNA)模板按5-1、5-2、5-3、5-4、5-5的梯度浓度稀释,分别扩增内参基因和差异表达序列,根据其 CT值获得内参基因和差异表达序列的扩增效率和标准曲线。根据D-10和03-2的门茄和四门斗时期各取样时间点的差异表达序列和内参基因的 CT值,结合标准曲线,得到不同结实性果实中不同时期的差异表达序列的相对表达量,使用Excel 2007软件处理数据。
2 结果与分析
2.1 差异表达EST序列的比对分析
对所构建的抑制差减cDNA文库中的阳性克隆,经过测序拼接获得1 248个unigenes,其中singletons 981个,contigs 267个。将1 248个unigenes在GenBank数据库上进行BLAST比对,比对结果中E值低于1e-5的有1 109个,占全部unigenes的88.86 %;与其他物种同源性低或者没有可匹配的同源基因的unigenes所代表的可能是新基因,共139个,占11.14 %。笔者构建的茄子单性结实SSH-cDNA文库中部分unigenes的BLAST结果见表1。

表1 SSH-cDNA文库中的部分unigenes BLAST结果
2.2 荧光定量PCR基因特异引物设计
根据从构建的抑制差减文库中挑选出的10条差异表达的unigenes的核苷酸序列(表2),利用Primer Premier 5.0设计退火温度为57 ℃,产物小于400 bp的基因特异引物,以番茄ubiquitin为内参基因(Cooper et al.,2004),经琼脂糖凝胶电泳检测,确认其能有效扩增,且扩增产物为单一条带,表明设计的引物具有特异性(表2),可用于荧光定量PCR分析。

表2 荧光定量PCR所用的基因特异性引物
2.3 相对定量标准曲线的建立
10个unigenes均以ubiquitin基因作为内参基因,作相对定量标准曲线。以梯度稀释的模板进行PCR,构建各差异表达unigene和内参基因的标准曲线,并计算扩增效率(表3)。各差异表达基因的标准曲线都呈很好的线性关系,扩增效率都大于0.9,适合进行荧光定量比较。根据标准曲线方程,可以计算出要验证的10个unigenes的相对表达量。
2.4 差异表达基因的实时荧光定量PCR分析
为了更准确地鉴定SSH文库中差异表达基因的可靠性,推测单性结实的形成机理,选取9个已知功能的 unigenes(F1、Z351、Z569、Z599、Z603、Z613、Z622、Z626、Z707)和 1个功能未知的unigene(Z358)(表1),采用实时荧光定量PCR分析其在单性结实品系D-10和非单性结实品系03-2果实不同发育时期的表达情况(图1)。由图1可知,10个unigenes的表达情况大致可分为 3类:在单性结实品系D-10中特异表达的 unigenes,包括 Z358、Z569、Z599、Z603、Z626和Z707;在非单性结实品系03-2适温条件下特异表达的unigenes,包括F1和Z613;在单性结实和非单性结实品系中非特异性表达的unigenes,包括Z351和Z622。
Z569在单性结实品系低温(门茄)和适温(四门斗)时期果实的发育过程中具有相同的表达规律。在开花前表达量逐渐升高,开花当天表达量最高,至开花后7 d,表达量逐渐减少,开花后7~20 d,表达量变化不大。Z569在单性结实品系低温条件下的表达量高于在适温条件下的表达量。Z569在单性结实品系低温条件下(门茄)开花当天的表达量最高,约为适温条件下单性结实品系和非单性结实品系果实中表达量的 2倍,为非单性结实品系低温条件下表达量的3.08倍。因此,Z569可能在低温下单性结实果实的发育过程中起重要的作用。
Z599在单性结实品系和非单性结实品系果实发育过程中的表达模式不同。在单性结实品系中,开花前的表达量高于开花后的表达量,开花当天的表达量最高;而在非单性结实品系中,表达量随子房和幼果的发育逐渐下降。Z707在单性结实品系低温条件下开花前的表达量逐渐下降,从开花当天起又逐渐升高,开花后7 d表达量最高,之后又逐渐下降,而在非单性结实品系的果实和单性结实品系适温下的有籽果实的开花当天表达量最高,表明 Z707在单性结实品系低温条件下特异表达。
在低温条件下,Z603在单性结实品系中的表达量低于在非单性结实品系的表达量;而Z626在单性结实品系中的表达量高于非单性结实品系。Z358在单性结实品系不同结实性果实发育中的表达模式是逐渐下降,在低温条件下开花前7 d的表达量变化不大;在非单性结实品系果实发育中的表达模式是在开花前逐渐上升,开花当天的表达量最高,开花后表达量逐渐下降。
F1在03-2四门斗有籽果实的开花前7 d和开花当天的表达量高于其他3种果实,在开花后7 d和20 d,4种不同结实性果实的表达量基本相同。Z613在03-2四门斗有籽果实中的表达模式是在开花前7 d至开花后7 d表达量逐渐减少,之后逐渐升高,在开花后7 d表达量最低。而在其他3种果实中的表达模式则是完全相反,先上升后下降,在开花后7 d表达量最高。
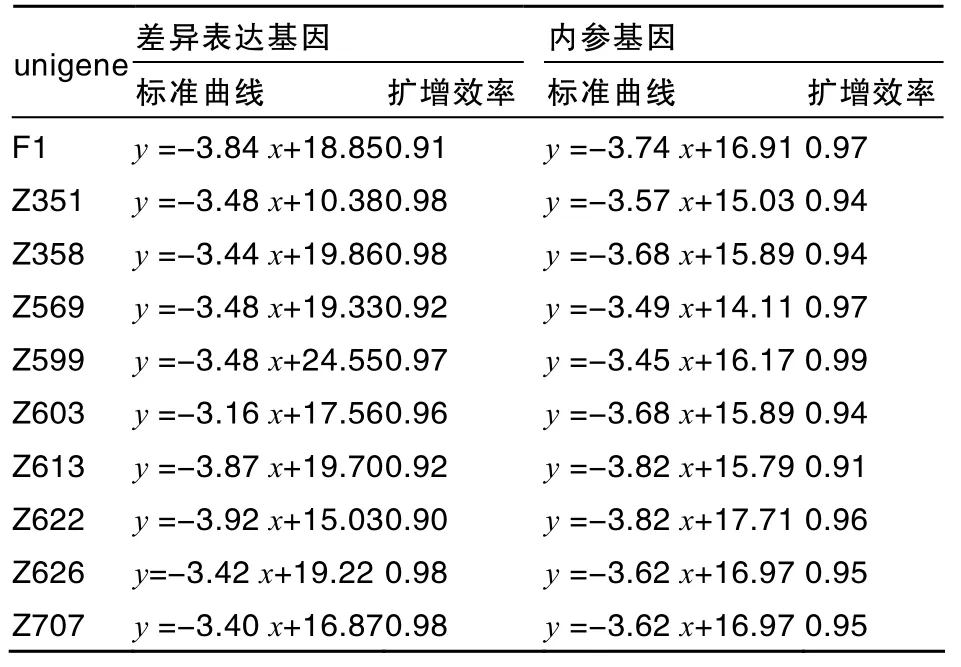
表3 差异表达基因标准曲线及其扩增效率

图1 差异表达unigenes相对定量分析
Z351和Z622在单性结实和非单性结实品系不同果实的发育过程中的表达规律基本相同,其表达模式是下降—升高—下降,Z351在开花后7 d表达量最高(图1)。
3 结论与讨论
本试验对前期构建的茄子单性结实抑制差减文库中的一些重要的差异表达 unigenes序列进行分析,这些基因编码的产物包括转录调控因子MADS-box transcription factor和AP2/ERF transcription factor,果实生长相关蛋白 pistil extension-like protein、methionine fulfoxide reductase和3-ketoacyl-CoA synthase,细胞组分histone H3.2 precursor和ribosomal protein,以及与植物成花相关的光受体Cryptochrome和Prf interactor等,涉及到果实发育的多个方面。获得部分与其他物种同源性低或没有可匹配的同源基因的 ESTs,可能是新基因。这些基因的功能有待进一步研究。
本试验得到的在单性结实子房和果实中上调表达的Z569,与控制番茄果实膨大的E4基因同源性高达89 %,其翻译产物是甲硫氨酸亚砜还原酶(Cordes et al.,1989)。E4基因在膨大的果实中表达量高(即合成甲硫氨酸亚砜还原酶),在突变的番茄品种rin(果实膨大受阻型)中,E4基因的转录水平只有正常果实的1/10(DellaPenna et al.,1989)。这是因为在膨大的果实中代谢旺盛,产生大量的活性氧,活性氧会导致细胞的失衡和组织的损坏,由于甲硫氨酸亚砜还原酶的修复作用,保护了果实膨大过程中的关键蛋白,使果实得以正常生长和发育(Sadanandom et al.,2000)。荧光定量分析表明,在低温条件下,单性结实品系D-10门茄开花当天子房中的Z569表达量最高,为非单性结实品系03-2门茄子房中表达量的3.08倍,约为单性结实品系和非单性结实品系适温条件下四门斗有籽果实表达量的2倍。前期试验表明,单性结实品系D-10的单性结实性受低温诱导表达(刘富中 等,2005),其单性结实果实的形成可能是Z569基因的大量表达,消除了低温胁迫环境下(Berlett & Stadtman,1997)和果实膨大过程中(Dann & Pell,1989)产生的大量破坏性活性氧对一系列蛋白、脂肪和核酸的氧化作用,使子房正常发育成果实。因此推测Z569与单性结实相关。
Z707与乙烯合成和信号转导途径末端的乙烯响应因子序列为同源序列,乙烯响应因子作为表达调控因子,调控下游具有 GCC-box元件的基因的表达,从而实现性状的表达和胁迫的响应(安丰英和郭卫红,2006)。近年来在拟南芥和番茄中的研究证明,乙烯可通过调控生长素的作用以及通过乙烯信号转导作用引起果实的自发膨大,形成单性结实(Vivian-Smith,2000;Linet al.,2008)。Z707在低温条件下的单性结实品系中开花前下调表达,开花后上调表达,其可能通过调控乙烯的表达促进果实的发育。
Z599与番茄中软木脂和果皮表面的蜡粉合成有关的3 -酮脂酰辅酶A合成酶相似(Leide et al.,2007);Z603与组蛋白H2A相似,H2A具有维持核小体结构稳定性和染色质凝聚的作用,还可作为调节因子绑定到特需的蛋白质上,调节基因的表达;Z626是一种光敏色素相互作用因子,通过光信号的转导对环境条件的改变发生响应(Jiaoet al.,2007)。荧光定量分析表明,Z599和 Z358在单性结实品系中特异表达,在低温条件下,Z603在单性结实品系子房和果实的生长和发育过程中下调表达,Z626上调表达。这3个unigenes与功能未知的Z358在茄子果实中的具体功能、作用机制以及是否与单性结实相关还需要进一步的试验验证。
F1和Z613在03-2适温条件下的四门斗果实中特异表达,可能与03-2四门斗果实中的种子数量最多有关。BLAST结果显示F1与番茄中的单性结实相关基因Tm29相似性高达90 %,转基因实验和反义技术证明其可以引起单性结实(Ampomah-Dwamena et al.,2002)。基因Tm29与拟南芥中的MADS-box基因家族中的SEPALLATA1、SEPALLATA2和SEPALLATA3基因具有相似性,已从拟南芥中分离出与胚珠发育密切的SEP基因(Favaroet al.,2003),研究发现若使SEP的活性减少,其正常的胚珠和种子的发育被打乱,一些胚珠变成叶状或心皮状的结构,这些结果表明SEP基因对于正常的胚珠发育是必须的。因此,茄子单性结实果实中种子的缺失,可能是控制胚珠发育的SEP基因活性减小引起的。Z613与隐花色素同源,隐花色素在响应外界环境、开花调控和基因表达调节方面都具有重要作用(张小冰,2010),但其表达模式的改变是否调控果实的发育和种子的形成还需进一步研究。
非特异性表达的ungenes Z351和Z622则可能与单性结实无关。
安丰英,郭红卫.2006.乙烯信号转导的分子机制.植物学通报,23(5):531-542.
刘富中,连勇,陈钰辉,宋燕.2005.温度和蕾期去雄及去柱头处理对茄子单性结实性的影响.园艺学报,32(6):1021-1025.
刘富中,万翔,陈钰辉,连勇,宋明.2008.茄子单性结实基因的遗传分析及AFLP分子标记.园艺学报,35(9):1305-1309.
唐永凯,贾永义.2008.荧光定量PCR数据处理方法的探讨.生物技术,37(6):29-32.
田时炳,刘君绍,皮伟,赵晓凤,杨治元.1999.低温下茄子单性结实观察试验初报.中国蔬菜,(5):28.
田时炳,刘富中,王永清,罗章勇,陈义康,刘君绍,连勇,皮伟,洪云菊.2003.茄子单性结实性的遗传分析.园艺学报,30(4):413-416.
武彦荣,郭秀林,高秀瑞,李冰,潘秀清.2009.茄子单性结实系开花期内源激素含量的变化.河北农业科学,13(9):14-16.
张伟春,魏毓棠,王静,何明,唐萍.2008.茄子单性结实与非单性结实品系胚胎发育及果实解剖结构的观察.沈阳农业大学学报,39(5):534-537.
张伟春,魏毓棠,王静,何明,唐萍,杜雪晶.2009.茄子子房内源激素含量与单性结实的关系.沈阳农业大学学报,40(1): 3-6.
张小冰.2010.植物隐花色素及其功能研究进展.生物学教学,35(7):4-6.
张映,刘富中,陈钰辉,连勇.2009.低温下茄子单性结实特性的研究.中国蔬菜,(2):16-20.
Ampomah-Dwamena C,Morris B A,Sutherland P,Veit B,Yao J L.2002.Down-regulation ofTM29,a tomatoSEPALLATAhomolog,causes parthenocarpic fruit development and floral reversion.Plant Physiology,130(2):605-617.
Berlett B S,Stadtman E R.1997.Protein oxidation in aging,disease,and oxidative stress.Journal of Biological Chemistry,272(33): 20313-20316.
Cooper W C,Jia L,Goggin F L.2004.Acquired and R-gene-mediated resistance against the potato aphid in tomato.Journal of Chemical Ecology,30(12):2527-2542.
Cordes S,Deikman J,Margossian L J,Fischer R L.1989.Interaction of a developmentally regulated DNA-binding factor with sites flanking two different fruit-ripening genes from tomato.The Plant Cell,1(10):1025-1034.
Dann M S,Pell E J.1989.Decline of activity and quantity of ribulose bisphosphate carboxylase/oxygenase and net photosynthesis in ozone-treated potato foliage.Plant Physiology,91(1):427-432.
DellaPenna D,Lincoln J E,Fischer R L,Bennett A B.1989.Transcriptional analysis of polygalacturonase and other ripening associated genes in Rutgers,rin,norandNrtomato fruit.Plant Physiology,90(4):1372-1377.
Favaro R,Pinyopich A,Battaglia R,Kooiker M,Borghi L,Ditta G,Yanofsky M,Kater M,Colombo L.2003.MADS-box protein complexes control carpel and ovule development in Arabidopsis.The Plant Cell Online,15(11):2603-2611.
Jiao Y,Lau O S,Deng X W.2007.Light-regulated transcriptional networks in higher plants.Nature Reviews Genetics,8(3):217-230.
Leide J,Hildebrandt U,Reussing K,Riederer M,Vogg G.2007.The developmental pattern of tomato fruit wax accumulation and its impact on cuticular transpiration barrier properties:effects of a deficiency in aβ-ketoacyl-coenzyme A synthase(LeCER6).Plant Physiology,144(3):1667-1679.
Lin Z,Arciga-Reyes L,Zhong S,Alexander L,Hackett R,Wilson I,Grierson D.2008.SlTPR1,a tomato tetratricopeptide repeat protein,interacts with the ethylene receptors NR and LeETR1,modulating ethylene and auxin responses and development.Journal of Experimental Botany,59(15):4271-4287.
Rotino G L,Perri E,Zottini M,Sommer H,Spena A.1997.Genetic engineering of parthenocarpic plants.Nature Biotechnology,15(13):1398-1401.
Sadanandom A,Poghosyan Z,Fairbairn D J,Murphy D J.2000.Differential regulation of plastidial and cytosolic isoforms of peptide methionine sulfoxide reductase in Arabidopsis.Plant Physiology,123(1):255-264.
Shimomura K,Koga T,Sueyoshi T,Hamachi Y.2010.Development and suitability of DNA markers for breeding of parthenocarpic eggplant.Horticultural Research (Japan),9(1):13-17.
Vivian-Smith A.2000.The molecular basis for the initiation of fruit development and parthenocarpy.Adelaide:The University of Adelaide.
