充血性心力衰竭患者外周血中内皮素受体基因的表达及意义
2011-08-13龚少愚周春刚朱红俊
龚少愚,周春刚,高 枫,陆 曙,朱红俊
(南京中医药大学无锡附属医院/无锡市中医医院心内科,江苏 无锡 214001)
近年来的研究表明,内皮素(ET-1)是迄今发现的最强烈的收缩血管物质,内皮素系统在心力衰竭(简称心衰)的发病过程中起着重要作用[1]。升高的血浆ET-1浓度不但和心衰时的症状和血流动力学的严重程度呈正相关[2],而且影响患者的预后,能引起心肌肥厚和心肌细胞损伤[3]。ET和ET受体的生物学意义及表达调控机制日益引起人们的重视。本院利用已构建的外周血ETA、ETB基因的逆转录聚合酶链反应(RTPCR)检测方法,对48例心衰患者和25例健康对照组的外周血中内皮素受体基因(ETA、ETB)的表达进行了检测,从而探讨其临床意义,现报道如下。
1 资料与方法
1.1 临床资料 心衰患者48例,均为本院心内科2009年2月至2010年2月的住院患者,男25例,女23例,年龄49~82岁,平均(72.2±8.3)岁;其中冠心病 28例,高血压性心脏病15例,扩张型心肌病5例;均经超声心动图证实为充血性心力衰竭,EF值小于50%。依据NYHA心功能分级,Ⅱ级13例,Ⅲ级18例,Ⅳ级17例。选择25例健康体检无心功能不全证据的成年人作为对照组,其中男 14例,女 11例,年龄 48~76岁,平均(68.2±7.6)岁,两组在年龄、性别上差异无统计学意义。
1.2 方法
1.2.1 ET-1的测定 两组均于入院后第1天清晨采空腹静脉血 2 mL(30 μ L EDTA 加 20 μ L 抑肽酶),立即离心,分离血清,-80℃冰箱保存,集中采用放射免疫方法测定,试剂盒由北京东亚免疫技术研究所提供。
1.2.2 全血总RNA抽提 清晨采空腹静脉血3 mL,经EDTA⋅Na2抗凝,采用3S柱离心式血液总 RNA抽提试剂盒(K3620上海博彩生物科技有限公司),RNA浓度测定采用BIO-RAD核酸蛋白测量仪(SmartSpec Plus Spectrophotometer),RNA提取物-80℃保存。
1.2.3 外周血 ETA、ETB基因表达的检测方法 外周血ETA、ETB mRNA表达水平通过实时荧光定量PCR技术进行相对定量检测。ETA受体基因引物序列,GenBank:NM-001957 正向 5′-GCT TCC TGG TTA CCA CTC ATC AA-3′,反向 5′-TAG TCT GCT GTG GGC AAT AGT TG-3′。 ETB受体基因引物序列,GenBank:NM-001101正向,5′-GCC AAG GAC CCA TCG AGA T-3′,反向 5′-GAA GTG TGG AGT TCC CGA TGA T-3′。管家基因 GAPDH作为内参基因,GAPDH基因引物序列,GenBank:NM-002046.3,正向5′-ACA GTC AGC CGC A TC TTC TT-3′,反向 5′-ACG ACC AAA TCC GT T GAC TC-3′。
实时荧光定量PCR采用两步法,全血总RNA合成cDNA使用TAKARA反转录反应试剂盒(DRR037S大连宝生物工程有限公司)。实时荧光定量 PCR采用SYBR PrimeScript RT-PCR KitⅡ试剂盒(DRR083S大连宝生物工程有限公司),PCR仪采用LightCycler480扩增仪。实时荧光定量PCR反应体系为20 μ L,包括 2×SYBR Premix Ex Taq,1~ 100 ng cDNA,50 pmoL/μ L引物。两步法 PCR循环条件:预变性95℃30 s一个循环,变性 95℃5 s,退火/延伸60℃20 s,共40个循环。溶解曲线分析采用LightCycler Relative Quantification(Version 1.5)软件,用于产物的特异性分析,2%琼脂糖凝胶电泳亦用于扩增产物的大小及特异性鉴定。
表1 心衰患者和健康对照组血浆ET-1水平、ETA 、ETB基因表达的比较()

表1 心衰患者和健康对照组血浆ET-1水平、ETA 、ETB基因表达的比较()
*:P>0.05,**:P<0.01,***:P<0.05,与健康对照组比较。
组别 n ET-1(ng/L) ET A ET B健康对照组 25 67.34±14.36 1.08±0.32 1.00±0.28心功能Ⅱ级组 13 82.24±12.48* 1.09±0.25* 0.92±0.30*心功能Ⅲ级+Ⅳ级组 35 126.25±16.51** 2.06±0.49** 1.67±0.47***
相对定量分析采用△△CT法进行相对定量。△△CT法是通过LightCycler Relative Quantification(Version 1.5)软件,假定目的基因和内参基因扩增效率相同时,扩增效率默认为2,标准化比值计算公式为2-△△CT。
1.3 统计学处理 计数资料用χ2检验,计量资料以表示,组间均数比较用方差分析,同组治疗前后均数用配对t检验。各检测指标间进行相关性分析。所有数据采用SPSS13.0统计软件包处理。P<0.05为差异有统计学意义。
2 结 果
2.1 扩增产物电泳及溶解曲线分析 ETA、ETB和甘油醛-3-磷酸脱氢酶(GAPDH)的RT-qPCR产物经2%琼脂糖凝胶电泳鉴定,结果显示扩增产物均为单一条带,无引物二聚体形成,大小分别为84、99、94 bp,见图 1。扩增产物溶解曲线分析,产物具有单一明显而尖峭的峰图,说明产物特异无非特异性产物生成,见图2。
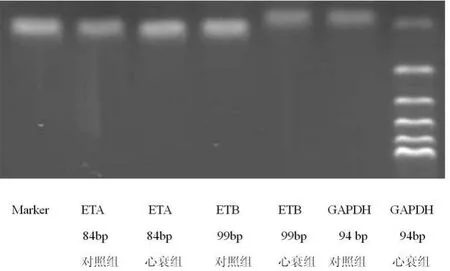
图1 目的基因和内参基因2%琼脂糖凝胶电泳图
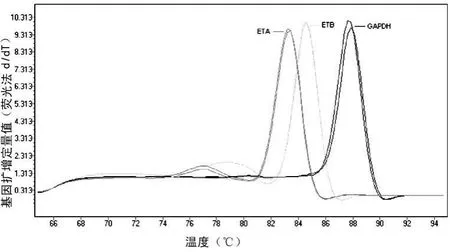
图2 目的基因和内参基因溶解曲线峰图
2.2 心衰患者和健康对照组血浆ET-1水平、ETA、ETB基因表达的比较 结果表明,心功能Ⅱ级组的血浆ET-1水平及ETA、ETB基因表达与健康对照组比较,两组差异无统计学意义(P>0.05)。心功能Ⅲ级+Ⅳ级组的血浆ET-1水平与健康对照组比较,两组差异具有统计学意义(F=8.014,P<0.01)。心功能Ⅲ级+Ⅳ级组的ETA基因表达与健康对照组比较,差异具有统计学意义(F=8.317,P<0.01);心功能Ⅲ级+Ⅳ级组的ETB基因表达与健康对照组比较,两组差异具有统计学意义(F=6.235,P<0.05)。此外,不同病因引起的心力衰竭之间血浆ET-1水平、ETA 、ETB基因表达等无显著性差异,可能与病例数较少有关,见表 1。
3 讨 论
ET是由血管内皮细胞分泌的一种血管收缩肽,缺氧、机械性应力、神经内分泌激素(如去甲肾上腺素、血管紧张素Ⅱ)、细胞因子(转化生长因子-β和白介素 1β)等[4]可以刺激血管内皮细胞释放ET-1。大量试验表明在心衰过程中ET-1的水平显著升高,它们的升高与心搏出量的减少、肺动脉高压、肺血管阻力的增高以及心脏的重构、肥厚和纤维化都有关[1-5]。心衰患者中,随着心功能的恶化,内皮依赖性舒张功能呈减退趋势[6]。ET的生物学效应就是由内皮特异受体介导的[7]。ET的受体有ETA和ETB两种亚型[8]。ETA受体存在于血管平滑肌细胞和心肌细胞中,调节血管收缩和细胞增生[9]。ETB受体存在于内皮细胞和血管平滑肌细胞,通常调节血管舒张;但在某些病理情况下,亦可引起血管收缩[10-11]。心衰时ETB还参与心肌纤维化的进展和循环中ET-1的清除[12]。发生心衰时内皮素受体介导的信号转导系统被显著激活,表现为ET受体的密度上调、ET-1结合位点增加、血浆ET-1水平随着心衰程度的加重而进行性升高[13-14]。
在心衰患者中,肺循环是ET-1的主要来源和清除部位,故肺血管阻力与循环ET-1水平直接相关[11]。本文结果显示,心衰患者血浆ET-1浓度明显升高,与NYHA心功能分级呈正相关。Lepailleur-endouf等[15]也发现,心衰患者失代偿期血浆ET-1分别是代偿期及对照组的4.2倍及6.9倍,本研究结果与其相似。本文结果还显示,心衰患者血浆ET受体基因表达与NYHA心功能分级和血液动力学有很大关系,心功能Ⅲ~Ⅳ级组患者ETA、ETB的基因表达水平明显高于心功能Ⅱ级组及健康对照组,即心功能愈差,ET受体基因表达升高愈显著。本研究中可看出,心衰患者血浆ET升高,外周血单个核细胞ETA、ETB表达上调,说明ET系统在心衰的促发及恶化方面起一定的作用。
[1]Cowburn PJ,Cleland JGF.Endothelin antagonists for chronic heant failure:dother have a role[J].Eurheart J,2001,22(19):1772-1784.
[2]Kiowski W,Sutsch G,Oechslin E,et al.Hem odynam ic efiects of bosentam in patients with chron icheart faihiue[J].Heart Fail Rev,2001,6(4):325-334.
[3]张天泰.内皮素系统在慢性心力衰竭中作用的研究进展[J].国外医学药学分册,2002,29(4):213-217.
[4]李天奇.内皮素与心衰[J].心血管病学进展,2005,26(1):17-20.
[5]龚生兰,施仲伟,于金德.充血性心力衰竭[M].上海:上海科学技术出版社,2004:44.
[6]彭艳,覃数,刘剑,等.血脂康对慢性心力衰竭患者血清TNF2A和血管内皮功能的影响[J].重庆医学,2009,38(14):1771-1772.
[7]Naruse M,Naruse K,Demura H.Recent advances in endothelin research on cardiovascular and endocrine systems[J].Endocr J,1994,41(5):491-507.
[8]Yamamoto S,Matsumoto N,Kanazawa M,et al.Different contributions of endothelin-A and endothelin-B receptors in postischem ic candiac dysfunction and norepinephrine overflow in rat heants[J].Circulation,2005,111(3):302-309.
[9]Ohlstein E,Douglas S.Endothelin-I modulates vascular smooth muscle structure and vasanotion:implications in cardiovascular pathology[J].Drug Dev Res,1993,29(2):108-128.
[10]Levin ER.Endothelins[J].N Eng J Med,1995,333(6):356-363.
[11]Benigni A,Rernuzzi G.Endothelin antagonists[J].Lancet,1999,353(9):133-138.
[12]Dupuis J,Stewart DJ,Cemacek P,et al.Human pulmonary circulation is an important site for both clearance and production of endothelin-1[J].Circulation,1996,94(7):1578-1584.
[13]Wei CM,Lennan A,Rodeheffer RJ,et al.Endothelin in human congestive heart failure[J].Circulation,1994,89(4):1580-1586.
[14]M ulder P,Richard V,Derumeaus C,et al.Role of endogenous endothelin in chronic heart failure.Effect of longterm treatment with an endothelin antagonist on survival,hemodynamics,and cardiac remodelling[J].Circulation,1997,96(6):1976-1982.
[15]Lepailleur-enouf D,Egidy G,Philippe M,et al.Pulmonary endothelinergic system in experimental congestive heart failure[J].Cardiovas Res,2001,49(2):330-339.
