Si4+和F−掺杂对LiNi1/3Co1/3Mn1/3O2结构和电化学性能的影响
2011-08-13张培新谭智博任祥忠
张培新, 张 利, 谭智博, 任祥忠
(深圳大学 化学与化工学院,深圳 518060)
自 OHZUKU 和 MAKIMURA[1]对 LiNi1/3Co1/3-Mn1/3O2正极材料研究报道以来,人们对其进行了大量的研究。LiNi1/3Co1/3Mn1/3O2综合了 LiNiO2、LiCoO2和 LiMnO2这三类材料的优点,形成了LiNi1/3Co1/3Mn1/3O2的共溶体系,存在明显的三元协同作用[2−3],具有循环性能和热稳定性好、成本低、污染少等优点,有望发展为新一代锂离子电池正极材料,并作为 LiCoO2的替代产品[4−5]。
然而,N i2+与 L i+离子半径相近,导致LiNi1/3Co1/3Mn1/3O2易发生“阳离子混排”现象,使材料的结构不稳定,进而使其电化学性能变差[6],影响了其更广泛的应用。目前的研究主要集中在LiNi1/3Co1/3Mn1/3O2的改性上,主要包括:1) 金属及非金属离子的体相掺杂;2) 在颗粒表面进行包覆,已有的研究证明掺杂和包覆等改性手段能有效提高LiNi1/3Co1/3Mn1/3O2正极材料的电化学性能和循环稳定性[7−11]。而在众多的阴阳离子中,F-的引入可以提高材料的循环性能[12],Si4+可以增加材料的结构稳定性。前期研究表明:离子半径小的元素取代主体元素后可以产生结构缺陷,利于 Li+的嵌入和脱出[13],由于 Si4+(40 pm)的半径小于 Ni2+的(69 pm)、Co3+的(74.5 pm)和Mn4+的(46 pm),所以,掺杂Si4+材料可以产生结构缺陷,进而提高正极材料的电化学性能。因此,本文作者采用 Si4+和 F−复合掺杂改性正极材料LiNi1/3Co1/3Mn1/3O2,以提高材料的结构稳定性和电化学性能。
LiNi1/3Co1/3Mn1/3O2的制备方法主要有固相反应法和液相化学法。固相反应法工艺简单,但材料的性能差;液相化学法可以制备性能优良的正极材料,但需要大量的溶剂和价格较高的原料,而且前躯体必须经过高温固相反应才能得到LiNi1/3Co1/3Mn1/3O2,且工艺复杂、成本高,提高原料的反应活性是制备高性能LiNi1/3Co1/3Mn1/3O2的关键。虽然通过硅氟离子改性LiNi1/3Co1/3Mn1/3O2材料的研究已有报道过[14],但通过机械力化学活化固相反应来制备改性的LiNi1/3Co1/3Mn1/3O2材料还未见报道,本文作者采用机械力化学活化固相反应制备了Si4+和F−掺杂阴阳离子复合掺杂的LiNi1/3Co1/3Mn1/3O2。
1 实验
以 Li2CO3、NiO、Co2O3、MnO2、LiF 和 SiO2为原料,将Li2CO3、NiO、Co2O3和MnO2按化学计量比混合,再分别加入一定量的LiF或SiO2置于玛瑙球磨罐中,以无水乙醇为介质,球磨数小时,合成掺杂 F或Si的前躯体。将球磨后的混合物与60 ℃烘干后,在850 ℃空气气氛下烧结20 h后得到掺杂后的样品LiNi1/3Co1/3Mn1/3O2−zFz、Li(Ni1/3Co1/3Mn1/3)1−zSizO2。复合掺杂的正极材料 Li(Ni1/3Co1/3Mn1/3)1−zSizO1.96F0.04是将Li2CO3、NiO、Co2O3、MnO2和LiF按照一定比例混合,再向其混合物中加入适量的SiO2得到。其中:z表示掺杂元素的摩尔分数,其值分别为0、0.02、0.04、0.08、0.12。
X射线衍射测试在Bruker D8-Advanced 型多晶X射线衍射仪上进行,Cu靶,扫描速度2.4 (°)/min,扫描范围10°~80°,步长0.04°;采用CHI 660A电化学工作站对电池进行电化学阻抗测试,频率范围为 10 mHz~100 kHz,并采用Zview拟合软件进行分析。
将上面合成的活性物质与乙炔黑、粘结剂 PVDF按质量比为85∶10∶5的比例混合,在NMP溶液中充分混合均匀,在一定温度下干燥,混合物成粘稠状后均匀地涂于铝箔上,干燥后冲片。将称重后的正极片作为正极,以金属锂片为负极,Celgard2400聚丙烯微孔膜为隔膜,以l mol/L LiPF6/EC+DMC(V(EC)/V(DMC)为 1∶2)混合液为电解液,在充满氩气的手套箱(Unilab型,德国)内组装成纽扣电池,静置数小时后,在LAND CT2001A电池性能测试系统上进行电化学性能测试。
2 结果与讨论
2.1 F掺杂对晶体结构及电化学性能的影响
图1所示为不同 F-掺杂量的 LiNi1/3Co1/3Mn1/3O2XRD谱。由图1可以看出,所有样品衍射峰明显,均具有 α-NaFeO2结构,说明F-掺杂并没有影响材料的晶型。随着z增大到0.04时,(006)/(102)与(108)/(110)两对分裂峰分裂最明显,当z继续增大到0.08与0.12时,XRD谱有杂峰出现, 这是因为当O2-被F-取代后,为了保持化合物的电荷平衡,过渡金属的平均价态降低,从而产生了新相,对于这个新相的研究需要进一步探索[15]。从表1可知,随着F-含量的增加,晶胞参数a逐渐增大,c先减小后增大,这主要是由于F−取代O2-后能够减小晶胞参数,因为F−的半径(1.34 Å)小于 O2-的半径(1.40 Å),然而,为了对 F−取代O2−的过程进行电荷补偿,过渡金属离子的平均价态就会降低,低价态的过渡金属离子的半径比高价态的大,这便导致晶胞参数的增大,晶体体积的膨胀[16−17]。当z=0.04时,c/a与 R值最大,表明 LiNi1/3Co1/3Mn1/3-O1.96F0.04具有较好的层状结构,且阳离子混排现象较轻。
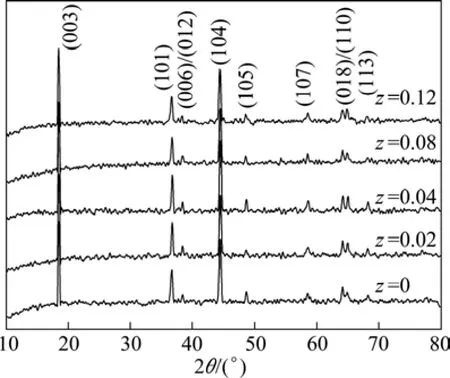
图1 LiNi1/3Co1/3Mn1/3O2−zFz的 XRD 谱Fig.1 XRD patterns of LiNi1/3Co1/3Mn1/3O2−zFz

表1 LiNi1/3Co1/3Mn1/3O2-zFz的结构参数Table 1 Characteristic parameter of LiNi1/3Co1/3Mn1/3O2−zFz

图2 LiNi1/3Co1/3Mn1/3O2−zFz首次与第40次充放电曲线Fig.2 First (a)and fortieth (b)charge-discharge curves of LiNi1/3Co1/3Mn1/3O2−zFz
图2所示为 LiNi1/3Co1/3Mn1/3O2-zFz在 0.5 C、3.0~4.4 V电压区间内的首次与第40次充放电曲线。可见,未掺杂的LiNi1/3Co1/3Mn1/3O2首次充放电比容量均较高,分别为186.3 mA·h/g与138 mA·h/g,首次放电效率为74.07%。随着z值的增加,材料的首次放电比容量与首次放电效率均减小,这是由于LiNi1/3Co1/3Mn1/3O2−zFz中有很强的 Li—F 键,它会阻碍Li+的嵌入[17]。但是,40次循环后,材料的循环性能随着z的增大,先提高后降低,当z增到0.04的时候,40次循环后材料的比容量与容量保持率达到最大,分别为 126.3 mA·h/g与 83.99%, 而 LiNi1/3Co1/3Mn1/3O2的只有115.9 mA·h/g与93.42%,这些现象的产生是由于强的Li—F键可以使活性材料免受电解液中HF的腐蚀[18]。当z值继续增大时,放电比容量与40次循环后的容量保持率减小。因此,适当掺杂 F会提高LiNi1/3Co1/3Mn1/3O2的循环性能。
2.2 Si掺杂对晶体结构及电化学性能的影响
图3所示为Li(Ni1/3Co1/3Mn1/3)1-zSizO2的XRD谱。由图3可知,各材料均具有α-NaFeO2典型结构,随着z值的增大,衍射峰强度先逐渐增大, 峰型变尖锐, 分裂变明显;当z值增大到0.08时,衍射峰开始宽化、峰强度变小,晶胞参数a、c随着Si掺杂量的增加而增加。由表2可以看出,a值由2.865(3)Å增大到2.872(3)Å,c值由14.362(5)Å增大到14.391(6)Å,晶胞参数增大使Li+能够更自由地在氧化物中移动,使得倍率性能有所提高[10]。并且c/a值与R值随着Si掺杂量的增加先增大后减小,当z=0.02时,这两个值都达到最大,表明z=0.02时材料的层状结构最好,阳离子混排现象较轻,从而提高材料的电化学性能。

图3 Li(Ni1/3Co1/3Mn1/3)1−zSizO2的 XRD 谱Fig.3 XRD patterns of Li(Ni1/3Co1/3Mn1/3)1−zSizO2

表2 Li(Ni1/3Co1/3Mn1/3)1−zSizO2样品的结构参数Table 2 Characteristic parameters of Li(Ni1/3Co1/3Mn1/3)1−z-SizO2
图4与5所示分别为在电压范围为2.8~4.4 V,0.5 C倍率下 Li(Ni1/3Co1/3Mn1/3)1−zSizO2的首次放电比容量与循环性能图。可看出,随着z值的增大,材料的首次放电比容量先增大后减小,其中Li(Ni1/3Co1/3Mn1/3)1.98Si0.02O2的首次放电比容量最高(145.9 mA·h/g),而 LiNi1/3Co1/3Mn1/3O2首次放电比容量为 138 mA·h/g, 比 Li(Ni1/3Co1/3Mn1/3)1.98Si0.02O2的首次放电比容量小约 10 mA·h/g。同时,Li(Ni1/3Co1/3-Mn1/3)1.98Si0.02O2材料经48次循环后,容量保持率高达95.82%,远远高于未掺杂材料的(83.19%)。而当 z值增大到0.08和0.12时,材料的放电比容量与循环性能明显恶化,这个结果与XRD的结果对应,a、c值逐渐增大可增大Li+的扩散通道,有利于Li+的自由移动,但当Si掺杂量继续增大时(z为0.08、0.12),a、c值也继续增大,材料的晶胞膨胀,导致晶胞畸变。从以上结果可以看出,掺杂少量的Si可提高材料的放电比容量、改善材料的循环性能。当z=0.02时,材料具有最佳性能。

图4 Li(Ni1/3Co1/3Mn1/3)1−zSizO2的首次放电曲线Fig.4 First discharge curves of Li(Ni1/3Co1/3Mn1/3)1−zSizO2

图5 Li(Ni1/3Co1/3Mn1/3)1−zSizO2的循环性能Fig.5 Cycling performances of Li(Ni1/3Co1/3Mn1/3)1−zSizO2
2.3 Si和F复合掺杂对晶体结构、形貌及电化学性能的影响
图6所示为 LiNi1/3Co1/3Mn1/3O2与 Li(Ni1/3Co1/3-Mn1/3)0.98Si0.02O1.96F0.04的XRD谱,其晶胞参数a与c值如表3所列。从图6可知,掺杂少量的F与Si基本没有影响材料的晶型,经过复合掺杂后,晶胞参数a、c均增大,说明掺杂离子已经进入了晶格。

图6 LiNi1/3Co1/3Mn1/3O与Li(Ni1/3Co1/3Mn1/3)0.98Si0.02-O1.96F0.04的XRD谱Fig.6 XRD patterns of LiNi1/3Co1/3Mn1/3O2(a)and Li(Ni1/3Co1/3Mn1/3)0.98Si0.02O1.96F0.04(b)

表3 Li(Ni1/3Co1/3Mn1/3)0.98Si0.02O1.96F0.04样品的结构参数Table 3 Characteristic parameters of Li(Ni1/3Co1/3Mn1/3)1−z-SizO1.96F0.04
图7所示为 Li(Ni1/3Co1/3Mn1/3)0.98Si0.02O1.96F0.04球磨活化前后的扫描电镜图谱。从图7中可以明显看出复合改性的正极材料在机械力活化固化前后的表面形貌变化,活化后的材料尺寸明显小于活化前的正极材料尺寸,分散也比较均匀。由此可知,经过机械力活化后的材料具有更小的粒径,也更有利于锂离子的脱出和嵌入,从而提高正极材料的放电比容量和循环性能。
图 8 所示为 Li(Ni1/3Co1/3Mn1/3)1−zSizO1.96F0.04在0.5 C、2.8~4.4 V条件下的循环性能。从图8中可以看出,Li(Ni1/3Co1/3Mn1/3)0.98Si0.02O1.96F0.04首次放电比容量达到最高,为 148.5mA·h/g,30次循环后容量保持率可达到99.12%。可见,适量Si掺杂可提高材料的循环性能。

图7 Li(Ni1/3Co1/3Mn1/3)0.98Si0.02O1.96F0.04活化前后的SEM像Fig.7 SEM images of Li(Ni1/3Co1/3Mn1/3)0.98Si0.02O1.96F0.04:(a)Before activation; (b)After activation

图8 Li(Ni1/3Co1/3Mn1/3)1−zSizO1.96F0.04的循环性能Fig.8 Cycling performances of Li(Ni1/3Co1/3Mn1/3)1−z-SizO1.96F0.04
图9所示为 LiNi1/3Co1/3Mn1/3O2与 Li(Ni1/3Co1/3-Mn1/3)0.98Si0.02O1.96F0.04前50次循环性能的对比(2.8~4.6 V、0.5 C),其电化学性能参数如表4所列。从图9中可知,Li(Ni1/3Co1/3Mn1/3)0.98Si0.02O1.96F0.04在高电压与高倍率充放电状态下具有较好的循环性能。结合晶胞参数变化的分析,掺杂少量的Si与F使晶胞参数增大,增大了晶胞的层间距,使 Li+的扩散速率得到提高,从而提高了材料的电化学性能。在充放电过程中,Si4+不参与电化学反应,从而使阳离子混排程度得到降低,同时Si4+在层状结构中起到了支撑作用,有利于充放电过程中晶体结构的稳定[19]。在复合掺杂的作用下,Li(Ni1/3Co1/3Mn1/3)0.98Si0.02O1.96F0.04首次放电比容量高达157.5 mA·h/g,50次循环后,容量保持率为96.19%,在循环过程中,最高的放电比容量高达173.3 mA·h/g。可见,适量的Si和F复合掺杂可以提高材料高电压及高倍率下的放电性能。

图9 LiNi1/3Co1/3Mn1/3O2与 Li(Ni1/3Co1/3Mn1/3)0.98Si0.02-O1.96F0.04的循环性能Fig.9 Cycling performances of LiNi1/3Co1/3Mn1/3O2 (a)and Li(Ni1/3Co1/3Mn1/3)0.98Si0.02O1.96F0.04 (b)at 2.8−4.6 V and 0.5 C

表4 Li(Ni1/3Co1/3Mn1/3)1−zSizO1.96F0.04的电化学性能Table 4 Electrochemical characteristics of Li(Ni1/3Co1/3-Mn1/3)1−zSizO1.96F0.04 at 2.8−4.6 V and 0.5C
图10所示为电池在2.8~4.4 V电压区间、0.5C倍率下进行充放电 2次与 20次后所得 LiNi1/3Co1/3-Mn1/3O2与Li(Ni1/3Co1/3Mn1/3)1.98Si0.02O1.96F0.04的交流阻抗谱图及相应的拟合图。从图中可以看到,曲线均由位于中高频区略为压缩的半圆和低频区约成 45°的直线组成。阻抗谱表现出3个区域:高频区对应Li+迁出表面膜的阻抗及表面膜的容抗,反映 Li+在表面膜中的迁移;中频区反映 Li+在膜和活性物质界面电荷的传递;低频区部分斜线反映 Li+在固体中的扩散[20−21]。可以看到,拟合曲线能较好地与阻抗实验值重合,且拟合误差较小,说明本研究所选用的等效电路能较好地描述锂离子在 LiNi1/3Co1/3Mn1/3O2电极中的脱嵌过程。在中高频区,LiNi1/3Co1/3Mn1/3O2第2次与第 20次循环的半圆相差明显,而 Li(Ni1/3Co1/3-Mn1/3)1.98Si0.02O1.96F0.04中高频区的两个半圆相差较小。LiNi1/3Co1/3Mn1/3O2第2次循环后的阻抗为38.21 Ω,20次循环后的阻抗增大到364 Ω,这说明电极表面传荷阻抗和界面电容随放电次数增加而不断增大,且在脱锂状态下易于电解液发生反应,致使表面钝化层不断增加,从而造成不可逆容量损失也相应增加。而Li(Ni1/3Co1/3Mn1/3)0.98Si0.02O1.96F0.04第 2次循环后的阻抗为14.7 Ω,20次循环后的阻抗仅增大到58.34 Ω,阻抗值与变化明显小于未掺杂材料的,可见,复合掺杂后电化学阻抗Rct明显得到了抑制,从而使界面反应不可逆容量的损失大大减小,循环性能得到提高。

图10 LiNi1/3Co1/3Mn1/3O2和 Li(Ni1/3Co1/3Mn1/3)1.98Si0.02-O1.96F0.04循环2次和20次后的交流阻抗谱Fig.10 Electrochemical impedance spectroscopy of LiNi1/3Co1/3Mn1/3O2 (a)and Li(Ni1/3Co1/3Mn1/3)1.98Si0.02O1.96-F0.04 (b)obtained after two and twenty cycles (1—Experimental value after 2 cycles; 2—Fitted value after 2 cycles; 3—Experimental value after 20 cycles; 4—Fitted value after 20 cycles)
3 结论
1) Si4+和F−掺杂可以提高材料的电化学性能,在2.8~4.4 V、0.5C倍率下,LiNi1/3Co1/3Mn1/3O1.96F0.04、Li(Ni1/3Co1/3Mn1/3)0.98Si0.02O2和 Li(Ni1/3Co1/3Mn1/3)0.98-Si0.02O1.96F0.04的首次放电比容量分别为135、145.9和148.5 mA·h/g。其中,Li(Ni1/3Co1/3Mn1/3)0.98Si0.02O1.96F0.04在30次循环后容量保持率为99.12%。
2) 当在高截止电压2.8~4.6 V、0.5 C倍率条件下,Li(Ni1/3Co1/3Mn1/3)0.98Si0.02O1.96F0.04首次放电比容量为157.5 mA·h/g, 在循环过程中,最高放电比容量达173.3 mA·h/g,50次循环后,容量保持率为96.19%,与纯LiNi1/3Co1/3Mn1/3O2材料相比,改性后的材料放电比容量与循环性能均得到改善。
[1]OHZUKU T, MAKIMURA Y. Layered lithium insertion material of LiNi1/3Co1/3Mn1/3O2for lithium-ion batteries[J]. Chem Lett,2001, 30(7): 642−644.
[2]杨 平, 张传福, 戴 曦, 樊友奇, 湛 菁, 蒋伟燕. 正极材料Li(Nil/3Col/3−xMnl/3)MxO2(M=Ti,Mg)的合成及性能[J]. 中国有色金属学报, 2009, 19(1): 101−107.YANG Ping, ZHANG Chuan-fu, DAI Xi, FAN You-qi, ZHAN Jing, JIANG Wei-yan. Synthesis of Li(Nil/3Col/3−xMnl/3)-MxO2(M=Ti, Mg)cathode material by oxalate precursor and its properties[J]. The Chinese Journal of Nonferrous Metals, 2009,19(1): 101−107.
[3]胡传跃, 郭 军, 汪形艳. 锂离子电池 Li(Ni3/8Co3/8Mn2/8)O2层状正极材料的制备与电化学性能[J]. 中国有色金属学报,2008, 18(9): 1721−1726.HU Chuan-yue, GUO Jun, WANG Xing-yan. Synthesis and electrochemical properties of layered Li(Ni3/8Co3/8Mn2/8)O2cathode material for lithium ion batteries[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(9): 1721−1726.
[4]杨 志, 李新海, 王志兴, 彭文杰, 郭华军. 高振实密度球形LiNi0.5Co0.3Mn0.2O2粉末的合成及性能[J]. 中国有色金属学报,2010, 20(1): 106−111.YANG Zhi, LI Xin-hai, WANG Zhi-xing, PENG Wen-jie, GUO Hua-jun. Synthesis and characterization of high tap-density spherical LiNi0.5Co0.3Mn0.2O2powders[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(1): 106−111.
[5]LIU L, SUN K N, ZHANG N Q, YANG T Y. Improvement of high-voltage cycling behavior of Li(Ni1/3Co1/3Mn1/3)O2cathodes by Mg, Cr, and Al substitution[J]. J Solid State Electrochem,2009, 13(9): 1381−1386.
[6]DING Y H, ZHANG P, JIANG Y, GAO D S. Effect of rare earth elements doping on structure and electrochemical properties of LiNi1/3Co1/3Mn1/3O2for lithium-ion battery[J]. Solid State Ionics,2007, 178(13/14): 967−971.
[7]王海燕, 唐爱东, 黄可龙, 荆 涛, 赵 薇. LiNi1/3Co1/3Mn1/3O2正极材料的制备与倍率性能研究[J]. 无机化学学报, 2008,24(4): 593−599.WANG Hai-yan, TANG Ai-dong, HUANG Ke-long, JING Tao,ZHAO Wei. Preparation and rate capability study of LiNi1/3Co1/3Mn1/3O2as cathode material[J]. Chinese Journal of Inorganic Chemistry, 2008, 24(4): 593−599.
[8]WANG M, WU F, SU Y F, CHEN S. Modification of LiCo1/3Ni1/3Mn1/3O2cathode material by CeO2-coating[J]. Sci China Ser E-Tech Sci, 2009, 52(9): 2737−2741.
[9]禹筱元, 胡国荣, 刘业翔.层状 LiNi1/3Co1/3Mn1/3O2正极材料的多元掺杂改性[J]. 中国有色金属学报, 2010, 11(6): 1170−1176.YU Xiao-yuan, HU Guo-rong, LIU Ye-xiang. Modification of layered LiNi1/3Co1/3Mn1/3O2cathode materials with doping multiple components[J]. The Chinese Journal of Nonferrous Metals, 2010, 11(6): 1170−1176.
[10]NA S H, KIM H S, MOON S I. The effect of Si doping on the electrochemical characteristics of LiNixMnyCo(1−x−y)O2[J]. Solid State Ionics, 2005, 176(3/4): 313−317.
[11]LI J G, FAN M S , HE X M, ZHAO R S, JIANGE C Y, WAN C R . TiO2coating of LiNi1/3Co1/3Mn1/3O2cathode materials for Li-ion batteries[J]. Ionics, 2006, 12(3): 215−218.
[12]YE S Y, XIA Y Y, ZHANG P W, QIAO Q. Al, B, and F doped LiNi1/3Co1/3Mn1/3O2as cathode material of lithium-ion batteries.J Solid State Electrochem, 2007, 6(11): 805−810.
[13]张培新, 林木崇, 张冬云, 袁秋华, 任祥忠. Zr4+掺杂对LiFePO4电化学性能及微观缺陷的影响[J]. 功能材料, 2010,41(4): 726−729.ZHANG Pei-xin, LIN Mu-chong, ZHANG Dong-yun, YUAN Qiu-hua, REN Xiang-zhong. Effects of doping Zr4+on the electrochemical Performances an micro-defect of LiFePO4[J].Journal of Functional Materials, 2010, 41(4): 726−729.
[14]HUANG Y J, GAO D S, LEI G T, LI Z H, SU G Y. Synthesis and characterization of Li(Ni1/3Co1/3Mn1/3)0.96Si0.04O1.96F0.04as a cathode material for lithium-ion battery[J]. Materials Chemistry and Physics, 2007, 106(2/3): 354−359.
[15]KAGEYAMA M, LI D, KOBAYAKAWA K, SATO Y, LEE Y S.Structural and electrochemical properties of LiNi1/3Mn1/3-Co1/3O2−xFxprepared by solid state reaction[J]. Journal of Power Sources 2006, 157(1): 494−500.
[16]唐致远, 余明远, 薛建军, 高 飞. 溶胶凝胶法制备LiNi0.01Co0.01Mn1.98O3.95F0.05及其电化学性能[J]. 化工进展,2007, 26(3): 396−399.TANG Zhi-yuan, YU Ming-yuan, XUE Jian-jun, GAO Fei.Synthesis of LiNi0.01Co0.01Mn1.98O3.95F0.05by sol-gel route for lithium secondary battery and its electrochemical properties[J].Chemical Industry and Engineering Progress, 2007, 26(3):396−399.
[17]黄原君, 高德淑, 李朝晖, 雷钢铁, 苏光耀.LiNi1/3Co1/3Mn1/3O2的Si/F复合掺杂及电化学性能[J]. 无机化学学报, 2007, 23(3): 466−472.HUANG Yuan-jun, GAO De-shu, LI Zhao-hui, LEI Gang-tie,SU Guang-yao. Electrochemical performances of the layered cathode material LiNi1/3Co1/3Mn1/3O2doped with Si/F ions[J].Chinese Journal of Inorganic Chemisty, 2007, 23(3): 466−472.
[18]KIM J M, CHUNG H T. Role of transition metals in layered Li[Ni, Co, Mn]O2under electrochemical operation[J].Electrochimica Acta, 2004, 49(21): 3573−3580.
[19]YOSHIO M, NOGUCHI H, ITOH J, OKADA M, MOURI T.Preparation and properties of LiCoyMnxNi1−x−yO2as a cathode for lithium ion batteries[J]. J Power Sources, 2000, 90(2): 176−181.
[20]GUO R, SHI P F, CHENG X Q, DU C Y. Synthesis and characterization of carbon-coated LiNi1/3Co1/3Mn1/3O2cathode material prepared by polyvinyl alcohol pyrolysis route[J].Journal of Alloys and Compounds, 2009, 473(1/2): 53−59.
[21]LI J G, WANG L, ZHANG Q, HE X M. Electrochemical performance of SrF2-coated LiNi1/3Co1/3Mn1/3O2cathode materials for Li-ion batteries[J]. Journal of Power Sources, 2009,190(1): 149−153.
