孤立性纤维性肿瘤48例临床病理特征分析
2011-08-08顾永耀贺菽嘉曾晶晶党裔武
顾永耀 贺菽嘉 曾晶晶 党裔武
孤立性纤维性肿瘤(solitary fibrous tumor,SFT)是一种较为少见的梭形细胞肿瘤,由Klemperer和Rabin[1]于1931年首先描述,以往也称为“局限性纤维性间皮瘤”、“胸膜下纤维瘤”等。近年研究发现,SFT并非仅限于胸膜,而是可以发生于身体各处,组织学形态多样,生物学行为难以预测[2]。为了更好地认识此类肿瘤,我们收集48例SFT病例并对其临床表现、形态学特点、免疫表型特征及预后进行了分析和探讨。
1 资料与方法
1.1 一般资料 收集广西医科大学第一附属医院病理科2005年1月~2010年6月间手术标本及会诊病例中诊断为SFT的病例,由2位副主任或主任医师参照2002年版WH0软组织肿瘤分类标准独立阅片确诊。
1.2 方法 所有标本经10%中性福尔马林固定、常规石蜡包埋、3~5µm厚连续切片,HE染色。免疫组采用Elivision二步法,二氨基联苯胺(DAB)显色,苏木精衬染。选用一抗包括Vimentin、CD34、Bcl-2、CD99、SMA、Desmin、S-100、CD117、Calretinin、EMA。所用一抗及Elivision试剂盒均购自福建迈新公司。
1.3 统计分析 统计分析软件为SPSS16.0,两样本均数比较用Studentt检验,构成比比较用Fisher’s确切概率法检验,P<0.05有统计学差异。
2 结果
2.1 临床特征 发病年龄为11~73岁,平均43岁。其中男性27例,女性21例,男女比例约1.3∶1。初发45例,复发3例。肿瘤位于胸膜4例,胸膜外44例,其中皮下软组织23例(前胸壁7例,腋下3例,下肢3例,臀部2例,腹壁2例,腰部2例,肩胛2例,上肢1例,头枕部1例),颅内3例(小脑鞍区1例,第四脑室1例,左中后颅窝1例),眼眶、盆腔各3例,腹腔、肾脏、鼻腔、肺脏各2例,纵隔、咽部、颌下腺、甲状腺各1例。临床无症状或为部位相关性压迫症状。1例恶性胸膜SFT出现低糖血症,血糖水平在肿瘤切除后恢复正常。本组病例良性38例,恶性10例,两者临床病理特征比较见表1。
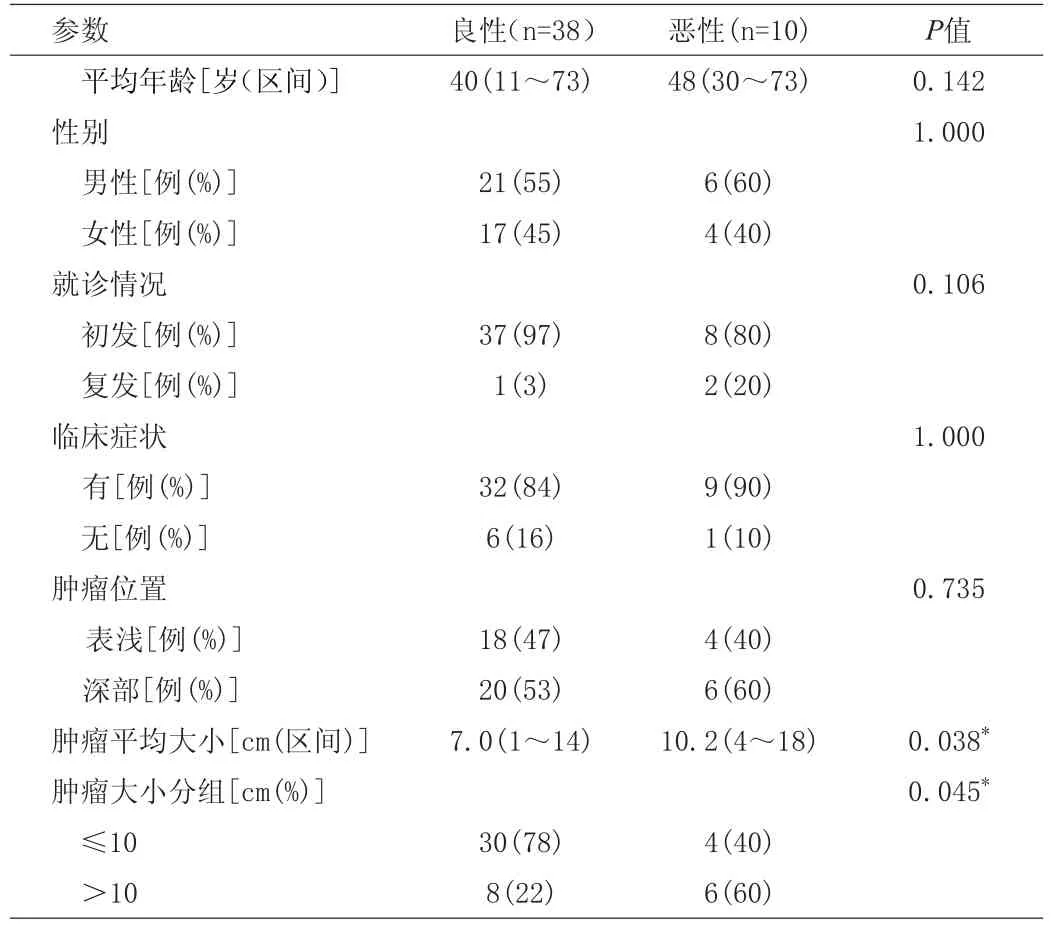
表1 良、恶性孤立性纤维性肿瘤临床病理特征比较
2.2 病理检查
2.2.1 大体特点 肿瘤最大径为1~18cm,平均7.7cm。大部分肿瘤边界清楚,其中16例可见部分或较完整假纤维性包膜。切面多为灰白色实性,19例呈多结节状,8例见漩涡状结构。质地中等至偏韧。
2.2.2 组织学特点 瘤细胞似纤维/肌纤维母细胞,大小较一致,胞界欠清,胞质稀少;核长卵圆形,空泡状,染色质细腻,核仁不明显。34例见肿瘤细胞密集区和疏松区相间,排列呈束状、编织状或无模式化。31例间质内可见粗细不等胶原纤维穿行,细胞稀疏区较易见到瘢痕样、玻璃样变的粗大胶原束(图1)。28例可见鹿角状分枝薄壁血管及血管外皮细胞瘤样结构(图2)。少数病例见粘液样变(11/48)、小囊性变(6/48)、小灶状出血(6/48)、成熟脂肪细胞(4/48)和淋巴细胞浸润(4/48)。
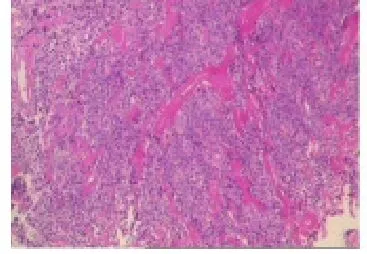
图1 粗细不等胶原纤维穿行(HE×100)
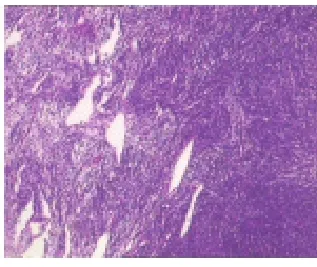
图2 血管外皮瘤样结构(HE×100)
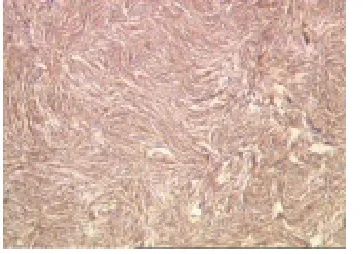
图3 CD34弥漫强阳性(Elivision二步法×100)
2.2.3 免疫表型 Vimentin阳性率100%(36/36)。CD34阳性率94%(45/48),其中35例为胞质弥漫强阳性(图3),10例为灶性阳性,3例阴性病例中2例为恶性,1例为良性。Bcl-2、CD99阳性率分别为79%(38/48)、67%(32/48)。SMA阳性率5%(2/40),呈小灶状胞质阳性。Desmin、S-100、CD117、Calretinin及EMA均为阴性。
2.3 随访资料 48例均经手术切除肿瘤。术后回访病例36例,随访时间4~63个月,平均随访29.4个月。33例无瘤生存。3例复发,其中2例初诊为恶性,1例为良性。所有病例均无远处转移。
3 讨论
孤立性纤维性肿瘤(solitary fibrous tumor,SFT)是一种特殊的软组织肿瘤,组织学起源尚未明确。多数学者认为起源于原始间叶细胞,并具有向纤维母细胞、肌纤维母细胞分化的特征[2-3]。
3.1 临床特征 SFT一般多见于20~70岁成年人,平均年龄50岁,但也有发生于儿童和青少年的报道。无明显性别差异。本组病例累及13个部位,可分为胸膜组 (solitary fibrous tumor of pleura,SFTP)和胸膜外组(extrapleural solitary fibrous tumor,ESFT)。ESFT位于皮下软组织最多,其次为眼眶、颅内和盆腔,腹腔、肾脏、鼻腔等部位相对少见,与文献报道相符[4]。ESFT并不少见,与SFTP具有相似的组织学形态、免疫表型、超微结构及生物学行为特征[5-6]。临床常为部位相关性压迫症状。Briselli等[7]报道在4%的SFT病例中可出现非胰岛细胞肿瘤性低糖血症,也称为 Doege-Potter综合征,由SFT产生高分子量胰岛素样生长因子Ⅱ(insulin-like growth factor II,IGF-II)介导,并与肿瘤体积巨大或侵袭性行为有关[8]。
3.2 病理学特征 SFT大小相差悬殊,小者0.5cm,大者可达39cm,多数小于10cm。大部分肿瘤境界清楚,切面灰白色结节状。SFT组织学形态多样,本组病例基本特征为形态温和的纤维母细胞样细胞呈无模式化(patternless pattern)排列,其他诊断性线索包括细胞密疏区相间、间质胶原纤维穿行和血管外皮细胞瘤样结构。恶性病例占21%(10/48),组织学形态呈现不同程度细胞密集、多形性及坏死,核分裂像>4/10HPF。与良性病例比较,恶性者瘤体更大(P=0.038),在发病年龄、就诊情况、临床症状等方面无差异。2例局部复发的恶性SFT病例瘤体均大于10cm,印证了大于10cm的SFT更易发生复发或转移的观点[9]。在经典形态SFT之外,有研究者报道了粘液型[10]、双相型/上皮样[11]和去分化型[12],使SFT形态学谱系日益拓宽,也对诊断提出了挑战。
Vimentin+/CD34+/bcl2+/CD99+是SFT主要免疫表型,少数病例表达SMA。CD34是目前最有价值的SFT诊断性标记物,常呈胞质弥漫强阳性表达,但也可灶状表达或无表达。有研究者报道[12-13]少数CD34-/CK+SFT,多为恶性,提示CD34表达缺失与侵袭性生物学行为相关。CD34、bcl-2、CD99三者均缺乏特异性,也可表达于隆突性皮纤维肉瘤、黏液炎症性纤维母细胞肉瘤等多种肿瘤。因此,SFT诊断需要结合临床表现和组织学形态,合理选择免疫标记组合并正确判读结果。
3.3 鉴别诊断 (1)血管外皮细胞瘤(haemangioperi cytoma,HPC):目前认为,以往诊断的HPC大多为富于细胞型SFT,而“真性”HPC非常少见,应作为排除性诊断。Weiss在2008年版软组织肿瘤中将“血管外皮瘤-孤立性纤维性肿瘤”作为整体进行介绍,涵盖了经典HPC和SFT以及脂肪瘤样、脑(脊)膜和伴巨细胞三种亚型。(2)肉瘤样间皮瘤:免疫组化CK5/6、Calretinin通常阳性,而CD34阴性。电镜检查瘤细胞呈现细长的微绒毛是诊断间皮瘤的“金标准”。(3)单相型滑膜肉瘤:多发生膝关节周围,瘤细胞常呈鱼骨样排列,广泛取材多能找到灶状上皮样区域。免疫组化CK、EMA灶性表达,CD34一般不表达。采用FISH或RT-PCR方法检测SYT-SSX融合基因,有助于鉴别少数CD34-CK+表型的SFT。(4)隆突性皮纤维肉瘤:瘤细胞常呈CD34弥漫强阳性,可通过特征性席纹状(Storiform)排列、蜂窝状浸润图像、紧密围绕汗管等皮肤附件加以鉴别。(5)神经鞘瘤:肿瘤与神经关系密切。瘤细胞呈现施万细胞形态特征,可见Antoni A区和Antoni B区。免疫组化S-100弥漫阳性,定位于核和胞质,CD34阴性。(6)梭形细胞脂肪瘤:瘤细胞间常见较多肥大细胞、绳索样胶原纤维、缺乏玻璃样变血管可资鉴别。(7)深部纤维组织细胞瘤:瘤细胞呈楔状延伸入皮下脂肪组织,常伴有黄色瘤细胞,免疫组化FⅩⅢa阳性,CD34阴性。
3.4 治疗与预后 手术完整切除肿瘤是目前最好的SFT治疗手段。术后5年总体生存率为70%~97.5%,复发率为5%~18%,转移率为0~24%;复发和转移以恶性组更多见,但良性SFT也可发生[14-17]。Mohamed[18]报道1例良性SFT病例,在25a随访过程中经历4次复发并发生恶性转变。本组随访病例复发率为8.3%,1例初诊为良性,术后14个月复发,未见恶性转变,可能由肿瘤切除不完全引起。由于随访时间较短,未见转移及死亡。因此,SFT应视为中间型/交界性肿瘤,鉴于组织学形态并不能完全准确地反映肿瘤的生物学行为,预后难以预测,对所有SFT病例进行长期随访非常必要。
[1]Klemperer P, Rabin CB. Primary neoplasms of the pleura: a report of 5 cases[J]. Arch Pathol, 1931,11:385-394.
[2]Chan JK. Solitary fibrous tumour-everywhere, and a diagnosis in vogue[J]. Histopathology, 1997,31(6):568-576.
[3]Ide F, Obara K, Mishima K, et al. Ultrastructural spectrum of solitary fibrous tumor: a unique perivascular tumor with alternative lines of differentiation[J]. Virchows Arch,2005, 446(6):646-652.
[4]Insabato L,Siano M, Somma A,et al.Extrapleural solitary fibrous tumor: a clinicopathologic study of 19 cases[J]. Int J Surg Pathol,2009,17(3):250-254.
[5]Brunnemann RB,Ro JY,Ordonez NG,et al.Extrapleural solitary tumor:a clinicopathologic study of 24 cases[J].Mod Pathol,1999,12(11):1034-1042.
[6]Gengler C, Guillou L.Solitary fibrous tumour and haemangiopericytoma: evolution of a concept[J].Histopatholo gy,2006,48(1):63-74.
[7]Briselli M, Mark EJ, Dickersin GR. Solitary fibrous tumors of the pleura: eight new cases and review of 360 cases in the literature[J].Cancer,1981,47(11):2678-2689.
[8]Zafar H, Takimoto CH, Weiss G. Doege Potter syndrome:hypoglycemia associated with malignant solitary fibrous tumor[J]. Med Oncol,2003,20(4):403-408.
[9]Gold JS, Antonescu CR, Hajdu C,et al.Clinicopathologic correlates of solitary fibrous tumors[J].Cancer, 2002,94(4):1057-1068.
[10]Lau SK, Weiss LM, Chu PG. Myxoid solitary fibrous tumor: a clinicopathologic study of three cases[J].Virchows Arch,2009,454(2):189-194.
[11]Awasthi R, O'neill JK, Keen CE, et al. Biphasic solitary fibrous tumour: a report of two cases with epithelioid features[J]. Virchows Arch,2006, 448(3):306-310.
[12]Mosquera JM, Fletcher CD.Expanding the spectrum of malignant progression in solitary fibrous tumors.A study of 8 cases with a discrete anaplastic component-Is this dedifferentiated SFT?[J].Am J Surg Pathol,2009,33(9):1314-1321.
[13]Schirosi L, Lantuejoul S, Cavazza A, et al.Pleuro-pulmonary solitary fibrous tumors: a clinicopathologic, immunohistochemical, and molecular study of 88 cases confirming the prognostic value of de Perrot staging system and p53 expression, and evaluating the role of c-kit,BRAF, PDGFRs [alpha/beta], cmet, and EGFR[J]. Am J Surg Pathol,2008,32(11):1627-1642.
[14]Cranshaw IM, Gikas PD, Fisher C, et al.Clinical outcomes of extra-thoracic solitary fibrous tumours[J].Eur J Surg Oncol,2009,35(9):994-998.
[15]Magdeleinat P, Alifano M, Petino A,et al.Solitary fibrous tumors of the pleura: clinical characteristics, surgical treatment and outcome[J].Eur J Cardiothorac Surg, 2002,21(6): 1087-1093.
[16]England DM,Hochholzer L,McCarthy MJ. Localized benign and malignant fibrous tumours of the pleura. A clinicopathologic review of 223 cases[J]. Am J Surg Pathol,1989,13(8):640-658.
[17]Cardillo G, Carbone L,Carleo F,et al.Solitary fibrous tumors of the pleura: an analysis of 110 patients treated in a s ingle institution[J].Ann Thorac Surg,2009,88(5): 1632-1637.
[18]Mohamed H, Mandal AK.Natural history of multifocal solitary fibrous tumors of the pleura: a 25-year follow-up report[J].J Natl Med Assoc, 2004,96(5):659-664.
