高铜对山羊红细胞膜磷脂组分和膜流动性的影响
2011-08-08张久丽唐宏伟孙红梅徐世文
张久丽,唐宏伟,孙红梅,徐世文*
(1.东北农业大学动物医学学院,哈尔滨 150030;2.黑龙江科技职业学院,黑龙江 双城 150100)
微量元素铜为生物机体必需的微量元素之一,对机体的生理功能和生长发育起着十分重要的作用。铜存在于30多种酶中参与机体的氧化磷酸化、自由基解毒、黑色素合成、儿茶酚胺代谢、结缔组织交联、血液凝固及毛发形成等过程,并能维持组织细胞的稳定性[1-2],所以铜在保证动物健康生长和提高生产力方面起着重要的作用,故广泛地应用于动物饲料中。铜也是重要的化工、金属原料和医药原料,普遍地应用于工业、农业和医药领域。因此,如饲料中添加过量或工业废物中铜超标会引起动物铜中毒,并间接通过食物链危害人类健康。当反刍动物机体摄入过量的铜,或是饲料中钼、硫、钙、锌等元素含量明显减少,以及肝细胞受到损害之后,均易引起铜在体内特别是肝脏的大量蓄积,从而产生毒性作用,引发铜中毒[3]。铜中毒在山羊较为严重,溶血是其主要特征。目前关于高铜对山羊红细胞膜磷脂的损伤和膜流动性的影响还未见报道,因此本试验以体外培养山羊红细胞为研究对象,通过向培养液中加入不同浓度的铜,探讨高铜对山羊红细胞膜磷脂组分和膜流动性的影响,为进一步认识高铜致红细胞溶破机制提供试验依据。
1 材料与方法
1.1 红细胞悬液的制备、培养及处理
10~14个月健康山羊5只,颈静脉无菌采血,肝素抗凝,无菌收集红细胞,2 500 r·min-1,离心10 min,弃去上清液,加10%的RPMI1640培养液洗涤两次。将细胞稀释成1×106个·mL-1,分别加终浓度为 10、20、30、40 和 50 μmol·L-1的 CuSO4,培养48 h后收集细胞。
1.2 红细胞膜的制备方法
制备原理是在低渗条件下胀破红细胞,离心后反复洗涤去除血红蛋白,即获红细胞膜。具体操作如下:取红细胞悬液20 mL,2 000 r·min-1离心10 min,弃去上清,加10 mL生理盐水混匀,重复3次,在留下的红细胞层中,加入预冷的10 mmol·L-1Tris-HCl pH 7.4的缓冲液,混匀4℃放置40 min,使其充分溶血,用高速冷冻离心机12 000 r·min-1,离心20 min,弃去含血红蛋白的上清层,留沉淀,此过程重复3次,向红细胞膜中加50 mmol·L-1Tris-HCl pH 7.4的缓冲液悬浮,-70℃保存备用。
1.3 红细胞膜磷脂组分分析方法
1.3.1 红细胞膜磷脂的提取
取0.5 mL红细胞膜悬浮液,加入5.5 mL预冷的异丙醇,振匀后放冰箱冷藏15 min,取出后置室温1 h,每隔10 min振匀1次。再加入3.3 mL预冷的三氯甲烷,振匀后置于冰箱内冷藏15 min,取出后置室温1 h,每隔10 min振匀1次。3 500 r·min-1离心15 min,吸出全部上清液,在50℃水浴中减压蒸干。
1.3.2 磷脂薄层层析及定性
加200 μL异丙醇于提取磷脂的圆底烧瓶中以溶解提取的磷脂,将溶液吸出注入小试管中。用不活化的硅胶G板展层,上样量标准品为1 μL,样品为 3 μL。展层剂为氯仿∶异丙醇∶水=65∶25∶4。放于110℃烘箱中烘干,取出用碘蒸气熏显色,得到薄层层析图。标准品配成1μL∶1μ L的异丙醇标准液。
磷脂组分的定量分析用岛津CS-930型光密度扫描仪扫描,波长660 nm,狭缝6 mm×0.2 mm,积分后求得各磷脂组分含量。
1.4 红细胞膜流动性测定方法
采用李长顺等的方法[4],测定淋巴细胞膜的荧光偏振度(P),并计算成微粘度(η),η值与膜流动性呈反比。
1.5 数据的统计
所有数据用SAS for Windows 6.12软件进行统计分析,用平均值±标准差(X±S)表示。
2 结果与分析
2.1 铜对红细胞膜磷脂影响的检测结果
细胞膜PE百分含量随染铜剂量的增加逐渐降低,与对照组相比,10 μmol·L-1差异不显著(P>0.05),20 μmol·L-1差异显著(P<0.05),其他各组差异均极显著(P<0.01)。PS百分含量随染铜剂量的增加逐渐增加,与对照组相比,除10、20 μmol·L-1差异不显著(P>0.05)外,其他各组差异均极显著(P<0.01)。SM百分含量随染铜剂量的增加逐渐增加,与对照组相比,10 μ mol·L-1差异不显著(P>0.05),其他各组差异均极显著(P<0.01)(见表1和图1)。

表1 铜对红细胞膜磷脂影响的结果Table 1 Results of copper on phospholipid on erythrocytic membrane (%)
2.2 铜对红细胞膜流动性影响的检测结果
2.2.1 铜对红细胞膜荧光偏振度(P)影响的检测结果
加铜组红细胞膜荧光偏振度随铜剂量的增加逐渐升高,与对照组间相比差异均显著(P<0.05)或极显著(P<0.01)(见表 2)。

图1 各组红细胞膜磷脂组分薄层层析图谱Fig.1 Thin-layer chromatogram on phospholipid on erythrocytic membrane
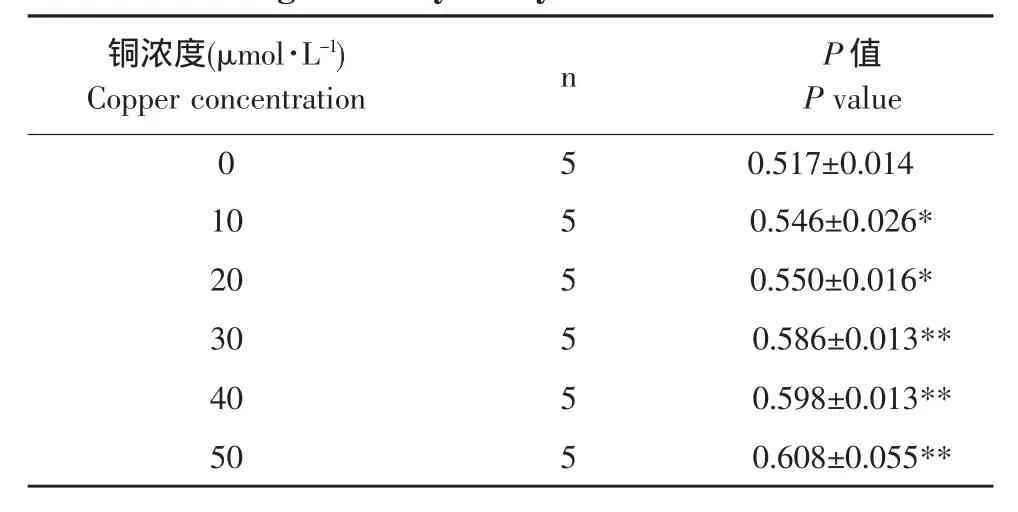
表2 铜对红细胞膜荧光偏振度影响的检测结果Table 2 Results of copper on fluorescence polarizationdegree of erythrocytic membrane
2.2.2 铜对红细胞膜微粘度影响的检测结果
加铜组红细胞膜微粘度随铜剂量的增加逐渐增加,10 μmol·L-1、20 μmol·L-1与对照组比较差异不显著(P>0.05),其他各组与对照组比较差异极显著(P<0.01)(见表 3)。

表3 铜对红细胞膜η值影响的检测结果Table 3 Results of copper on micro-consistency of erythrocytic membrane
3 讨论
红细胞膜磷脂含量(占60%)较其他生物膜高,磷脂含量及其组分的正常是保证膜生理功能的重要因素。细胞膜中不同磷脂在膜脂质内外层中的分布是不对称的,PE主要在细胞膜的内层,PC主要在细胞膜的外层,这种磷脂排列的有序性是保证膜磷脂正常流动性的必要条件[5],同时PE中脂肪酸的不饱和程度较高,是维持细胞膜稳定性的重要物质[6]。而膜流动性是细胞膜的重要生物学特性,是细胞膜功能完整的重要参数,可以敏感地反映细胞膜状态,细胞膜的流动性影响完整的膜蛋白定向、膜渗透性和跨膜转运过程等,而细胞脂质过氧化水平的提高能够影响细胞膜的流动性[7]。
研究表明由低磷发展至溶血,红细胞形态从正常的圆盘状→棘形→球形→溶破的演变过程,发生血管内溶血时,其红细胞膜磷脂组分、骨架蛋白及红细胞形态发生显著改变,是导致溶血的最关键性因素[8]。低硒组奶牛全血中几种重要的抗氧化酶-谷胱甘肽过氧化物酶、超氧化物歧化酶、过氧化氢酶活力明显下降;细胞膜蛋白质含量明显低于对照组,其他物理特性也有所改变,表现为在低硒条件下红细胞膜流动性降低、微黏度增加、渗透脆性增加、离子泵活力下降[9]。
本试验研究结果显示,加铜组山羊红细胞膜PE的含量低于对照组,PS与SM的含量高于对照组,红细胞膜荧光偏振度和微粘度增加明显,流动性明显降低。表明高铜使红细胞膜磷脂原有的正常排列和组合发生改变,PE减少,膜双层结构稳定性被破坏,因此膜流动性显著降低。动物体内的铜代谢紊乱时常有一价铜的大量产生,生成的一价铜通过Haber-Werss反应促进体内羟自由基形成,从而使机体发生氧自由基的损伤[11]。过量铜能引起山羊红细胞渗透脆性增加,红细胞溶血度增加,使红细胞损伤加重[10]。因此分析红细胞在高铜环境下,红细胞抗氧化功能降低,自由基产生增多,红细胞膜脂质双分子层发生改变,造成膜结构破坏,进而使膜上镶嵌的一系列酶空间排列紊乱,活性降低,进而导致膜流动性改变,继而红细胞膜稳定性、形态、变形性都有所改变,从而引起溶血现象。以上的研究结果提示高铜可引起膜磷脂组分含量的改变与膜流动性的改变,这在铜中毒的发生、发展中起一定的作用,可能是高铜致羊红细胞溶破的机制之一。而高铜对红细胞膜蛋白及抗氧化功能的影响及高铜致红细胞溶破的其他机制仍需进一步研究。
*唐宏伟为本文的同等贡献者。
[1] Bonham M,O'Connor J M,Hannigan B M,et al.The immune system as a physiological indicator of marginal copper status[J].British Joumal of Nutrition,2002,87(3):393-403.
[2] 柴春彦,石发庆,刘国艳,等.摇摆病奶牛体内铜状态及其与NO水平的关系[J].黑龙江畜牧兽医,2001(7):1-3.
[3] 杨德才,王哲,姜玉富.家畜铜中毒研究进展[J].动物医学进展,2005,26(4):27-30,57.
[4] 李长顺,和水祥,刘恩岐.硒对慢性肝病患者外周血单个核细胞膜流动性的影响[J].西安交通大学学报:医学版,2003,24(2):131-132.
[5] 张之南,李蓉生.红细胞疾病基础与临床[M].北京:科技出版社,2000:98-100.
[6] DiL,LiuW,LiuY.Effectofasymmetricdistributionofphospholipids in ghost membrane from rat blood on peroxidation induced by ferrous ion[J].FEBS Lett,2004,580(2):685-690.
[7] Rosario J,Sathedand E,Zaccaro L,et a1.Ethinylestradiol administration selectively alters liver sinusoidal membrane lipid fluidity and protein composition[J].Biochemistry,1988,27(11):3939-3946.
[8] Shi F Q,Xuan D W,Xu S W,et al.The molecular mechanism in the damag of erythrocyte membrane of the cows with hemoglobinuria[J].Journal of Northeast Agricultural University:English Edition,2002,9(2):117-127.
[9] 张馨心,刘文丽,华秋东,等.硒与奶牛红细胞膜功能的关系研究[J].东北农业大学学报,2009,40(1):54-60.
[10] 唐宏伟,张久丽,肖银霞,等.铜胁迫对山羊红细胞渗透脆性和溶血度的影响[J].中国兽医学报,2008,28(1):87-89.
[11] 王德海,程国富.铜抗氧自由基作用的研究进展[J].微量元素与健康研究,2001,18(4):70-73.
