肝脏X受体激活对α-GalCer诱导的小鼠肝损伤保护机制探讨*
2011-08-06卞兆连韩小凤王绮夏邱德凯
刘 渊 卞兆连 韩小凤 王绮夏 邱德凯 马 雄
上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所(200001)
自身免疫性肝炎(AIH)是由异常自身免疫反应介导的肝实质炎症性病变,以高丙种球蛋白血症、血清自身抗体阳性和对免疫抑制治疗有应答为特点[1,2],其病因和发病机制目前尚不清楚。大量研究发现AIH患者肝脏内有大量激活的淋巴细胞浸润,并分泌高水平促炎细胞因子,这些淋巴细胞和炎症介质在肝脏炎症损伤过程中起重要作用[3]。α-半乳糖神经酰胺(α-GalCer)为不变型Vα14自然杀伤T细胞(NKT细胞)的特异性配体,可诱导免疫介导的肝损伤小鼠模型,模型小鼠血清转氨酶水平升高,肝小叶内大量炎性细胞浸润,肝细胞变性坏死,其特点与人类AIH极为相似。研究[4]发现予C57BL/6小鼠注射α-GalCer可诱导明显的细胞因子反应,包括肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)、白细胞介素-2(IL-2)、IL-4、IL-6 等。
肝脏X受体(LXR)属于核受体超家族成员,对脂类代谢相关基因的转录调控起关键作用。近年研究发现LXR还具有调节免疫反应和抗炎效应。在接触性皮炎、动脉粥样硬化、自身免疫性脑脊髓炎小鼠模型中,LXR激动剂可有效抗炎、抑制炎症基因表达,调节免疫反应[5 ~ 7]。本研究通过观察LXR激动剂对α-GalCer诱导的小鼠肝损伤的影响,探讨LXR激活对肝损伤的保护作用及其可能机制,为进一步了解AIH的发病机制、探索AIH的潜在治疗靶点提供实验依据。
材料与方法
一、实验动物和主要试剂
雄性清洁级C57BL/6J小鼠15只,6 ~ 8周龄,体质量18 ~ 22 g,由中科院上海实验动物中心提供,饲养于上海交通大学医学院实验动物科学部实验动物饲养中心。标准商业饲料购自上海斯莱克实验动物有限责任公司。
LXR激动剂T0901317(Cayman Chemical Company),α-GalCer Analog 7(AXXORA®Platform),即用型免疫组化超敏UltraSensitiveTMSP试剂盒(福州迈新生物技术开发公司),羊抗鼠IL-6多克隆抗体(Santa Cruz Biotechnology,Inc.),蛋白抽提试剂盒(碧云天生物技术研究所),小鼠 Akt、p-Akt、IκBα、p-IκBα、PI3K (p85)、NF-κB (p65)抗 体 (Cell Signaling Technology,Inc.),TRIzol®试剂(InvitrogenTMby Life Technologies),PrimeScriptTMRT reagent Kit(Perfect Real Time)、SYBR®Premix Ex TaqTM(Perfect Real Time)(TaKaRa Bio Inc.)。
二、方法
1.动物分组和模型制备:小鼠随机分为3组,分别为正常对照组、α-GalCer模型组和LXR治疗组,每组5只。
T0901317预先溶于DMSO,浓度为50 mg/ml,-20℃保存,使用前以0.9%NaCl溶液稀释至3 mg/ml[8]。 α-GalCer预先溶于 DMSO,浓度为 1 mg/ml,-20℃保存,使用前以含0.5%Tween-20的1×PBS稀释至6μg/ml[9]。LXR治疗组每天腹腔注射T0901317(30 mg/kg),注射体积为 0.3 ml,另两组注射等体积溶剂,连续注射 7 d;第 8 d,α-GalCer模型组和LXR治疗组腹腔注射α-GalCer(40μg/kg),注射体积为0.2 ml,正常对照组注射等体积溶剂。α-GalCer腹腔注射6 h后眼眶取血0.8 ~ 1.0 ml,处死小鼠,于肝脏右叶相同部位留取肝组织,用于后续实验。
2.肝脏组织病理学检查:肝组织4%甲醛溶液固定,常规石蜡包埋,切片,HE染色,光学显微镜下观察。
3.血清转氨酶水平检测:以HITACHI 7080全自动生化分析仪检测血清ALT、AST水平。
4.免疫组化染色检测IL-6表达:甲醛固定石蜡包埋肝组织4μm厚连续切片,常规脱蜡至水,3%H2O2消除内源性过氧化物酶活性,微波抗原修复,封闭液室温封闭,滴加IL-6抗体(1:100),4℃过夜,滴加二抗,DAB显色,自来水充分冲洗,苏木精复染,封片。拍照后以Image-Pro Plus 6.0软件分析肝组织IL-6阳性物质单位面积内的积分光密度值(IOD),作为IL-6蛋白相对表达量。
5.蛋白质印迹法检测PI3K/Akt/NF-κB信号通路激活情况:抽提肝组织总蛋白,测定蛋白浓度。电泳,转膜,封闭,依次一抗、二抗孵育,ECL显影,定影。扫描图像,ImageJ 1.42软件分析肝组织各目的蛋白相对表达量。
6.实时荧光定量RT-PCR检测TNF-α、诱导型一氧化氮合酶(iNOS)mRNA表达:抽提肝组织总RNA,逆转录合成cDNA,以之为模板行实时荧光定量PCR,引物设计采用Primer Express软件(见表 1)。PCR 循环参数:95 ℃ 10 s;95 ℃ 10 s,60 ℃20 s,81 ℃ 1 s,45 个循环。以 β-actin 为内参照,2-△△Ct法计算目的基因mRNA相对表达量。以正常对照组表达量为基数,将α-GalCer模型组和LXR治疗组的表达量转换成与正常对照组的比值表示。
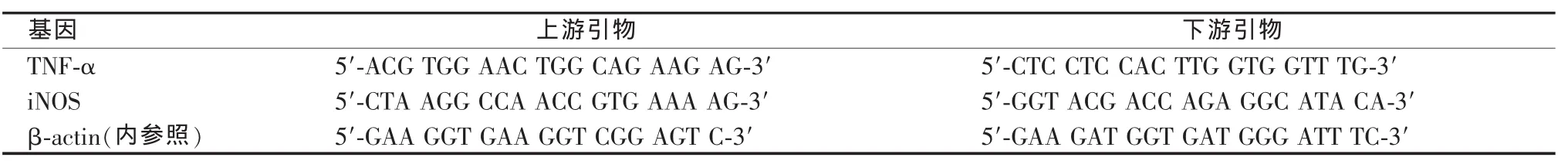
表1 实时荧光定量PCR引物序列
三、统计学分析
结 果
一、LXR激活减轻α-GalCer诱导的肝损伤
正常对照组肝组织结构正常,未见明显淋巴细胞浸润和肝细胞坏死;α-GalCer模型组肝组织门管区和小叶内大量淋巴细胞浸润,肝细胞肿胀坏死明显;LXR治疗组肝组织淋巴细胞浸润程度明显轻于α-GalCer模型组,偶见肝细胞坏死(见图1)。各组血清ALT、AST水平的变化与肝组织病理学改变平行,α-GalCer模型组显著高于正常对照组,LXR治疗组则较α-GalCer模型组显著降低(见表2)。
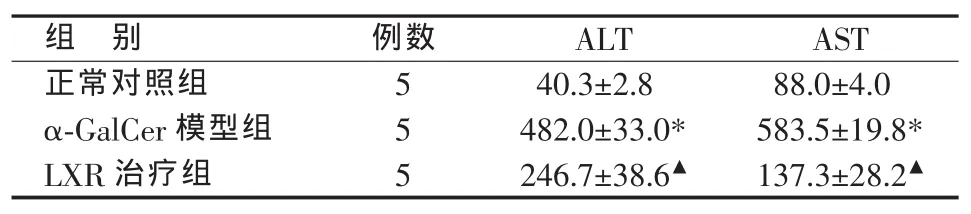
表2 各组血清转氨酶水平比较(x±s,U/L)

二、LXR激活下调肝组织IL-6表达
免疫组化染色显示,IL-6阳性物质呈棕黄色,主要定位于细胞质。α-GalCer模型组IL-6主要表达于肝细胞中,肝组织IL-6表达量较正常对照组显著上调(6512.23±356.74 对 98.17±38.59,P<0.01),LXR 治疗组(501.46±79.84)则较 α-GalCer模型组显著下调(P<0.01)(见图 2)。
三、LXR激活抑制肝内PI3K/Akt/NF-κB信号通路
蛋白质印迹法检测显示,各组间肝组织总Akt、 总 IκBα 蛋白表达量无明显差异,α-GalCer模型组 PI3K p85、p-Akt、p-IκBα、NF-κB p65 蛋 白表达量较正常对照组显著上调,LXR治疗组则较α-GalCer模型组显著下调(见表3、图3)。
四、LXR激活下调肝组织TNF-α、iNOSmRNA表达
实时荧光定量RT-PCR检测显示,α-GalCer模型组肝组织TNF-α、iNOSmRNA表达量较正常对照组明显上调,LXR治疗组则较α-GalCer模型组显著下调(TNF-α:2.19±1.34 对 7.31±3.78,P<0.05;iNOS:2.65±1.21 对 5.12±0.67,P<0.05)。
表3 各组肝内PI3K/Akt/NF-κB信号通路相关蛋白表达量比较(±s )
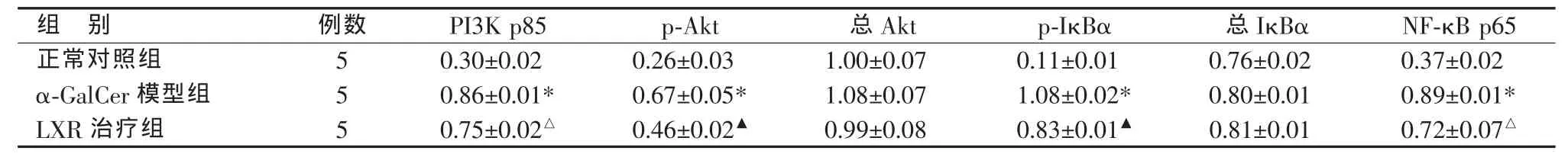
表3 各组肝内PI3K/Akt/NF-κB信号通路相关蛋白表达量比较(±s )
*与正常对照组比较,P<0.01;与 α-GalCer模型组比较,△P<0.05,▲P<0.01
组 别 例数 PI3K p85 p-Akt 总Akt p-IκBα 总IκBα NF-κB p65正常对照组 5 0.30±0.02 0.26±0.03 1.00±0.07 0.11±0.01 0.76±0.02 0.37±0.02 α-GalCer模型组 5 0.86±0.01* 0.67±0.05* 1.08±0.07 1.08±0.02* 0.80±0.01 0.89±0.01*LXR 治疗组 5 0.75±0.02△ 0.46±0.02▲ 0.99±0.08 0.83±0.01▲ 0.81±0.01 0.72±0.07△
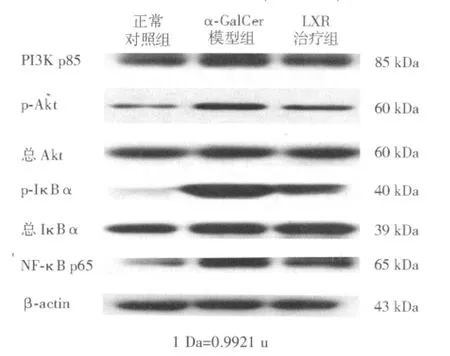
图3 各组肝内PI3K/Akt/NF-κB信号通路相关蛋白蛋白质印迹法电泳图
讨 论
AIH的病因和发病机制至今尚未明确。AIH患者肝脏具有典型的界面性肝炎特征,门管区有大量淋巴细胞浸润,并有较高水平的促炎细胞因子分泌,表明肝内免疫反应引起的炎症可能在AIH的发生、发展过程中起关键作用[10]。因此,通过免疫调节抑制肝脏炎症成为治疗AIH的重要途径之一。
理想的动物模型对AIH的研究具有重要意义。伴刀豆球蛋白A(Con A)模型和α-GalCer模型均为经典的免疫介导肝损伤小鼠模型。然而,Con A模型的肝脏炎症并非由自身抗原所诱导,α-GalCer则可作为天然自身抗原的替代抗原被MHC-Ⅰ样分子CD1d呈递至NKT细胞[4]。因此α-GalCer模型与Con A模型相比更接近人类自身免疫性肝病,是研究AIH理想的动物模型。
LXR系于1994年从肝cDNA文库克隆得到,因在肝脏内大量表达而得名,包括LXRα(NR1H3)和LXRβ(NR1H2)两种亚型。LXRα和LXRβ在组织分布上有一定差异,LXRα在肝脏内高表达,在肾上腺、肠、脂肪组织、巨噬细胞、肺、肾等部位亦有一定水平的表达,LXRβ则在全身广泛表达。除参与调控胆固醇的吸收、输出、转运、分泌等过程,LXR对免疫和炎症反应亦具有调节作用[11]。研究发现LXR 激活可抑制 Toll样受体 4(TLR4)、IL-1β、TNF-α等介导的信号通路及其下游炎症基因表达,可由LXR激动剂抑制的参与免疫反应的炎症介质、细胞因子、趋化因子等基因包括iNOS、环氧合酶-2(COX-2)、IL-6、IL-1β、粒细胞集落刺激因子(G-CSF)、单核细胞趋化蛋白-1(MCP-1)、MCP-3、巨噬细胞炎症蛋白-1β(MIP-1β)、干扰素诱导蛋白-10(IP-10)、基质金属蛋白酶-9(MMP-9)等[6]。T0901317是人工合成的LXR选择性激动剂,可以同时激活LXRα和LXRβ。LXR激动剂已在多个自身免疫性疾病,如实验性自身免疫性脑脊髓炎、胶原性关节炎动物模型中被证实可减轻症状、改善炎症[12,13],然而关于LXR激活对肝脏自身免疫性炎症性疾病的保护作用及其机制的研究尚少。本研究首次在α-GalCer诱导的小鼠肝损伤模型中证实LXR激活可调节免疫反应,抑制肝脏炎症,从而发挥肝脏保护作用。
血清转氨酶活性升高是AIH重要的临床生化指标,在一定程度上可反映肝损伤的严重程度[14]。本研究发现LXR激活能显著降低腹腔注射α-GalCer引起的血清ALT、AST水平升高,组织病理学检查示α-GalCer模型组小鼠肝内大量淋巴细胞浸润,肝细胞肿胀坏死明显,而LXR治疗组小鼠的淋巴细胞浸润程度明显轻于α-GalCer模型组,仅偶见肝细胞坏死,证实肝损伤程度与血清转氨酶水平的变化相一致。
IL-6为Th17型细胞因子,在肝脏中可由单核细胞、巨噬细胞、肝细胞等产生,是一种促炎细胞因子。研究[15]显示AIH患者血清IL-6水平显著升高,并与肝脏炎症相关。Th17细胞可诱导肝细胞表达IL-6,而IL-6进一步作用于Th17细胞,形成正反馈,这可能是AIH的发病机制之一。本研究中小鼠腹腔注射α-GalCer后肝细胞IL-6表达显著上调,而LXR激活可显著下调α-GalCer引起的肝细胞IL-6分泌,从而调节免疫反应,抑制肝脏炎症。
研究表明PI3K/Akt信号通路可负反馈调节过度的先天免疫和TLR介导的促炎反应[16],可能与自身免疫性疾病有关[17],但该信号通路与AIH之间有无联系尚无相关报道。PI3K/Akt信号通路激活可诱导IκBα磷酸化,使 NF-κB p65亚基与之解离并向核内易位,从而激活NF-κB的转录活性,启动一系列免疫、炎症反应相关细胞因子基因表达。本研究发现α-GalCer腹腔注射可激活肝内PI3K/Akt信号通路,肝组织PI3K、p-Akt表达明显上调,p-IκBα、NF-κB p65 同时上调,而 LXR 激活可显著下调α-GalCer引起的上述蛋白表达上调,提示LXR激活可抑制PI3K/Akt信号通路的激活,通过抑制IκBα磷酸化而影响NF-κB的转录活性,从而减少促炎细胞因子表达,抑制肝脏炎症,起到保护肝脏的作用。
TNF-α是介导α-GalCer诱导的肝损伤的重要介质,以抗体中和TNF-α可显著减轻α-GalCer诱导的肝损伤[4]。TNF-α可通过NF-κB信号通路诱导iNOSmRNA和蛋白表达[18],而iNOS催化产生的一氧化氮(NO)可介导肝损伤。本研究证实LXR激活可显著下调α-GalCer腹腔注射引起的肝组织TNF-α、iNOSmRNA表达上调,从而减轻肝损伤。
综上所述,以LXR激动剂T0901317激活LXR可调节免疫反应,抑制肝脏炎症,从而显著减轻α-GalCer诱导的小鼠肝损伤,提示LXR激动剂对AIH具有潜在治疗价值。LXR激活对肝脏的保护机制可能与抑制PI3K/Akt/NF-κB信号通路激活有关。
1 Krawitt EL.Autoimmune hepatitis.N Engl J Med,2006,354(1):54-66.
2 Manns MP,Czaja AJ,Gorham JD,et al;American Association for the Study of Liver Diseases.Diagnosis and management of autoimmune hepatitis.Hepatology,2010,51(6):2193-2213.
3 Longhi MS,Ma Y,Mieli-Vergani G,et al.Adaptive immunity in autoimmune hepatitis.Dig Dis,2010,28(1):63-69.
4 Biburger M,Tiegs G.Alpha-galactosylceramide-induced liver injury in mice is mediated by TNF-alpha but independent of Kupffer cells.J Immunol,2005,175(3):1540-1550.
5 Fowler AJ,Sheu MY,Schmuth M,et al.Liver X receptor activators display anti-inflammatory activity in irritant and allergic contact dermatitis models:liver-X-receptorspecific inhibition of inflammation and primary cytokine production.JInvest Dermatol,2003,120(2):246-255.
6 Joseph SB,Castrillo A,Laffitte BA,et al.Reciprocal regulation of inflammation and lipid metabolism by liver X receptors.Nat Med,2003,9(2):213-219.
7 Xu J,Wagoner G,Douglas JC,et al.Liver X receptor agonist regulation of Th17 lymphocyte function in autoimmunity.JLeukoc Biol,2009,86(2):401-409.
8 Zhang X,Zhu Z,Luo G,et al.Liver X receptor agonist downregulates hepatic apoM expression in vivo and in vitro.Biochem Biophys Res Commun,2008,371(1):114-117.
9 Cao Z,Yuan Y,Jeyabalan G,et al.Preactivation of NKT cells with alpha-GalCer protects against hepatic ischemiareperfusion injury in mouse by a mechanism involving IL-13 and adenosine A2A receptor.Am J Physiol Gastrointest Liver Physiol,2009,297(2):G249-G258.
10 Vergani D,Longhi MS,Bogdanos DP,et al.Autoimmune hepatitis.Semin Immunopathol,2009,31(3):421-435.
11 Zelcer N,Tontonoz P.Liver X receptors as integrators of metabolic and inflammatory signaling.J Clin Invest,2006,116(3):607-614.
12 Hindinger C,Hinton DR,Kirwin SJ,et al.Liver X receptor activation decreases the severity of experimental autoimmune encephalomyelitis.J Neurosci Res,2006,84(6):1225-1234.
13 Chintalacharuvu SR,Sandusky GE,Burris TP,et al.Liver X receptor is a therapeutic target in collagen-induced arthritis.Arthritis Rheum,2007,56(4):1365-1367.
14 Manns MP,Vogel A.Autoimmune hepatitis,from mechanisms to therapy.Hepatology,2006,43(2 Suppl 1):S132-S144.
15 Zhao L,Tang Y,You Z,et al.Interleukin-17 contributes to the pathogenesis of autoimmune hepatitis through inducing hepatic interleukin-6 expression.PLoS One,2011,6(4):e18909.
16 Xu CQ,Liu BJ,Wu JF,et al.Icariin attenuates LPS-induced acute inflammatory responses:involvement of PI3K/Akt and NF-kappaB signaling pathway.Eur J Pharmacol,2010,642(1-3):146-153.
17 Patel RK,Mohan C.PI3K/AKT signaling and systemic autoimmunity.Immunol Res,2005,31(1):47-55.
18 Hatano E,Bennett BL,Manning AM,et al.NF-kappaB stimulates inducible nitric oxide synthase to protect mouse hepatocytes from TNF-alpha-and Fas-mediated apoptosis.Gastroenterology,2001,120(5):1251-1262.
