荷叶化学成分的HPLC-TOF/MS分析
2011-08-05周永刚解放军第8医院药剂科江苏南京000安捷伦公司上海0000北京儿童医院药剂科北京00056解放军680部队北京0007
周永刚,刘 畅,毛 飞,李 祥(.解放军第8医院药剂科,江苏 南京 000;.安捷伦公司,上海 0000;.北京儿童医院药剂科,北京 00056;.解放军680部队,北京 0007)
荷叶属于睡莲科植物莲的干燥叶,分布于我国大部分地区,主产于湖南、湖北、浙江、江苏等地[1]。荷叶味苦性平,归肝、脾、胃经,具有清热解暑、升发清阳、凉血止血等功效,主治暑热烦渴、暑湿泄泻、脾虚泄泻、血热吐衄、便血崩漏[2~5]。研究表明,荷叶中的生物碱和黄酮类化合物还具有降血脂、抑制胆固醇、抗有丝分裂、抑菌和止痉挛、抗氧化等活性[6~12]。目前国内外学者采用传统的植物化学的方法,对荷叶中生物碱、黄酮和挥发油进行了分离提取[13,14],显然,这些传统方法难以系统地体现中药中多类成分的复杂性。为了能够对荷叶的药效基础作更好的阐述,本研究采用HPLC-TOF/MS技术对荷叶中多成分进行了鉴别,该法操作简便、可靠,对阐明荷叶药效物质基础和质量控制具有一定的参考价值。
1 仪器和试药
安捷伦1200型液相色谱仪,包括在线脱气机,二元泵,高性能自动进样器;安捷伦G6210A飞行时间质谱仪,配有标准电喷雾离子源(ESI),MassHunter色谱工作站和Qualitative Analysis质谱分析软件。
荷叶购于上海雷允上大药房,荷叶碱标准品购自中国生物制品检定所,乙腈为色谱纯(Fisher,USA),水为娃哈哈纯净水,其余试剂均为分析纯。
2 试验方法
2.1 供试品溶液制备 用粉碎机将药材荷叶均匀粉碎,取细粉约2 g(过40目筛),精密称定,置于具塞锥形瓶中,精密加入50%乙醇25 ml,密塞,称定重量,超声提取30 min,放置冷却,再称定重量,用50%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.2 色谱及质谱条件
2.2.1 液相色谱条件 色谱柱:Agilent Zorbax SBAq C18(250 mm ×4.6 mm,5 μm);流动相为乙腈和1.0%醋酸(用氨水调 pH 至6.2±0.1);A 相为乙腈,B相为1%醋酸,梯度洗脱;梯度洗脱程序如下:0~50 min,0~30%A;50~90 min,30% ~75%A;进样量10 μl;流速:1.0 ml/min,柱温:25 ℃。
2.2.2 TOF/MS质谱条件 采用ESI离子源,正离子模式下(ESI+),柱后分流比为3∶1,具体参数如下:毛细管电压4 000 V,雾化气压力40 psig,干燥气流速10 ml/min,干燥气温度350℃,碎片电压选择120 V和200 V;参比离子m/z 121.050 8和922.009 7;质量数扫描范围m/z 100~1 000。
2.3 荷叶中化学成分数据库的建立 根据有关荷叶药材化学成分研究的报道,收集了生物碱类、黄酮类等化学成分共38个,并通过安捷伦“Formula-Database-Generator”软件建立荷叶药材中已知化学成分的数据库。
3 结果和讨论
3.1 实验条件优化 首先考察了甲醇-水和乙腈-水两种体系,结果显示乙腈的洗脱效果要优于甲醇,故选择乙腈作为有机相。由于荷叶中主要含有黄酮类成分和生物碱类成分,为保证生物碱类成分具有较好的峰形,所以在流动相中加入少量氨水。一般调pH值常用的试剂为三乙胺和氨水,但三乙胺在质谱中有较大的残留,多次进样后会对定性鉴别产生较大的干扰,所以,选择在流动相中添加氨水,避免残留离子的干扰。同时,为了保证总离子流图有较好的重现性,在每次配制流动相的时候控制水相的pH值为6.2±0.1。质谱检测分别比较了正、负离子两种扫描模式,结果发现正模式下峰容量更大、质谱响应更强,故实验最终选择在正模式下进行。
3.2 荷叶中化学成分的鉴别 在优化的色谱质谱条件下,荷叶提取液的HPLC-TOF/MS典型总离子流图见图1。从图中看到有超过25个峰被检测到,我们对其中的14个峰进行了详细的鉴别。通过对比标准物质的保留时间和质谱图,可以判定峰13为荷叶碱。其它化合物由于没有标准品进行比对,按照以下方法鉴别:首先,我们根据TOF/MS上所得到的精确化合物分子量信息,通过MassHunter软件在3 ppm的质量偏差范围内计算其可能的元素组成,并将其与所建的数据库相匹配,对荷叶化学成分的初步鉴别。然后,调节碎片电压至200 V,获得化合物结构相关的碎片离子,根据离子的裂解情况,结合数据库中各化合物的化学结构,对荷叶化学成分进行进一步的鉴别,结果见表1。
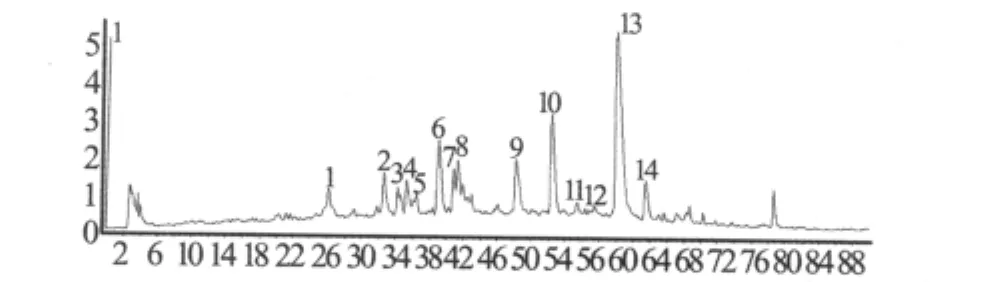
图1 荷叶提取物TOF/MS总离子流图
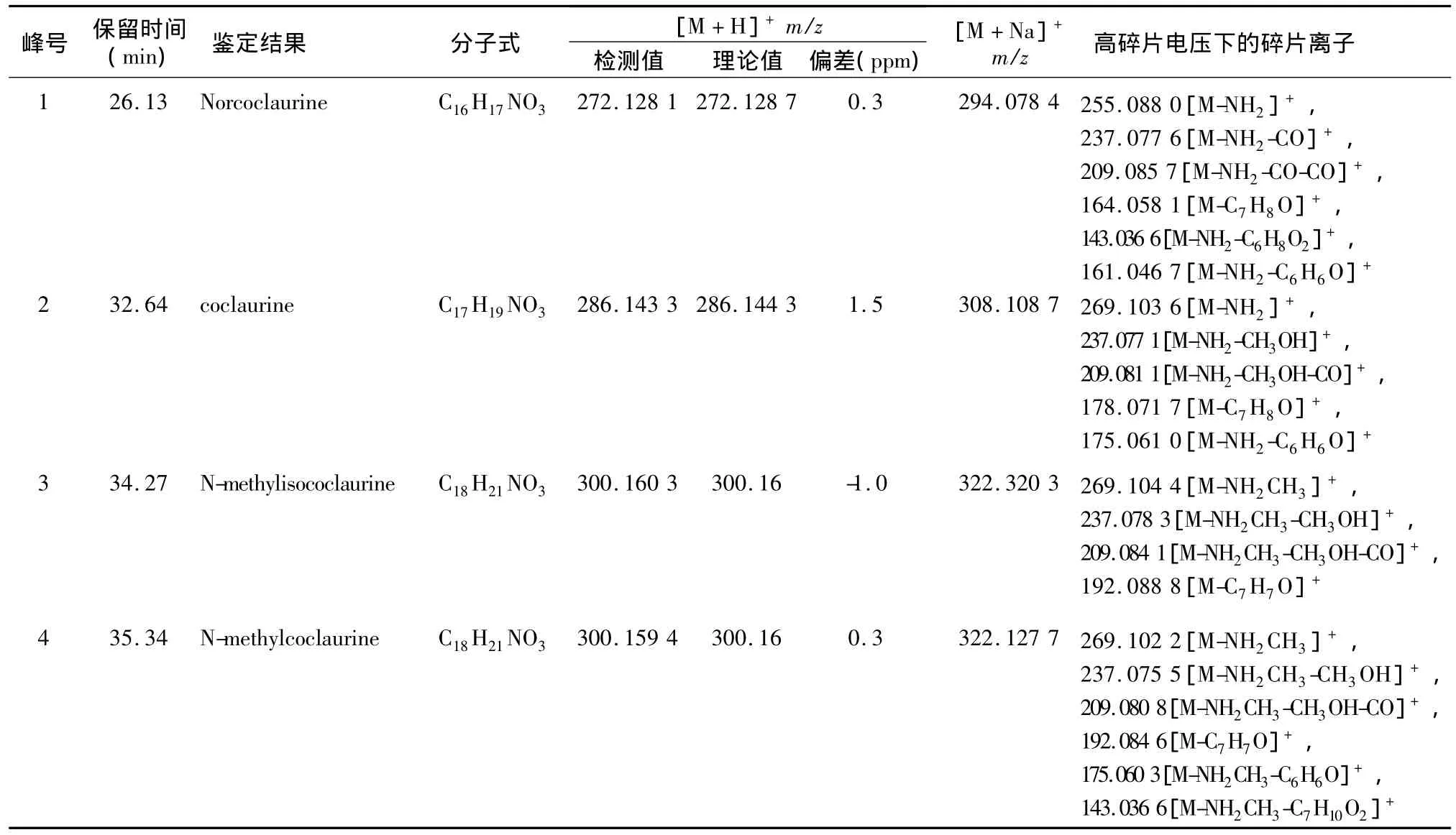
表1 荷叶化学成分鉴别结果

以峰1为例,来说明鉴别过程。在碎片电压在120 V的条件下,得到其质谱图(图2(a)),测得其分子离子峰为272.128 1,元素组成为C16H17NO3,根据数据库匹配我们初步鉴定该化合物为去甲基乌药碱。调节碎片电压至200 V,得到此电压条件下的质谱图(图2(b)),发现有很强的脱NH3(17 Da)的碎片离子,推测该碎片离子为其B环的Retro Diels-Alder(RDA)裂解碎片,这说明该结构中的N上没有甲基取代,然后根据质谱图上明显的255.088 0[M-NH2]+、237.077 6[M-NH2-CO]+、209.085 7[M-NH2-CO-CO]+、164.058 1[MC7H8O]+、163.046 7[M-NH2-C6H6O]+和143.036 6[M-NH2-C6H8O2]+等碎片离子的信息,推断出裂解途径见图3所示。结合以上信息,我们能够鉴定峰1为去甲基乌药碱。

图2 120 V(A)与200 V去甲基乌药碱(B)碎片离子质谱图
去甲基乌药碱ESI-MS裂解途径如下:

采用类似的方法,能够对峰2~14也进行相应的鉴别。峰2显示的分子离子峰为286.143 3,分子式为 C17H19NO3,产生碎片离子 269.103 6[MNH2]+、237.077 1[M-NH2-CH3OH]+、209.081 1[M-NH2-CH3OH-CO]+、178.071 7[M-C7H8O]+和 175.061 0[M-NH2-C6H6O]+,故判断其为乌药碱;峰 3、4、6的分子离子峰分别为 300.160 3、300.159 4和300.159 5,三者具有相同的分子式C18H21NO3,其中峰3在200 V电压下能够产生碎片离子 269.104 4[M-NH2CH3]+、237.078 3[MNH2CH3-CH3OH]+、209.084 1[M-NH2CH3-CH3OH-CO]+和 192.088 8[M-C7H7O]+,峰 4 则另有特征性的碎片离子175.060 3[M-NH2CH3-C6H6O]+和 143.036 6[M-NH2CH3-C7H10O2]+,峰6所产生的碎片离子为 283.117 4[M-NH2]+、252.098 6[M-NH2-CH3OH]+、237.076 4[M-NH2-CH3OH-CH3]+、209.078 9[M-NH2-CH3OH-CH3-CO]+、192.086 4[M-C7H8O]+、189.075 6[MNH2-C6H6O]+,根据三者所具有的碎片离子的不同,判断峰3为N-甲基异乌药碱,峰4为N-甲基乌药碱,峰6为N-去甲亚美罂粟碱;峰5的分子离子峰为465.103 6,化学式为 C21H20O12,产生的碎片离子为 377.120 8[M-C5H10O]+、303.052 4[MC6H10O5]+,根据裂解规律判断为异槲皮苷;峰7的分子离子峰为286.143 2,化学式为C17H19NO3,产生碎片离子 269.103 6[M-NH2]+、254.079 3[M-NH2CH3]+、237.076 3[M-NH2-CH3OH]+和209.081 4[M-NH2-CH3OH-CO]+,判断为 N-去甲甲基乌药碱;峰8的分子离子峰为314.176 4,化学式为 C19H23NO3,产生的碎片离子为283.117 6[M-NH2CH3]+,、252.098 2[M-NH2CH3-CH3OH]+和206.111 3[M-C7H8O]+,判断峰 8 为亚美罂粟碱;峰9和峰10的分子离子峰为 282.150 7和282.148 9,共同的元素组成C18H19NO2,峰9有很强的-31 的251.106 9[M-NH2CH3]+碎片离子,推测此结构的氮原子上有甲基取代,峰10则有很强的-17的265.122 2[M-H2NH]+碎片离子,推测该碎片离子为其B环的RDA裂解碎片,而该结构中N上没有甲基取代,根据分析和数据库匹配,判断峰9为O-去甲基荷叶碱,峰10为 N-去甲基荷叶碱;峰11的分子离子峰为266.227 6,化学式为C17H15NO2,产生碎片离子 249.091 0[M-H2NH]+、219.080 4[MH2NH-CH2O]+、191.085 3[M-H2NH-CH2O-CO]+,判断为番荔枝碱;峰12的分子离子峰为312.150 9,化学式为 C19H21NO3,其碎片离子为 283.125 3[MCO]+、269.108 8[M-CH2CH2NH]+、251.098 0[MCO-CH3NH2]+、254.087 1[M-CH2CH2NH-CH3]+、225.185 5[M-CH2CH2NH-CH3-CO]+,判断其原荷叶碱;峰14的分子离子峰为280.133 8,化学式为C18H17NO2,产生碎片离子249.083 1[MNH2CH3]+、219.072 2[M-NH2CH3-CH2O]+和191.077 2[M-NH2CH3-CH2O-CO]+,根据裂解情况推断其为斑点亚洲罂粟碱。
4 结论
本实验采用HPLC-TOF/MS技术,结合数据库匹配技术和碎片离子分析,对荷叶中的主要化学成分进行了鉴别,共确定了14个荷叶中的主要生物碱类和黄酮类成分。利用TOF/MS在高碎片电压下产生的丰富的碎片离子信息,进一步明确鉴别了一系列非靶标成分,并总结了荷叶中化学成分的一般裂解规律。该方法快速,灵敏,准确度高,可作为荷叶质量控制的方法之一,同时为荷叶的药理学和临床药效学研究提供了化学物质基础信息。
[1]钟先锋,黄桂东.荷叶成分及功能的研究进展[J].食品与机械,2006,22(4):138.
[2]王玲玲,刘 斌,石任兵.荷叶的化学成分研究[J].天然产物研究与开发,2009,21:416.
[3]刘树兴,赵 芳.荷叶功能成分研究进展[J].食品工业科技,2008,04:321.
[4]张国庆,冯习坤,曾为驰,等.荷叶的化学和药理研究进展[J].药学实践杂志,2010,28(5):328.
[5]王福刚,曹 娟,刘 斌,等.荷叶的化学成分及其药理作用研究进展[J].时珍国医国药,2010,21(9):2339.
[6]杨冀艳,胡 磊,许 杨.荷叶黄酮类化合物的研究进展[J].食品科学,2007,08:554.
[7]王玲玲,刘 斌,石任兵.荷叶黄酮类化学成分研究[J].北京中医药大学学报,2008,02(31):116.
[8]雷红松,肖文军,魏 勇.荷叶生物碱的研究进展[J].2007,05(28):92.
[9]单 斌,邓泽元,熊冬梅.荷叶中生物碱的提取及组成成分分析[J].食品科技,2008,10:163.
[10]肖桂青,卢向阳,田 云.荷叶中生物碱类成分的研究进展[J].化学与生物工程,2006,05(23):1.
[11]罗金波,肖文军,刘仲华.荷叶生物碱类成分的研究进展[J].药学进展,2008,18(3):9.
[12]孔文琦,李严巍,荷叶活性化学成分及药理研究进展[J].中药研究与信息,2005,7(6):22.
[13]聂 波,佟丽华,于 敏.荷叶化学成分的分离分析[J].黑龙江医药科学,2003,26(4):54.
[14]曾虹燕,苏杰龙,方 芳,等.不同方法提取的荷叶挥发油化学成分分析[J].西北植物学报,2005,25(3):578.
