牛卵泡抑素基因克隆及真核表达载体构建
2011-08-04苏广华苏建国王子东李光鹏
康 峰,苏广华,苏建国,段 彪,王子东,李光鹏*
(1.内蒙古大学生殖生物学及生物技术教育部重点实验室,内蒙古呼和浩特 010021;2.西北农林科技大学动物科技学院,陕西杨凌 712100)
引言
卵泡抑素(Follistatin,FSTN)又名FSH抑制蛋白(FSH-suppressing protein,FSP),是一种单链糖蛋白。人FSTN的基因长约为6 kb,含有6个外显子(exon)和5个内含子(intron),mRNA长1 kb左右[1]。FSTN最初是从牛[2]和猪[3]的卵泡液中分离出来的,但是后来发现FSTN的mRNA在多种组织和器官中都有表达,例如卵巢、睾丸、垂体、肾上腺、脑皮质 、骨髓 、心脏 、肺 、胸腺 、骨骼肌 、肾 、胰等,其中卵巢中的表达量最高[4]。
近年来的实验表明,FSTN以旁分泌或自分泌的方式,与转化生长因子-β(transforming growth factor-β,TGF-β)超家族的许多成员,如骨形态发生蛋白(bone morphogenic protein,BMP)、肌肉抑素(myostatin,MSTN)等结合,在生殖系统以外的器官和组织中起重要作用[5],如肝、肾、胰、骨骼肌、皮肤等,这表明FSTN对不同类型的细胞有广泛的调节作用[6]。
MSTN是目前所知的最强的骨骼肌生长抑制物[7]。人们试图寻找MSTN的抑制物,达到促进肌肉生长的目的。有研究表明,FSTN能抑制MSTN的活性[8],FSTN蛋白能够同MSTN黏合在一起,阻断其抑制功能,促进肌肉的生长[9]。FSTN今后可能会用于治疗人类肌肉性疾病,以及提高家畜肌肉的质量和数量。本研究构建了FSTN的过表达载体,为培育肌肉发达的转基因肉牛新品种奠定基础。
1 材料与方法
1.1 引物设计
根据GenBank中牛的FSTN mRNA序列(GenBank注册号:NM 175801.2),用 Primer Premier 5.0软件设计用于扩增FSTN编码区完整序列的引物 P1(5'-AACTGGAAT TCTGCCCTCAGGATGGCCCGT-3')和P2(5'-AACTGCTGCAGTGAACAT TGGTGGAGGGT-3'),以及用于质粒检测的引物P3(5'-ACAAGACAGAACTGAGCAAGG-3')和P4(5'-GGACAGAAAACATCCCGAC-3')。
1.2 牛FSTN基因的PCR扩增、T载体连接、阳性克隆筛选及测序
从屠宰场获得刚屠宰肉牛的卵巢,立即放入液氮罐中带回实验室,用Trizol法提取总RNA。用六碱基随机引物(Promega)和SuperscriptⅢ反转录酶(Invitrogen)进行反转录。用特异性引物P1和P2进行牛FSTN基因的PCR扩增。PCR反应体系为25 μ L,包括 10 ×Reaction buffer 2.5 μ L,MgCl2(25 mM)2.5 μ L,dNTP 1 μ L,引 物各 1 μ L,cDNA 1 μ L,Taq DNA 聚合酶 0.2 μ L(5 U/μ L),去离子水补至25 μ L。PCR反应程序:94℃预变性5 min;94℃变性30 s,59℃退火30 s,72℃延伸1 min,30个循环;72℃10 min;20℃程序结束。切胶回收目的片段(1 085 bp),连入pMD18-T载体,转化 E.coli DH5α感受态细胞。涂平板37℃过夜,用引物 P3和P4进行克隆PCR,以便获得阳性克隆(预期扩增长度385 bp)。PCR反应体系为25 μ L。PCR反应程序:94℃预变性5 min;94℃变性30 s,54℃退火30 s,72℃延伸30 s,30个循环;72℃10 min;20℃程序结束。选择3个阳性克隆进行测序,以便能获得没有突变的阳性克隆。
1.3 FSTN过表达载体的构建
对测序正确无误的一个阳性克隆在添加氨苄青霉素的液体LB培养基中培养16~20 h,提取质粒(pMD18-T-FSTN),测定浓度。将真核表达质粒载体pIRES2-AcGFP1(Clontech)转化 E.coli DH5α,筛选阳性克隆,在添加卡那霉素的液体LB培养基中培养16~20 h,提取质粒,测定浓度。把pMD18-T-FSTN与pIRES2-AcGFP1同时经EcoRI与PstI双酶切。胶回收FSTN和pIRES2-AcGFP1骨架片段,用T4连接酶进行连接,转化E.coli DH5α感受态细胞,涂具有卡那霉素抗性的LB平板,37℃培养过夜,筛选阳性克隆,摇菌,提取质粒,获得FSTN过表达载体pIRES2-AcGFP1-FSTN(如图1)。

图1 过表达载体pIRES2-AcGFP1-FSTN
2 结果
2.1 牛FSTN基因的克隆与鉴定
2.1.1 牛卵泡抑素基因cDNA的克隆与鉴定 牛FSTN基因PCR扩增结果(如图2),1 085 bp处有明显条带,与目的条带大小一致。检测引物扩增pMD18-T-FSTN的结果(如图3)表明,获得了预期大小片段(375 bp),初步表明T载体中含有牛FSTN序列。测序结果说明扩增的目的片段准确无误。

图2 FSTN全长PCR

图3 PCR检测引物筛选阳性克隆结果
2.2 过表达载体的PCR检测
随机挑取10个克隆进行PCR检测,1号与7号克隆获得预期大小片段(如图4)。

图4 pIRES2-AcGFP1-FSTN的PCR检测
2.3 过表达载体的酶切鉴定
选择2.2中 1、7号菌落扩培,提取质粒后 EcoRI与PstI酶切鉴定,若载体构建正确,可将FSTN切下,产生1 079 bp与5 298 bp两个片段。电泳酶切产物(如图5),电泳结果表明质粒构建正确。
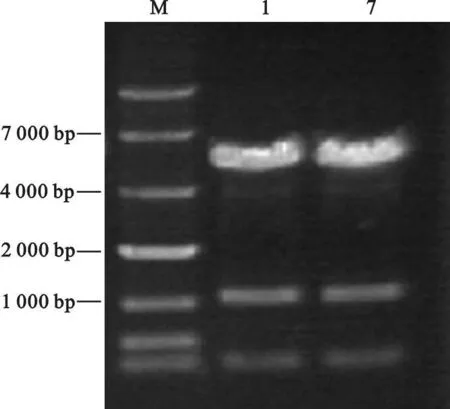
图 5 EcoRI与 PstI双酶切 pIRES2-AcGFP1-FSTN结果
3 讨论
利用基因工程技术治疗遗传性肌肉疾病,包括基因替换[10-13]、外显子跳跃[14]以及突变抑制[15,16]等手段,这些方法均在早期临床治疗中可以取得一定成效,但是他们都不是长效持久的治疗方法[17]。
MSTN对骨骼肌生长具有强烈抑制作用[18],而FSTN蛋白能够同MSTN黏合在一起,阻断其抑制功能,促进肌肉的生长[19]。目前,通过抑制MSTN而治疗肌肉疾病已成为一种可供选择的方法[19]。将人FSTN连入腺病毒载体(AAV1)中,将质粒注射到患有杜氏营养不良症的小鼠四头肌内,小鼠肌肉增生,且疗效持久[20]。之后将AAV1-FSTN注射到患有杜氏营养不良症的恒河猴四头肌内,也取得了良好的治疗效果[17],这为日后用于治疗人类杜氏营养不良症奠定了基础。腺病毒载体表达FSTN后可以达到良好治疗效果,尽管如此,其病毒自身存在安全问题,因此构建安全的基因过表达载体应成为日后研究重点。本研究构建的FSTN的过表达载体为这方面作出了努力,在日后工作中需要继续验证其表达稳定性及安全性,以期在治疗肌肉疾病方面做出贡献。
比利时兰牛和皮埃蒙特牛具有的双肌现象(骨胳肌过度发育)都是由于MSTN单个位点发生突变导致该基因失活的结果,MSTN基因敲除小鼠的肩和臀部肌肉明显肥大,整体骨骼肌明显高于野生型鼠,某些肌肉的重量约为野生型鼠的2~3倍[18]。FSTN转基因小鼠肌肉数量远高出野生型同窝出生仔鼠,尤其胸大肌、三头肌、四头肌和臀肌较为发达[21]。在小鼠体内的研究表明FSTN转基因有望成为培育肌肉发达的转基因肉牛新品种的手段之一。将构建的FSTN的过表达载体转入牛胎儿成纤维细胞,筛选并建立转基因细胞系,通过核移植技术生产转基因牛。
[1] Shimasaki S,Koga M,Esch F,et al.Primary structure of the human follistatin precursor and its genomic organization[J].Proc Natl Acad Sci USA,1988,85:4218-4222.
[2] Robertson D M,Klein R,de Vos F L,et al.T he isolation of polypeptides with FSH suppressing activity from bovine follicular fluid which are structurally different to inhibin[J].Biochem Biophys Res Commun,1987,149(2):744-749.
[3] Ueno N,Ling N,Ying S Y,et al.Isolation and partial characterization of follistatin:a single-chain M r 35,000 monomeric protein that inhibits the release of follicle-stimulating hormone[J].Proc Natl Acad Sci USA,1987,84(23):8282-8286.
[4] T ortoriello D V,Sidis Y,Holtzman D A,et al.Human follistatin-related protein:a structural homologue of follistatin with nuclear localization[J].T he Journal of Endocrinology,2001,142:3426-3434.
[5] Ying S Y.Inhibins,activins and follistatins[J].J Steroid Biochem,1989,33(4B):705-713.
[6] Cameron V A,Nishimura E,Mathews LS,et al.Hybridization histochemical localization of activin receptor subtypes in rat brain,pituitary,ovary,and testis[J].The Journal of Endocrinology,1994,134:799-808.
[7] McPherron A C,Lawler A M,Lee S J.Regulation of skeletal muscle mass in mice by a new TGF-β superfamily member[J].Nature,1997,387:83-90.
[8] Lee S J,Lee Y S,Zimmers T A,et al.Regulation of muscle mass by follistatin and activins[J].Mol Endocrinology,2010,24(10):1998-2008.
[9] Rodino-Klapac L R,Haidet A M,Kota J,et al.Inhibition of myostatin with emphasis on follistatin as a therapy for muscle disease[J].M uscle and Nerve.2009,39,283-296.
[10] Mendell J R,Rodino-Klapac L R,Rosales-Quintero X,et al.Limb-girdle muscular dystrophy ty pe 2D gene therapy restores alpha-sarcogly can and associated proteins[J].Ann Neurol,2009,66:290-297.
[11] Cerletti M,Negri T,Cozzi F,et al.Dystrophic phenotype of canine X-linked muscular dystrophy is mitigated by adenovirus-mediated utrophin gene transfer[J].Gene Ther,2003,10:750-757.
[12] G regorevic P,Allen JM,Minami E,et al.rAAV6-microdystrophin preserves muscle function and extends lifespan in severely dy strophic mice[J].Nat Med,2006,12:787-789.
[13] Gregorevic P,Blankinship M J,Allen J M,et al.Systemic delivery of genes to striated muscles using adeno-associated viral vectors[J].Nat Med,2004,10:828-834.
[14] Aartsma-Rus A,Kaman W E,Weij R,et al.Ex ploring the frontiers of therapeutic exon skipping fo r Duchenne muscular dystrophy by double targeting within one or multiple exons[J].Mol T her,2006,14:401-407.
[15] Frankhuizen W S,Koop K,Goemans N M,et al.Local dystrophin restoration with antisense olig onucleotide PRO051[J].The New England journal of medicine,2007,357:2677-2686.
[16] Barton-Davis E R,Cordier L,Shoturma D I,et al.Aminoglycoside antibiotics restore dystrophin function to skeletal muscles of mdx mice[J].J Clin Invest,1999,104:375-381.
[17] Kota J,Handy C R,Haidet A M,et al.Follistatin gene delivery enhances muscle growth and strength in nonhuman primates[J].Sci T ransl M ed,2009,1(6):6-15.
[18] McPherron A C,Lawler A M,Lee S J.Regulation of skeletal muscle mass in mice by a new TGF-βsuperfamily member[J].Nature,1997,387:83-90.
[19] Rodino-Klapac L R,Haidet A M,Kota J,et al.Inhibition of myostatin with emphasis on follistatin as a therapy for muscle disease[J].Muscle Nerve,2009,39:283-296.
[20] Haidet A M,Rizo L,Handy C,et al.Long-term enhancement of skeletal muscle mass and strength by single gene administration of myostatin inhibitors[J].Proc Natl Acad Sci USA,2008,105:4318-4322.
[21] Nakatani M,Takehara Y,Sugino H,et al.Transgenic expression of a myostatin inhibitor derived from follistatin increases skeletal muscle mass and ameliorates dystrophic pathology in mdx mice[J].FASEB J,2008,22(2):477-487.
