白血病Reh、HL-60、K562细胞系RUNX3基因P2启动子甲基化状态与RUNX3基因表达*
2011-08-02李大彩吴明彩张根葆毕富勇
李大彩, 吴明彩, 张根葆, 毕富勇△
(皖南医学院1肿瘤生化研究室,2病理生理学教研室,安徽 芜湖 241002)
白血病是一种造血干细胞的恶性克隆性疾病,严重威胁人类健康。随着近年来分子生物学、遗传学等学科的发展,白血病的治疗水平有了很大提高,比如急性早幼粒细胞白血病[1],但这仅是少数特例。另外很多类型的白血病治疗效果仍然不佳,预后差。RUNX3属人runt相关转录因子(runtrelated transcription factor,RUNX)家族成员,RUNX3基因作为一种近年来发现的抑癌基因,已在多种实体瘤中发现其发生了异常甲基化,并且认为RUNX3基因启动子的甲基化是导致该基因失活,促进肿瘤发生发展的重要因素。而该基因启动子在不同白血病细胞中的甲基化状态的研究鲜有报道。本实验采用甲基化特异性 PCR(methylation-specific PCR,MSP)和RT-PCR方法对白血病Reh、HL-60和K562细胞系进行研究,探讨白血病 Reh、HL-60和 K562细胞系中RUNX3基因P2启动子的甲基化状态及该基因的表达情况。
材料和方法
1 材料
1.1 主要仪器与试剂 PCR扩增仪(东胜创新生物科技有限公司);水平电泳槽、电泳仪(北京六一仪器公司);捷达801凝胶成像系统(江苏省捷达科技发展有限公司)。DNA提取试剂盒(Promega);Epitect Bisulfite Kit(Qiagen);Trizol试剂(上海生工);PCR试剂盒(Promega);RT-PCR(Promega);RPMI-1640(上海生工);胎牛血清(Biochrom/上海生工);DNA marker(上海生工);琼脂糖(西班牙进口);DNase 1(上海生工)。引物[2]委托上海生工合成,见表1。

表1 引物、序列及扩增长度Table 1.The primer sequence and amplification length
1.2 细胞培养 人白血病细胞系Reh购自中科院上海细胞库(ATCC建系),人白血病细胞系HL-60和K562由山东大学医学院惠赠。Reh、HL-60、K562细胞于RPMI-1640培养液(含10%胎牛血清,其中Reh细胞系的培养血清为Biochrom胎牛血清,余为上海生工胎牛血清),37℃、5%CO2、饱和湿度CO2培养箱中孵育,2-3 d传代1次。以对数生长期的细胞为实验细胞。
2 方法
2.1 DNA提取及MSP 取1×106细胞按DNA提取说明书(Promega)提取DNA,对提取的DNA用紫外分光光度计检测其纯度及含量,DNA纯度测定:A260/A280>1.8。取2 μg DNA按Epitect Bisulfite Kit(Qiagen)说明书进行修饰及纯化,纯化后的DNA立即使用或-20℃保存备用。纯化后的DNA作为模板进行MSP,PCR反应体系(25 μL):2× GoTaq® Hot Start Green Master Mix 12.5 μL,Epitect Bisulfite Kit修饰后的DNA 模板 2 μL,双蒸水 8.5 μL,引物(10 umol/L)各 1 μL。PCR反应条件:94℃预变性2 min后进行35个循环:94℃30 s,58℃ 30s,72℃ 30 s,最后1个循环后再72℃ 5min。每个样本扩增时,同时以灭菌双蒸水作为阴性对照。取5 μL PCR产物3.5%的琼脂糖凝胶(含溴化乙啶)电泳,分析产物。
2.2 RNA提取及RT-PCR 取1×106细胞用 Trizol试剂(上海生工)按说明书提取RNA。用DNase1(RNA free)(上海生工)消化RNA中痕量的DNA,用紫外分光光度计及琼脂糖凝胶电泳检测RNA的含量及纯度。RNA的纯度测定:A260/A280>2.0。取消化后的RNA作为模板进行RT-PCR实验,操作按试剂盒说明书(Promega)一步法进行。RT-PCR体系为 25 μL,2 × AccessQuickTMMaster Mix 12.5 μL,RNA 模板 2 μL,Nuclease - free water 6.5 μL,引物各 2 μL,AMV Reverse Transcriptase 0.5 μL。RT-PCR反应条件为:45℃孵育45 min,95℃预变性2 min之后进行32个如下循环:95℃ 30 s,58℃ 30 s,72℃ 30 s,最后1个循环后再72℃ 5 min。同时,灭菌DEPC水作为阴性对照,GAPDH作为内参照。扩增产物3.5%的琼脂糖凝胶(含溴化乙啶)电泳,分析扩增产物。
2.3 琼脂糖凝胶电泳结果分析 用凝胶成像系统(捷达801)扫描电泳条带,以RUNX3特异性扩增产物条带吸光度值与GAPDH条带吸光度值之比半定量分析各细胞系的基因表达水平。
3 统计学处理
结 果
1 MSP检测
用RUNX3基因甲基化特异性引物及非甲基化特异性引物扩增修饰后的 DNA,MSP后Reh、HL-60、K562细胞系分别在甲基化特异性扩增(methylation)、非甲基化特异性扩增(unmethylation)、甲基化特异性扩增得到了预期大小的扩增片段,见图1。提示RUNX3基因P2启动子在Reh、K562细胞系中为甲基化状态;而HL-60细胞系RUNX3基因P2启动子为非甲基化的状态。
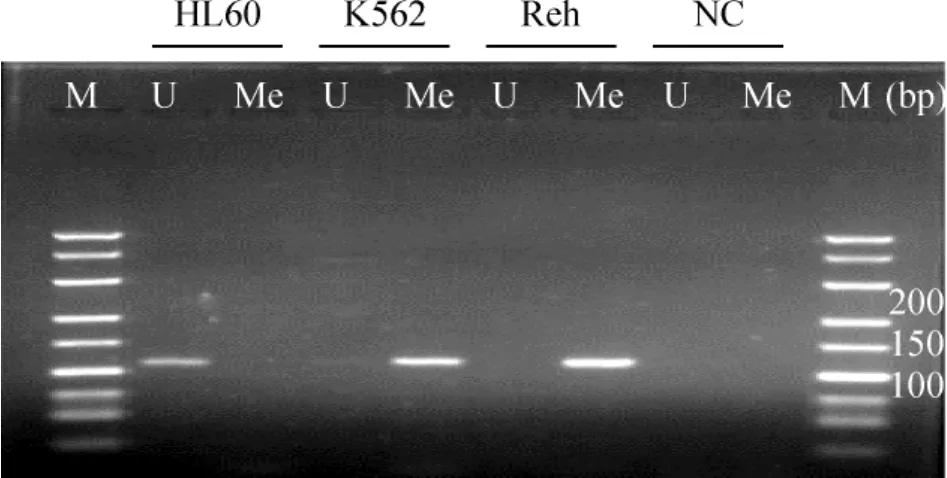
Figure 1.The methylation status of RUNX3 gene P2 promoter in Reh,HL -60 and K562 cells.M:marker;Me:methylation-specific products;U:unmethylation-specific products;NC:negative control.图1 MSP结果
2 RT-PCR检测
用RUNX3基因RT-PCR特异性引物及GAPDH引物进行RT-PCR扩增,HL-60细胞RNA进行RT-PCR一步法扩增后,RT-PCR特异性引物得到了预期大小的扩增产物,见图2,而Reh及K562细胞系RNA无RUNX3基因RT-PCR特异性引物扩增的预期大小产物。GAPDH在RT-PCR扩增时作为内参照,都有预期大小产物生成。实验结果显示:在Reh及K562细胞系,无RUNX3基因表达,而在HL-60细胞系有RUNX3基因的表达,见表2。
讨 论
目前认为,癌基因的激活与过量表达与肿瘤形成有关,同时,抑癌基因的丢失或失活也可能导致肿瘤发生。在抑癌基因的失活或活性降低的发生过程中,抑癌基因的甲基化可能是一个重要机制。对这一问题的研究有助于我们对肿瘤发生机制的认识。
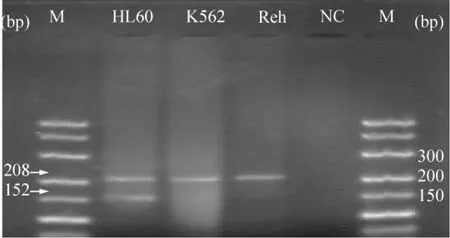
Figure 2.The expression of RUNX3 gene in Reh,HL -60 and K562 cells.M:marker;152 bp:RT-PCR product of RUNX3 gene;208 bp:RT-PCR product of GAPDH;NC:negative control.图2 RT-PCR结果
表2 白血病Reh、HL-60、K562细胞系RUNX3 mRNA的表达Table 2.The expression of RUNX3 mRNA in Reh,HL -60 and K562 cells(.n=5)

表2 白血病Reh、HL-60、K562细胞系RUNX3 mRNA的表达Table 2.The expression of RUNX3 mRNA in Reh,HL -60 and K562 cells(.n=5)
The relative expression level of RUNX3 was normalized against the level of GAPDH.
Cell RUNX3mRNA expression Reh 0 K562 0 HL60 1.36 ±0.19
RUNX3基因为近年来发现的一个抑癌基因,该基因位于人染色体1p36.1上,含有P1、P2两个启动子,其中P2启动子中CG含量高达64%。RUNX3基因编码的蛋白质为含有415个氨基酸的RUNX3蛋白,它广泛表达于各种类型的细胞,尤其在人消化道上皮细胞及血液细胞最为显著[3]。RUNX3的抑癌机制被认为可能与转化生长因子β(transforming growthfactor beta,TGF-β)的功能有关,为其下游通路的一个环节,参与细胞生长的负调控[4]。
DNA的甲基化是指在甲基转移酶(DNA methyltransferases,DNMT)的作用下,将甲基添加到胞嘧啶(C)的5位碳原子上,转变成5-甲基胞嘧啶。一个基因的启动子区域CpG岛异常甲基化(高甲基化)常导致该基因的表达下调或缺失。
研究发现,在多种实体瘤中,癌组织有RUNX3基因启动子的高甲基化率,而相应正常组织RUNX3基因启动子甲基化率低或是非甲基化的状态。并且认为,RUNX3基因P2启动子的甲基化是导致该基因失活、表达缺失、促进肿瘤发生发展的重要因素。
关于RUNX3基因启动子甲基化状态在白血病细胞系及白血病患者中的报道较少。在仅有的几篇报道中,对一些细胞系的甲基化状态研究方面存在矛盾的结果。白血病因类型、染色体改变、免疫表型、融合基因等不同,所采取的治疗方案也不同。因此对于白血病发病机制的认识,有助于对白血病治疗方案的选择。例如作为急性髓性白血病的一个特殊类型,急性早幼粒细胞白血病针对其特殊的分子发生机制有独特的治疗方法,并且有较好的治疗效果。因此对不同类型白血病发病机制的探究,将有助于白血病的治疗。
在本研究中,Reh及K562细胞系,RUNX3基因P2启动子的甲基化为阳性,RT-PCR检测无该基因的表达;而在HL-60细胞系RUNX3基因P2启动子的甲基化为阴性,RTPCR检测有该基因的表达。结合Cheng等[5]的报道,用5-氮杂2’-脱氧胞苷(5-aza-2’-deoxycytidine,5-Aza)处理Reh后,RUNX3的表达恢复,这提示我们:在白血病Reh及K562细胞系,RUNX3基因P2启动子为甲基化的状态,P2启动子的甲基化可能是导致该基因失活、基因表达缺失的重要因素。这个机制可能在Reh及K562细胞系所代表的急性淋巴细胞白血病及慢性髓性白血病的发病过程中起到一定作用。上述3种细胞系之间RUNX3基因表达的明显差异(P<0.01)可能就在于它们之间RUNX3基因P2启动子甲基化状态的不同。因本实验中,急性淋巴细胞性白血病及慢性髓性白血病只分别选取了1种细胞系,不能代表该类型所有细胞系。Cheng等[5]认为在急性淋巴细胞白血病及慢性髓性白血病细胞中RUNX3基因启动子的甲基化率分别为2/4和1/2。在白血病的发病机制中,传统认为染色体易位、蛋白融合是一个重要的特征,而目前认为有遗传和表观遗传机制的共同作用。表观遗传作用在肿瘤发生过程中的作用越来越被学者们所认识[6]。
RUNX3基因P2启动子甲基化在多种肿瘤中都有发生,并且在很多实验中发现,在癌前病变中就有该基因的失活。李文庆等[7]认为,RUNX3的表达与幽门螺杆菌感染相关胃黏膜病变程度呈明显的负相关,病变越重表达越低。Li等[8]发现在胃黏膜的肠化生组织比正常上皮细胞的RUNX3表达明显降低。因此提示我们RUNX3基因可作为早期诊断的分子指标。在白血病发病的高危人群,我们可以通过检测RUNX3基因P2启动子的甲基化状态,进行早期诊断,以期早治疗。
RUNX3基因P2启动子甲基化状态可作为预后诊断的因素。Araki等[9]在对肺癌病例进行分析发现,RUNX3高表达的病例5年生存率明显高于低表达者,认为RUNX3可以作为预后诊断的因素。林东军等[10]在研究急性白血病患者时发现,存在RUNX3启动子区域甲基化的患者首次化疗后完全缓解率低于未甲基化者,认为对RUNX3启动子区域甲基化的检测有助于对预后的估计。黄珍等[11]在研究儿童急性白血病时也有相同结论。因而,对于RUNX3基因P2启动子甲基化状态的研究有助于我们对白血病患者预后的判断。
与遗传学的变化不同,表观遗传学的修饰具有可逆性,可以通过药物处理使其发生逆转,使得表观遗传学的改变可以作为药物治疗的靶点。在一些实验中发现,恢复RUNX3的表达,使细胞生长速度减慢,可促进细胞凋亡,抑制肿瘤生长[12],因而也为临床白血病的治疗提供了一个新的方向。目前,已经有实验[13]利用核苷类似物来抑制DNMT活性,达到降甲基化的目的。但同时也有学者提出了不同的看法,认为在降甲基化治疗的同时,可能引起其它肿瘤发生的风险[14]。这些问题尚需要进一步研究探索。
[1]Chen Y,Gu L,Zhou C,et al.Relapsed APL patient with variant NPM -RARα fusion responded to arsenic trioxide- based therapy and achieved long - term survival[J].Int J Hematol,2010,91(4):708 -710.
[2]Homma N,Tamura G,Honda T,et al.Spreading of methylation within RUNX3 CpG island in gastric cancer[J].Cancer Sci,2006,97(1):51 -56.
[3]Bangsow C,Rubins N,Glusman G,et al.The RUNX3 gene- sequence,structure and regulated expression[J].Gene,2001,279(2):221 -232.
[4]Miyazono K,Suzuki H,Imamura T.Regulation of TGF - β signaling and its roles in progression of tumors[J].Cancer Sci,2003,94(3):230 -234.
[5]Cheng CK,Li L,Cheng SH,et al.Transcriptional repression of the RUNX3/AML2 gene by the t(8;21)and inv(16)fusion proteins in acute myeloid leukemia[J].Blood,2008,112(8):3391 -3402.
[6]AL - Moundhri MS,Al- Nabhani M,Tarantini L,et al.The prognostic significance of whole blood global and specific DNA methylation levels in gastric adenocarcinoma[J].Plos One,2010,5(12):e15585.
[7]李文庆,潘凯枫,张 阳,等.胃癌高发区人群RUNX3表达与胃黏膜病变的关系[J].北京大学学报:医学版,2009,41(3):348 -352.
[8]Li QL,Ito K,Sakakura C,et al.Causal relationship between the loss of RUNX3 expression and gastric cancer[J].Cell,2002,109(1):113 -124.
[9]Araki K,Osaki M,Nagahama Y,et al.Expression of RUNX3 protein in human lung adenocarcinoma:Implications for tumor progression and prognosis[J].Cancer Sci,2005,96(4):227 -231.
[10]林东军,范蕊芳,刘相富.runx3启动子区域甲基化在急性白血病中意义的初步研究[J].中国实验血液学杂志,2008,16(2):263 -266.
[11]黄 珍,高 楠,岑建农,等.Runx3基因启动子甲基化与儿童急性白血病关系的研究[J].中国实用儿科杂志,2009,24(9):705 -707,710.
[12]Peng Z,Tang H,Wang X,et al.Inhibition of the growth and metastasis of human colon cancer by restoration of RUNX3 expression in cancer cells[J].Int J Oncol,2008,33(5):979- 984.
[13]Yang AS,Doshi KD,Choi SW,et al.DNA methylation changes after 5-aza -2’-deoxycytidine therapy in patients with leukemia[J].Cancer Res,2006,66(10):5495-5503.
[14]Gaudet F,Hodgson JG,Eden A,et al.Induction of tumors in mice by genomic hypomethylation [J].Science,2003,300(5618):489-492.
