肾上腺髓质素对内毒素性休克大鼠心肌细胞β-肾上腺素受体激动剂反应性的影响*
2011-08-02张晓晖金满文
张晓晖, 金满文
(1广州中医药大学深圳附属医院中心实验室,广州 深圳 518033;2华中科技大学同济医学院基础医学院药理学系,湖北 武汉 430030)
在内毒素血症中,细菌或脂多糖(lipopolysaccharide,LPS)启动一系列的细胞内反应,导致心脏收缩效能的降低、左心室功能不全[1],其机制目前尚不清楚。肾上腺髓质素(adrenomedullin,ADM)是一种多功能的调节肽[2],在多种不同的病理生理条件下,特别是内毒素性休克时,其循环血液中的水平显著提高[3]。另外在心脏组织中已检测到ADM mRNA的表达、ADM免疫活性及其丰富的结合部位,ADM已被看成是调节心脏功能的自分泌或旁分泌因子[4]。我们用高剂量ADM长时间孵育正常心室肌细胞来模拟内毒素血症时的过度产生,并以细胞缩短为指标,研究内毒素症休克对心肌收缩的影响及ADM在其中的作用。
β-肾上腺素受体信号系统是介导心肌收缩的主要通路之一。该系统主要包括β-肾上腺素受体、G-蛋白、腺苷酸环化酶(adenyl cyclase,AC)、蛋白激酶 A(protein kinase A,PKA)和收缩结构的组成元素。内毒素性休克时,循环血液中增加的ADM可减少人心肌细胞缩短速率,并钝化β-肾上腺素受体介导的心肌细胞缩短速率的增加[5]。此外,心肌细胞对β-肾上腺素受体刺激的正性变力反应与细胞内cAMP的增加相关联。因此,我们以细胞内cAMP的水平为指标,探讨ADM对内毒素性休克大鼠β-肾上腺素受体信号系统的影响。
材料和方法
1 动物和试剂
健康雄性SD大鼠,10-15周龄,体重250-300 g,由同济医学院实验动物中心提供。人ADM和ADM-(22-52)购于 Peninsula Laboratories。LPS(Escherichia coli serotype 0111∶B4)、牛血清白蛋白、XIV型蛋白酶、异丙肾上腺素(isoprenaline,Iso)、forskolin(FKN)、3-异丁基 -1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)和其它化学试剂购于Sigma-Aldrich。Ⅱ型胶原酶为Worthington产品。
2 内毒素性休克动物模型
参照文献[6]方法,大鼠腹腔内注射LPS(10mg/kg,ip)诱导内毒素血症。LPS处理4 h后,出现竖毛、淡漠、腹泻等内毒素血症体征的清醒大鼠被用于实验。大约10%动物不出现上述体征,即LPS抵抗的大鼠,则从实验中剔除。正常对照组动物注射生理盐水(1 mL/kg,ip)。后续实验中不再用LPS处理心肌细胞。
3 细胞分离程序
单个心室肌细胞参照文献[6]所述的酶解法分离。断颈处死动物,迅速开胸,取出心脏并固定于Langendorff装置上。使用37℃氧饱和的蒂罗德液灌流心脏冠脉系统5 min后,再用无钙蒂罗德液灌流5 min,然后用含有1.75 g/L II型胶原酶,1 g/L小牛血清白蛋白和0.28 g/L XIV型蛋白酶的无钙蒂罗德液灌流20-30 min。取下变软的心脏,轻轻吹打,使心肌细胞悬浮于高K+溶液(mmol/L):10 KCl,120谷氨酸钾,10 KH2PO4,1.8 MgSO4,10 牛磺酸,10 HEPES,0.5 EGTA,20葡萄糖,10甘露醇,用KOH调pH值至7.3。实验前将分离的心肌细胞于室温下放置至少1 h。
4 测定心肌细胞收缩
心室肌细胞收缩指标通过一个视频边缘检测系统(Ion-Optix)测定,在60 Hz频率下对细胞长度进行采样。简单地说,就是将细胞放置于浴槽,后者固定于倒置显微镜(Nikon)下。用铂电极以20%阈上刺激、0.2 Hz的频率对细胞进行场刺激(Model S88,Grass)。心肌细胞经显微镜附带的照相系统(IonOptix MyoCam)显示于计算机的显示屏上。SoftEdge Acquisition软件(IonOptix)捕捉并将细胞长度转化成为数字信号。IonWizard分析软件 (IonOptix)分析这些数字信号以获得细胞收缩的指标。最大细胞缩短程度用静息细胞长度的百分比表示。实验在室温(22-24℃)下进行。
5 细胞内cAMP含量的测量
上述分离的心肌细胞悬浮于20 mL台式液。调整心肌细胞数至6×107/L缓冲液,并置于聚丙乙烯管。在显微镜下观察,细胞悬液中呈杆状的心肌细胞,即有活力的心肌细胞占60% -70%。心肌细胞预先用100 μmol/L IBMX在37℃孵育15 min,防止cAMP降解。加入100 nmol/L ADM-(22-52)孵育30 min。然后分别加入1 μmol/L Iso处理细胞3 min或1 μmol/L FKN处理细胞5 min。
4℃离心收集细胞,PBS洗涤细胞3次,弃上清。加0.05 mol/L HCl,并放置于沸水中煮3 min。冷却并冷冻干燥,冻存于-80℃冰箱备用。按cAMP试剂盒(cyclic AMP EIA kit,Bio-medical Technologies)说明,用ELISA的方法测量心肌细胞内cAMP含量。在分光光度计(ImmunoReader NJ2001,Japan Inter Med)410 nm处读取吸光度值。每孔测量3次。Bradford技术(Bio-Rad protein assay)进行样本蛋白定量,实验结果用nmol/g蛋白表示。
6 实验分组
(1)对照(control)组:正常心肌细胞;(2)LPS处理组:自内毒素休克大鼠分离得到的休克心肌细胞;(3)LPS+ADM-(22-52)组:用100 nmol/L ADM-(22-52)处理休克心肌细胞30 min;(4)control+ADM 60 min组:用100 nmol/L ADM孵育正常心肌细胞60 min;(5)control+ADM 60 min+ADM-(22-52)30 min组:用100 nmol/L ADM孵育正常心肌细胞60 min,后用100 nmol/L ADM-(22-52)处理心肌细胞30 min。
7 统计学处理
结 果
1 内毒素休克对大鼠心肌细胞收缩的影响
图1显示内毒素休克大鼠模型的心肌细胞缩短程度较正常对照组心肌细胞明显减弱(P<0.01)。100 nmol/L ADM-(22-52)与休克心肌细胞孵育30 min,细胞缩短程度可完全恢复,与休克心肌细胞比,显著差异(P<0.01),与正常对照细胞比较,无显著差异(P>0.05)。

Figure 1.The effects of LPS and ADM on rat myocardial cell shortening **P <0.01 vs control group;##P <0.01 vs LPS group.图1 LPS及ADM对大鼠心肌细胞缩短的影响
2 ADM对正常大鼠心肌细胞收缩的影响
如图2所示,100 nmol/L ADM与正常心肌细胞孵育时间超过60 min时,细胞缩短程度比正常细胞明显减弱(P<0.01)。100 nmol/L ADM-(22-52)继续孵育心肌细胞30 min,细胞缩短程度可完全恢复。
3 肾上腺髓质素对内毒素休克大鼠心肌细胞β-肾上腺素受体激动剂反应性的影响
如图3所示,内毒素休克心肌细胞 cAMP基础水平[(10.95±3.20)nmol/g protein,n=8]较正常心肌细胞[(15.74 ±3.32)nmol/g protein,n=7,P <0.05]降低。休克细胞经100 nmol/L ADM-(22-52)孵育30 min后,其基础水平cAMP恢复至正常水平(n=6,P>0.05)。
经磷酸二酯酶抑制剂IBMX处理后,正常心肌细胞、内毒素休克心肌细胞和ADM-(22-52)处理的休克心肌细胞的cAMP水平与前面结果相似,提示 IBMX处理对基础水平cAMP影响不大。
如图3显示,1 μmol/L Iso诱导正常心肌细胞cAMP增加至(56.40±7.74)nmol/g protein(n=7);诱导休克心肌细胞cAMP增加至(40.35±5.23)nmol/g protein(n=8),明显较正常心肌细胞减弱(P<0.01);ADM-(22-52)处理的休克心肌细胞cAMP水平增加至(52.45±9.23)nmol/g protein(n=6),与相应休克心肌细胞比较差异显著(P<0.05);与相应正常心肌细胞比较无显著差异(P>0.05)。

Figure 2.The effect of ADM treatment for 60 min on rat myocardial cell shortening.*P<0.05 vs control group.图2 ADM孵育60 min对正常大鼠心肌细胞缩短的影响
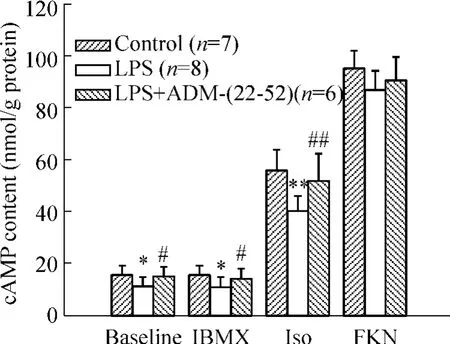
Figure 3.The effect of ADM on β - adrenergic responsiveness in cardio myocytes of septic shock rats..*P<0.05,**P < 0.01 vs corresponding control group;#P<0.05,##P <0.01 vs corresponding LPS group.图3 ADM对内毒素性休克大鼠心肌细胞β-肾上腺素受体激动剂反应性的影响
1 μmol/L FKN诱导正常心肌细胞cAMP增加至(95.29±7.06)nmol/g protein(n=8),使休克心肌细胞cAMP增加至(87.29±8.00)nmol/g protein(n=6),使ADM-(22-52)处理的休克心肌细胞cAMP水平则增加至(91.22±8.55)nmol/g protein(n=6),3组之间无显著差异(P>0.05)。
讨 论
本研究观察到,休克心肌细胞缩短程度较正常心肌细胞明显减弱,提示内毒素体克影响了心肌细胞的收缩功能,这与以前小鼠、家兔和豚鼠的研究结果一致[7-9]。
特异性的ADM受体拮抗ADM-(22-52)可使减弱的休克心肌细胞收缩恢复正常,提示ADM在内毒素性休克心功能不全中具有重要作用。由于ADM在内毒素性休克中大量产生,我们用高剂量的ADM孵育正常心肌细胞,若正常心肌细胞与ADM孵育时间超过60 min,则表现出明显的负性肌力作用;特异性的ADM受体拮抗ADM-(22-52)可取消以上负性肌力作用。这说明ADM可直接抑制心肌细胞收缩。有学者在家兔心室肌细胞上也观察到了ADM的负性变力作用,它还同时减小[Ca2+]i和L型钙电流,并发现这些作用部分经由左旋精氨酸-NO途径介导[10]。
β-肾上腺素受体信号系统是介导心肌收缩的主要通路之一。在研究中,与正常对照组比较,用Iso刺激内毒素性休克大鼠的β-肾上腺素受体,cAMP的增加明显减少。Forskolin(一种直接的AC激动剂)增加cAMP的作用在两组间没有变化。以上结果说明内毒素性休克大鼠心肌细胞对β-肾上腺素受体刺激反应性的缺陷存在于AC水平之前,有可能在β-肾上腺素受体与AC之间,或是出现β-肾上腺素受体下调,内毒素性休克并不影响AC的水平或功能。这与早前的研究结果类似。Risφe等[11]发现,内毒素性休克大鼠心脏7型AC的mRNA表达减少,而4型AC的mRNA表达是增加的,另外两种5型和7型AC的mRNA表达在对照和模型组之间没有差异,因而总体mRNA水平不变。Matsuda等[12]发现,内毒素性休克的家兔β-肾上腺素受体密度与正常组比较没有变化,而 Gsα蛋白和GsαmRNA的表达却减少了50%。
本研究发现特异性的ADM受体拮抗剂ADM-(22-52)可恢复内毒素性休克时心肌细胞对β-肾上腺素受体激动剂的反应性降低,说明内毒素性休克时过量产生的ADM使大鼠心肌细胞收缩减弱,有可能是因为ADM使大鼠心肌细胞对β-肾上腺素受体刺激的反应性降低。人心脏衰竭的特征之一是对β-肾上腺素受体刺激的变力反应性减弱,这种变化通常都归因于β-肾上腺素受体下调[13]和(或)G蛋白的改变[14]。近来的研究提示NO产生增加可能是引起衰竭心脏β-肾上腺素受体低反应性的另一机制[15]。ADM可刺激多种细胞NO产生增加或iNOS表达增加[16]。ADM是否通过后二者的增加影响内毒素性休克大鼠β-肾上腺素能受体信号系统的反应性还有待进一步研究。
[1]Lancel S,Joulin O,Favory R,et al.Ventricular myocyte caspases are directly responsible for endotoxin-induced cardiac dysfunction[J].Circulation,2005,111(20):2596-2604.
[2]Hinson JP,Kapas S,Smith DM.Adrenomedullin,a multifunctional regulatory peptide [J].Endocr Rev,2000,21(2):138-167.
[3]Matheson PJ,Mays MP,Hurt RT,et al.Adrenomedullin is increased in the portal circulation during chronic sepsisin rats[J].Am J Surg,2003,186(5):519 -525.
[4]Jougasaki M,Wei CM,McKinley LJ,et al.Elevation of circulating and ventricular adrenomedullin in human congestive heart failure[J].Circulation,1995,92(3):286 -289.
[5]Mukherjee R,Multani MM,Sample JA,et al.Effects of adrenomedullin on human myocyte contractile function and β -adrenergic response[J].J Cardiovasc Pharmacol T-her,2002,7(4):235 -240.
[6]Zhang XH,Li GR,Bourreau JP.The effect of adrenomedullin on the L-type calcium current in myocytes from septic shock rats:signaling pathway[J].Am J Physiol Heart Circ Physiol,2007,293(5):H2888 -H2893.
[7]Ichinose F,Buys ES,Neilan TG,et al.Cardiomyocytespecific overexpression of nitric oxide synthase 3 prevents myocardial dysfunction in murine models of septic shock[J].Circ Res,2007,100(1):130 -139.
[8]Yasuda S,Lew WY.Angiotensin II exacerbates lipopolysaccharide-induced contractile depression in rabbit cardiac myocytes[J].Am J Physiol,1999,276(5 Pt 2):H1442-H1449.
[9]Thompson M,Kliewer A,Maass D,et al.Increased cardiomyocyte intracellular calcium during endotoxin-induced cardiac dysfunction in guinea pigs[J].Pediatr Res,2000,47(5):669 -676.
[10]Ikenouchi H,Kangawa K,Matsuo H,et al.Negative inotropic effect of adrenomedullin in isolated adult rabbit cardiac ventricular myocytes[J].Circulation,1997,95(9):2318-2324.
[11]Risφe PK,Wang Y,Stuestφl JF,et al.Lipopolysaccharide attenuates mRNA levels of several adenylyl cyclase isoforms in vivo[J].Biochim Biophys Acta,2007,1772(1):32-39.
[12]Matsuda N,Hattori Y,Akaishi Y,et al.Impairment of cardiac β-adrenoceptor cellular signaling by decreased expression of Gsαin septic rabbits[J].Anesthesiology,2000,93(6):1465-1473.
[13]Ogletree-Hughes ML,Stull LB,Sweet WE,et al.Mechanical unloading restores β-adrenergic responsiveness and reverses receptor downregulation in the failing human heart[J].Circulation,2001,104(8):881 -886.
[14]He JQ,Balijepalli RC,Haworth RA,et al.Crosstalk of beta-adrenergic receptor subtypes through Giblunts β -adrenergic stimulation of L-type Ca2+channels in canine heart failure[J].Circ Res,2005,97(6):566 -573.
[15]Bendall JK,Damy T,Ratajczak P,et al.Role of myocardial neuronal nitric oxide synthase-derived nitric oxide in β-adrenergic hyporesponsiveness after myocardial infarction -induced heart failure in rat[J].Circulation,2004,110(16):2368-2375.
[16]Xu Y,Krukoff TL.Adrenomedullin stimulates nitric oxide production from primary rat hypothalamic neurons:roles of calcium and phosphatases[J].Mol Pharmacol,2007,72(1):112-120.
