MMP-9和iNOS在胎膜早破胎膜组织中的表达及相关性研究
2011-08-02范建辉崔金晖滕奔琦陈新娟侯红瑛
范建辉, 崔金晖, 滕奔琦, 陈新娟, 侯红瑛
(中山大学附属第三医院产科,广东 广州 510630)
胎膜早破(premature rupture of membranes,PROM)是指在临产前胎膜发生破裂,是影响母儿健康安全常见的并发症之一,包括足月胎膜早破(term premature rupture of membranes,tPROM)和早产胎膜早 破(preterm prematureruptureofmembranes,pPROM)。国内统计发现[1],PROM 占足月妊娠的10%,占早产的2% -3.5%,30% -40%的早产和pPROM有关[2]。发生胎膜破裂后由于其屏障作用消失,使得围生期母儿的发病率、死亡率升高。国内外学者对PROM的病因及发病机制进行了长期大量的研究,但其确切的病因及发病机制至今仍未明确,本研究通过检测基质金属蛋白酶-9(matrix metallproteinase-9,MMP-9)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)在胎膜组织中的表达,探讨PROM发生的相关机制。
材料和方法
1 材料
1.1 研究对象 选取2010年4月-2011年1月我院行规律产检并临产前行剖宫产终止妊娠者共60例,均无复发性流产,无吸烟、酗酒、吸毒等不良生活习惯,排除妊娠合并内外科疾病、妊娠期并发症,其中pPROM组、tPROM组、正常足月妊娠组(对照组)各20例,经统计学分析,3组孕妇的年龄、孕产次无显著差异。
1.2 器材及试剂 恒温机(Thermo),离心机(Thermo),酶标仪(Thermo),微量加液器(Eppendorf),iNOS兔抗人多克隆抗体(ab3523,Abcam),MMP-9兔抗人多克隆抗体(ab76003,Abcam)。二步法抗兔/鼠通用型免疫组化检测试剂盒,内含试剂:ChemMateTMEnVisionTM/HRP(兔/小鼠)、DAB缓冲稀释液和DAB原液(GK500705/10,上海基因科技公司)。人MMP-9酶联免疫分析(ELISA)试剂盒(Uscnlife)。
2 方法
2.1 诊断标准 根据早孕B超及停经时间准确核对孕周,PROM诊断标准参考全国高等学校教材《妇产科学》第7 版[1]标准。
2.2 标本收集 所有病例均于剖宫产术前常规留取静脉血3 mL,术中切开子宫肌层、暴露胎膜后用注射器抽取羊水3 mL。标本放于-4℃冰箱中过夜后离心20 min,取上清液放于-20℃冰箱保存待测。胎盘娩出后立即在无菌条件下取胎膜破口处胎膜组织5-10 g,无菌生理盐水冲洗去除血迹及羊水,置于10%甲醛固定24-48 h后行常规石蜡包埋,切片、烤片,其中每个标本切片4张(5 μm),分别进行HE染色和iNOS、MMP-9免疫组化染色,另一张备用或者用作阴性对照。
2.3 结果判断
①HE染色 显微镜观察中性粒细胞浸润,每高倍镜视野5-10个为轻度,11-30个为中度,>30个为重度,中-重度中性粒细胞浸润者判断为绒毛膜羊膜炎[3]。
②免疫组织化学染色 MMP-9和iNOS均表达在细胞浆中,以细胞浆中出现棕黄色颗粒为阳性,与背景颜色一致或无明显着色为阴性,随机选择5个高倍视野(×400),参照 Barnes等[4]进行综合评分,见表1。

表1 MMP-9和iNOS在胎膜组织中表达的评分Table 1.The scoring of MMP-9 and iNOS expression in fetal membranes
3 统计学处理
结 果
1 MMP-9在胎膜组织中的表达
MMP-9在 tPROM 组(图 1B)、pPROM 组(图1C)孕妇胎膜中的表达水平均高于对照组(图1A),差异显著(均P<0.01)。MMP-9在tPROM组孕妇胎膜中的表达与pPROM组比较,无显著差异(P>0.05),见表 2。

Figure 1.The immunohistochemical staining of MMP-9(×400).A:normal group;B:tPROM group;C:pPROM group.图1 MMP-9的免疫组化染色
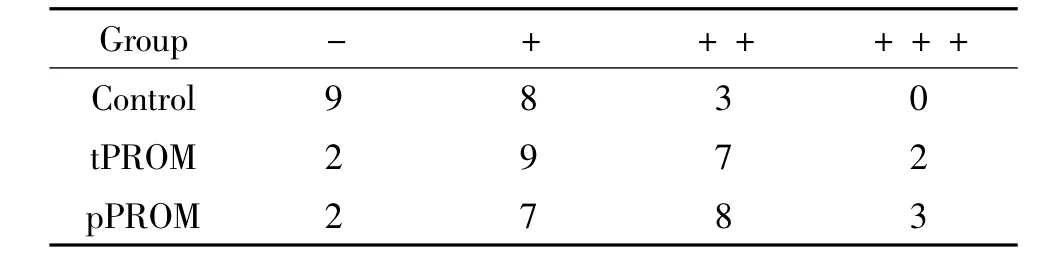
表2 MMP-9在胎膜组织中的表达Table 2.The expression of MMP-9 in fetal membranes of the three groups(n=20)
2 孕妇血清、羊水中MMP-9水平比较
MMP-9在3组孕妇不同组间母血及羊水的表达水平比较,pPROM组>tPROM组>对照组,差异显著(P <0.01),见表3。
表3 MMP-9在血清及羊水中的表达Table 3.The level of MMP-9 in serum and amniotic fluid in the three groups(ng/L..n=20)

表3 MMP-9在血清及羊水中的表达Table 3.The level of MMP-9 in serum and amniotic fluid in the three groups(ng/L..n=20)
**P <0.01 vs control;##P <0.01 vs tPROM.
Group Serum Amniotic fluid Control 89.74 ±22.85 51.48 ±22.59 tPROM 371.10 ±134.83** 100.04 ±26.50**pPROM 208.76 ±103.82**## 71.36 ±20.49**##
3 iNOS在胎膜组织中的表达
iNOS在炎症细胞中高表达,在pPROM组(图2C)孕妇胎膜中的表达水平高于对照组(图2A),差异显著(P<0.01);iNOS在 tPROM 组(图2B)孕妇胎膜中的表达与对照组比较,无显著差异(P>0.05),与pPROM组比较,无显著差异(P>0.05),见表4。
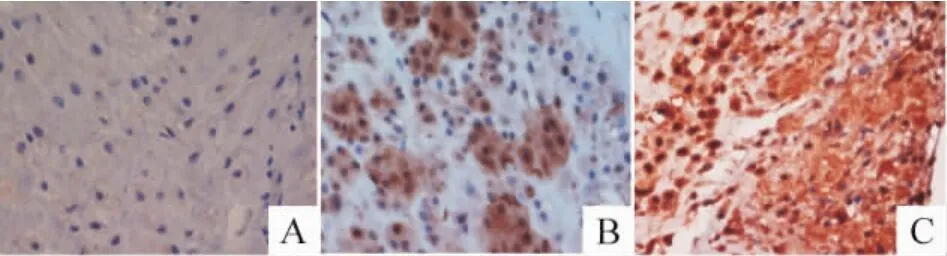
Figure 2.The immunohistochemical staining picture of iNOS(×400).A:normal group;B:tPROM group;C:pPROM group.图2 iNOS的免疫组化染色图片
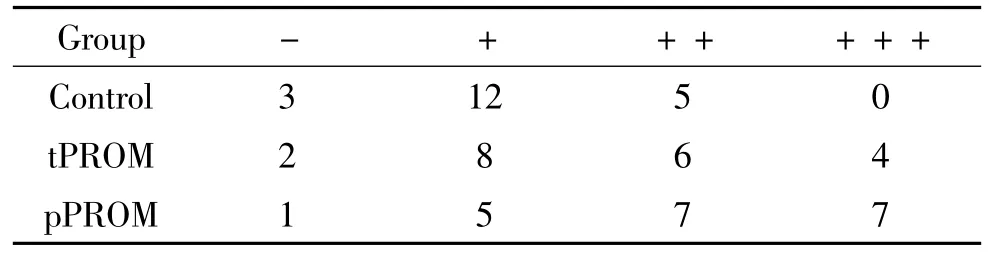
表4 iNOS在胎膜组织中的表达Table 4.The expression of iNOS in fetal membranes of the three groups(n=20)
4 MMP-9、iNOS与绒毛膜羊膜炎的关系
60例孕妇的胎膜组织全部进行HE染色,其中绒毛膜羊膜炎(图3B、C)18例,非绒毛膜羊膜炎(图3A)42例。MMP-9在绒毛膜羊膜炎胎膜中的表达水平高于非绒毛膜羊膜炎者,差异显著(P<0.05),iNOS在绒毛膜羊膜炎胎膜中的表达水平高于非绒毛膜羊膜炎者,差异显著(P <0.01),见表5、6。

Figure 3.The hematoxylin and eosin(HE)staining of fetal membranes(×200).A:normal fetal membranes;B:mild chorioamnionitis;C:severe chorioamnionitis.图3 胎膜组织的HE染色
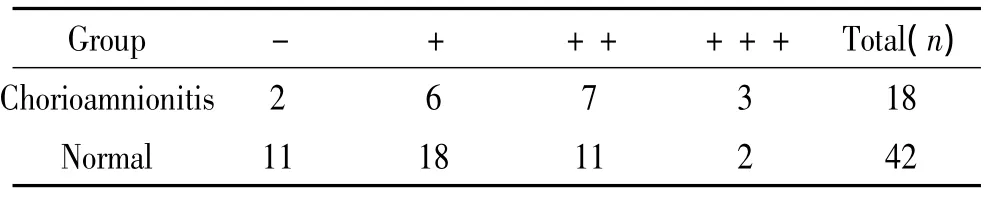
表5 绒毛膜羊膜炎与MMP-9表达的相关性Table 5.The relationship between chorioamnionitis and MMP-9 expression
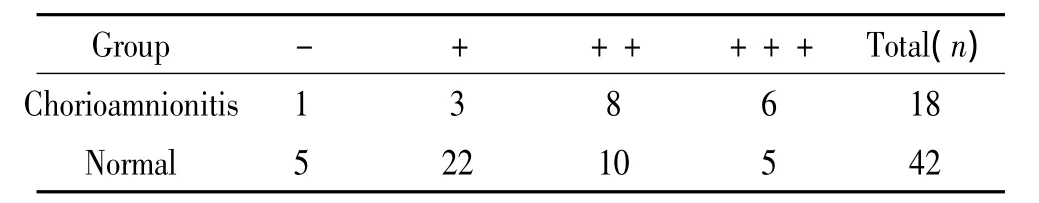
表6 绒毛膜羊膜炎与iNOS表达的相关性Table 6.The relationship between chorioamnionitis and iNOS expression
5 对孕妇胎膜中MMP-9和iNOS的表达做相关分析
相关分析表明MMP-9与iNOS在胎膜中的表达水平呈正相关(r=0.476,P <0.01),见表7。
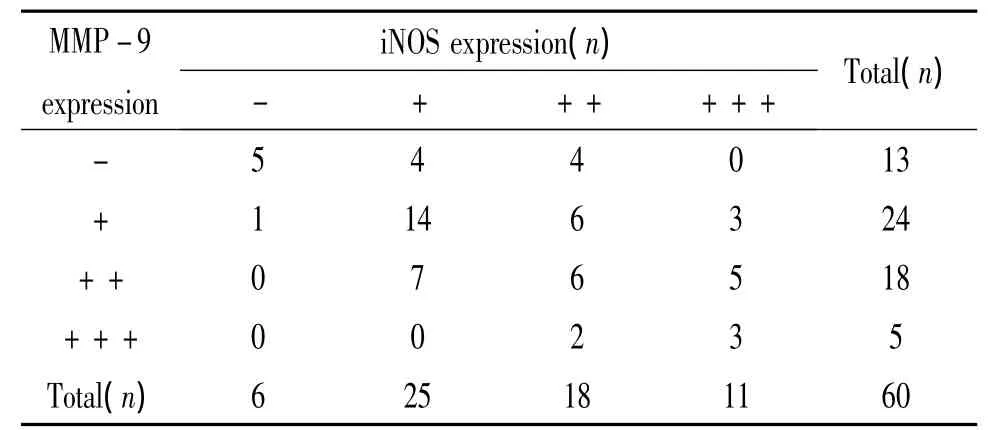
表7 MMP-9和iNOS表达的相关性Table 7.The relationship between MMP-9 and iNOS expression
讨 论
孕期胎膜可以使羊膜腔保持无菌状态,为胎儿的生长发育提供一个稳定的内环境。随着孕周的增大,胎膜发生相应变化使其适应逐渐增长的子宫压力及宫腔容量。近年来,国内外学者们主要从感染、营养、经济状态、社会因素等宏观方面以及细胞凋亡、炎性细胞因子、胎膜酶、氧化应激、基因多态性等微观方面对PROM的病因及发病机制进行研究,表明这几个因素在PROM的发病机制中均起到一定作用,而且它们之间也存在着相互作用,目前多数学者认为PROM的发病应该是多因素、多途径共同相互作用的结果。
1 MMP-9与PROM
基质金属蛋白酶(matrix metalloproteinases,MMPs)是一种降解和破坏细胞外基质的蛋白水解酶,其中MMP-9属于明胶酶B类,是PROM中研究最多的一种基质金属蛋白酶,Mclaren等[5]证实分娩发动前宫颈处胎膜中MMPs尤其是MMP-9的活性显著升高,认为MMP-9参与胎膜中胶原的程序性溶解重建过程,Maymon等[6]发现分娩发动后羊水和胎膜中MMP-9活性明显升高,PROM患者MMP-9在宫颈处胎膜中的浓度比其它地方高,且胎膜中Ⅳ型胶原含量下降明显,与MMP-9的上升具有相关性,提示了MMP-9可能是胎膜破裂发生的重要生理基础。当MMP-9表达过度时,细胞外基质降解加快,导致胎膜强度、韧性下降,胎膜结构弱化,可造成PROM的发生。本研究结果显示MMP-9在3组胎膜中均有一定程度的表达,尤其在羊膜上皮细胞中呈高表达,与文献报道一致[7]。同时显示tPROM组、pPROM组孕妇血清、羊水及胎膜组织中MMP-9的表达水平均高于对照组(P<0.01),证实了MMP-9的正常表达在孕期维持胎膜完整性方面起着重要作用。
2 iNOS与PROM
一氧化氮(nitric oxide,NO)是20世纪80年代发现的一种多功能因子,除了参与许多生理功能外,NO还与众多疾病发生发展密切相关。NO结构简单,性质极不稳定,容易扩散,其生物半衰期只有5 s左右,故对NO的认识大都集中在对NOS的测定。国外学者[8]利用反转录多聚酶链反应技术分析表明,妊娠期NO变化主要由iNOS引起。本实验结果显示iNOS在pPROM组孕妇胎膜中的表达水平高于对照组,差异显著(P<0.01),故可以推断 iNOS在pPROM发病中起到重要作用,此外,本实验结果显示iNOS在tPROM组孕妇胎膜中的表达与对照组比较,差异无显著(P>0.05),提示tPROM与pPROM可能存在不同发病机制,而iNOS在pPROM组孕妇胎膜中的表达与tPROM组比较,差异无显著(P>0.05),iNOS可能并不参与足月胎膜早破的发病,但是也可能与本实验研究例数较少有关。
3 MMP-9、iNOS与绒毛膜羊膜炎
目前,大量的临床医学、流行病学、组织学、微生物学和分子生物学资料提示感染与炎症在PROM的发生中占主要原因[9],且互为因果,当胎膜破裂后细菌通过上行性感染传播到胎膜,诱导或者加重绒毛膜羊膜炎的发生。有国内学者统计发现,pPROM患者中一半与绒毛膜羊膜炎相关[10]。正常情况下MMP-9在体内的合成、分泌、降解均受到严格调控,研究显示细胞因子如IL-6、8、TNF-α及脂多糖[11]等分泌增加可激活MMP-9合成的转录因子如细胞核因子 NF-κB,引起 MMP-9的合成增加,同时MMP-9也可以激活IL-8等,使炎症反应加剧,二者形成正反馈调节[12]。本实验中有绒毛膜羊膜炎孕妇18例,MMP-9在绒毛膜羊膜炎组孕妇胎膜中的表达水平高于非绒毛膜羊膜炎组,差异显著(P<0.05),说明MMP-9表达和体内的炎症反应密不可分,可能参与了绒毛膜羊膜炎的发生,并在感染所致的PROM中发挥重要作用。
妊娠是一个复杂的免疫调控过程,炎症是免疫紊乱发生发展的重要病理机制,iNOS在正常情况下呈低表达,当炎症发生时诱导iNOS表达产生NO,NO经过多种途径,在妊娠感染中调节杀菌机制,使胎儿在胎盘屏障破坏的情况下仍进一步受到保护。当炎症因子持续存在时可使NO水平持续升高,引起炎症级联瀑布反应,将信号波及范围扩大,推动炎症发展。本实验发现iNOS在胎膜中的炎性细胞中高表达,且iNOS在绒毛膜羊膜炎组孕妇胎膜中的表达水平明显高于非绒毛膜羊膜炎组(P<0.01),说明iNOS与炎症反应密不可分,炎症或感染可以导致iNOS的高表达,iNOS的高表达同时也促进了绒毛膜羊膜炎的发生发展,使得妊娠期免疫系统发生紊乱导致胎膜早破的发生。
4 MMP-9、iNOS与PROM
近年来有学者[13]研究发现,在小鼠胚胎着床期应用NO抑制剂抑制NO的产生会影响MMP-2、MMP-9、TIMP-3的基因表达,从而导致影响胚胎着床,从而得出结论NO表达可能激活MMP表达。本研究中我们对60例孕妇胎膜中MMP-9和iNOS的表达进行了Spearman秩相关分析,发现MMP-9与iNOS在胎膜中的表达水平呈正相关(P<0.01),说明MMP-9、iNOS二者在PROM发病中存在关联,NO可能会激活胎膜中的MMP-9,参与胎膜的破裂。生理过程中,NO参与体内环鸟苷酸的(cyclic guanosine monophosphate,cGMP)的产生,所以 NO 可能会通过影响细胞内信号通路中cGMP的产生从而影响MMP-9的表达,另一方面,NO也可能通过影响其它细胞因子的表达间接影响MMP-9的表达及活性[14],作为一种多功能分子,NO也可能直接参与MMP-9的表达的信号转导途径,具体的机制需要进一步研究。Yuan等[15]实验研究发现绒毛膜细胞iNOS的表达使NO产生增多,可以诱导细胞凋亡,从而导致组织活性细胞减少,从而影响胶原纤维合成及细胞外基质沉积,胎膜韧性下降,局部胎膜变薄导致胎膜破裂,故推断NO与PROM的发病可能存在密切相关。
综上所述,MMP-9和iNOS表达升高与pPROM及绒毛膜羊膜炎的发生相关,MMP-9和iNOS在PROM发病机制中存在关联作用,如果通过选择性的iNOS抑制剂干扰导致炎症瀑布反应的信号转导通路,抑制iNOS过量表达而抑制过量NO的产生,可同时下调 MMP-9的表达,有可能减少或预防PROM的发生。
[1]乐 杰,谢 幸,林仲秋,等.妇产科学[M].第7版.人民卫生出版社,2008.137.
[2]漆洪波,吴味辛.重视未足月胎膜早破的研究[J].中华妇产科杂志,2006,41(1):3 -6.
[3]Newton ER.Chorioamnionitis and intraamniotic infection[J].Clin Obstet Gynecol,1993,36(4):795 -808.
[4]Barnes DM,Dubin EA,Fisher CJ,et al.Immunohistochemical detecting of p53 protein in mamary carcinoma:an important new independent indicator of prognosis?[J].Hum Pathol,1993,24(5):469 -476.
[5]Mclaren J,Taylor DJ,Bell SC,et al.Increased concentration of pro-matrix metalloproteinase 9 in term fetal membranes overlying the cervix before labor:implications for membrane remodeling and rupture[J].Am J Obstet Gynecol,2000,182(2):409 -416.
[6]Maymon E,Romero R,Pacora P,et al.Evidence of in vivo differential bioavailability of active forms of matrix metalloproteinases 9 and 2 in parturition,spontaneous rupture of membranes,and intra - amniotic infection[J].Am J Obstet Gynecol,2000,183(4):887 -894.
[7]丁依玲,李婵娟.基质金属蛋白酶2,9在胎膜早破产妇胎膜的表达变化[J].实用妇产科杂志,2005,21(3):174-177.
[8]Suzuki T,Mori C,Yoshikawa H,et al.Changes in nitric oxide production levels and expression of nitric oxide synthase isforms in the rat uterus during pregnancy[J].Biosci Biotechnol Biochem,2009,73(10):2163 -2166.
[9]Menon R,Fortunato SJ.Infection and the role of inflammation in preterm premature rupture of the membranes[J].Best Pract Res Clin Obstet Gynaecol,2007,21(3):467 -478.
[10]周 健,段 涛.未足月胎膜早破的病因学研究进展[J].中国实用妇科与产科杂志,2006,22(6):457 -459.
[11]Li W,Unluqedik E,Bocking AD,et al.The role of prostaglandins in the mechanism of lipopolysaccharide-induced proMMP9 secretion from human placenta and fetal membrane cells[J].Biol Reprod,2007,76(4):654 -659.
[12]高 颖,蔡定芳.基质金属蛋白酶-9与炎症反应研究进展[J].中国病理生理杂志,2003,19(8):1133-1136..
[13]Zhang X,Wang HM,Lin HY,et al.Regulation of matric metalloproteinases(MMPs)and their inhibitors(TIMPs)during mouse peri- implantation:role of nitric oxide[J].Placenta,2004,25(4):243 -252.
[14]柴婵娟,杨志明,康玉明,等.NF-κB信号通路介导AngII诱导THP-1巨噬细胞表达 MMP-9[J].中国病理生理杂志,2009,25(12):2334 -2337.
[15]Yuan B,Ohyama K,Takeichi M,et al.Direct contribution of inducible nitric oxide synthase expression to apoptosis induction in primary smooth chorion trophoblast cells of human fetal membrane tissues[J].Int J Biochem Cell Biol,2009,41(5):1062 -1069.
