Fractalkine对类风湿关节炎患者成纤维样滑膜细胞中NF-κB活化及内源性fractalkine mRNA表达的影响*
2011-08-02郭兴华潘云峰宋泽蓉古洁若
郭兴华, 潘云峰△, 宋泽蓉, 王 昆, 古洁若
(中山大学附属第三医院1风湿免疫科,2骨科,广东 广州 510630)
类风湿关节炎(rheumatoid arthritis,RA)是一种以关节滑膜为主要靶组织的慢性系统性炎症,影响世界上0.5% -1%的人群。滑膜炎症细胞浸润以及衬里层增生是其典型病理表现。增生的衬里层主要由巨噬细胞样滑膜细胞和成纤维细胞样滑膜细胞(fibroblast-like synoviocyte,FLS)组成。小分子炎症介质(花生四烯酸代谢产物)、生长因子、趋化因子、黏附因子、基质金属蛋白酶等触发滑膜细胞的增殖和活化,侵袭并损坏关节软骨、软骨下骨、肌腱和韧带。因此,炎症因子对类风湿关节炎的发生和发展都有重要的作用。而传统的NF-κB通路在类风湿关节炎的炎症进程中有重要地位。NF-κB是可诱导型二聚体转录因子家族中的一员,它拥有5个成分,分别是:Rel(c-Rel)、RelA(p65)、RelB、NF-κB1(p50/p105)和 NF- κB2(p52/p100)。RA 发病中众多细胞因子和细胞黏附分子被激活受到NF-κB的转录调控[1]。同时,RA滑膜表达的许多炎症介质又可作用于NF-κB使其活化,如TNF-α和IL-1β[2],两者构成一反馈机制,导致 RA 炎症反应和结构破坏得以维持与发展。
Fractalkine(FKN),又称 CX3CL1,是 CX3C类趋化因子中的唯一成员,由373个氨基酸组成的大分子蛋白。CX3CR1是FKN的高亲和力受体,属于趋化因子受体超家族成员。Chandrasekar等[3]在动脉平滑肌细胞中发现,FKN可通过NF-κB诱导平滑肌细胞的增殖。RA-FLS可分泌游离的FKN[4],但FKN对RA-FLS NF-κB活化及内源性FKN的表达有无影响,尚未见相关报道。本研究观察FKN刺激RA-FLS后,对细胞中NF-κB活化以及内源性FKN mRNA表达的影响,以期了解FKN对RA中NF-κB活化以及炎症维持和发展的影响。
材料和方法
1 标本采集
类风湿关节炎患者滑膜组织来自2009年3月-2009年8月中山大学附属第三医院行关节置换术,共3例,均取自髋关节。年龄24-50,平均36.3岁,病程8-9年,平均102个月。所有RA患者诊断符合1987年美国风湿病学会(American Rheumatism Association,ARA)类风湿关节炎分类标准。
2 主要试剂
胎牛血清(fetal bovine serum,FBS)购自杭州四季青公司;重组人fractalkine(CX3CL1/FKN)购自PeproTech;培养细胞RNA提取试剂盒、含裂解液、去蛋白液、漂洗液、DEPC处理水、吸附柱、过滤柱、离心管(1.5 mL)和收集管(2 mL)购自北京天根生化科技有限公司;Fermentas RevertAid第1链cDNA合成试剂盒、含DEPC处理水、Oligo(dT)18引物(0.5 g/L)、5×反应缓冲液,Ribolock RNA酶抑制剂(20 g/L)、dNTP混合物和ReverAid M-MuLV反转录酶(2×108U/L)购自 Fermentas;2×Taq Plus PCR Master Mix(预染)购自北京天根生化科技有限公司;DNA marker 1购自北京天根生化科技有限公司;引物由广州英骏生物技术有限公司合成;核蛋白和胞浆蛋白提取试剂盒购自南京凯基生物科技发展有限公司;靶Ⅰ抗:兔抗人抗NF-κB p65单克隆抗体(C22B4)购自Cell Signaling;小鼠抗人抗TATA结合蛋白(TATA -binding protein,TBP)单克隆抗体(MAB3658)购自Millipore;兔抗人抗磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)多克隆抗体购自广州艺佳生物;辣根过氧化物酶(horseradish peroxidase,HRP)标记Ⅱ抗购自武汉博士德。
3 方法
3.1 细胞培养 滑膜组织经无菌条件下处理后,向滑膜组织滴加1-2滴20%FBS培养液,将其锐性剪碎至约1 mm×1 mm×1 mm大小,将组织块移至培养瓶中,均匀摆放到瓶底,将培养瓶翻转,使组织块面位于上方,加入适量20%FBS培养液,置于5%CO2、37℃培养箱中约5 h。将培养瓶轻轻翻转,使组织块浸没于培养液中,避免将组织块冲起。置于培养箱继续培养。根据细胞的生长情况及培养液的变化,每1-3 d更换培养液1次。当细胞生长至覆盖底面>80%时,可进行消化传代培养。经消化传代后获得较纯成纤维样滑膜细胞[5]。本实验均使用第3代滑膜细胞。
3.2 NF-κB活化检测 RA-FLS中加入100 μg/L FKN,分别作用0 h、1 h、2 h后收集细胞,用核蛋白和胞浆蛋白提取试剂盒提取胞核及胞浆蛋白,用Western blotting检测其胞浆及胞核中NF-κB p65蛋白表达的变化,即取25 μg蛋白(胞核或胞浆蛋白),经10%SDS-PAGE电泳分离,电转印到PVDF膜,取膜于5%封闭液中封闭,恒温摇床摇2 h;洗膜5次后,加入Ⅰ抗(NF - κB p651∶300,TBP 1∶500,GAPDH 1∶500,取抗体稀释液稀释),反应1 h,洗膜5次,每次间隔5 min,加HRP标记Ⅱ抗(1∶1000,取抗体稀释液稀释),反应1 h,洗膜5次,每次间隔5 min,加入增强化学发光(enhanced chemiluminescence,ECL)化学发光液,3-5 min后于暗室显影后冲洗胶片。用Quantity One软件进行分析,读取吸光度值(absorbance,A),计算各样本胞浆和胞核中NF-κB p65与胞浆内参(GAPDH)和胞核内参(TBP)的吸光度比值,作为样本的相对吸光度值,以观察各样本胞浆及胞核中NF-κB p65蛋白表达量的变化。
3.3 RT-PCR检测RA-FLS中FKN mRNA表达RA -FLS中加入100 μg/L FKN,分别作用0 h、12 h及18 h后收集细胞,用培养细胞RNA提取试剂盒提取总RNA,用Fermentas RevertAid第1链cDNA合成试剂盒合成 cDNA,即总 RNA 11 μL和 Oligo(dT)181 μg,70 ℃ 反应 5 min,再加 5 × 逆转录缓冲液4 μL、RiboLock RNase Inhibitor 1 μL、dNTP Mix(各10 mmol/L)2 μL,37 ℃ 反应 5 min,再加 RevertAid M -MuLV RT 1 μL,42 ℃反应60 min,最后 70 ℃反应10 min,产物用作PCR。用2×Taq Plus PCR Master Mix(预染)行PCR,引物为:CX3CL1正义链5’-TACCTGTAGCTTTGCTCATCCA-3’,反义链 5’-ACCACAGACTCGTCCATTCC-3’,产物长度为250 bp;β-actin正义链 5’- CGGGACCTGACTGACTACCTC-3’,反义链 5’-ACTCGTCATACTCCTGCTTGC-3’,产物长度为547 bp。PCR反应总体积为20 μL,含RT 产物1 μL ,2 ×Taq Plus PCR Master Mix10 μL,上、下游引物各 0.5 μL,ddH2O 8 μL。反应程序:95℃ 5 min后,95℃ 30 s,64℃ 30 s,72℃15 s,35个循环后再72℃ 8 min。扩增产物于含溴化乙啶琼脂糖凝胶中进行电泳。以目的条带与βactin的电泳条带的吸光度值比值作为mRNA的相对表达量并与对照组比较。
4 统计学处理
用SPSS 13.0统计分析软件进行数据处理,计量资料用均数±标准差()表示,各组间总差异比较用单因素方差分析,两组间差异比较采用LSD法。
结 果
1 重组人FKN对RA-FLS NF-κB活化的影响
结果显示,FKN刺激后1 h后胞浆中NF-κB p65蛋白表达量较对照组(0 h)降低(P<0.05),见图1。2 h后胞核中NF-κB p65蛋白表达量较对照组(0 h)升高(P<0.05),见图2,提示FKN对RAFLS中NF-κB有激活作用。
2 重组人FKN对RA-FLS中FKN mRNA表达的影响
RA-FLS中加入100 μg/L重组人FKN分别作用0 h、12 h、18 h,图3 显示刺激18 h后 FKN mRNA表达量高于对照组(0 h)(P<0.05),提示在0-18 h范围内,随着时间延长,FKN促进RA-FLS内源性FKN mRNA表达增加。
讨 论
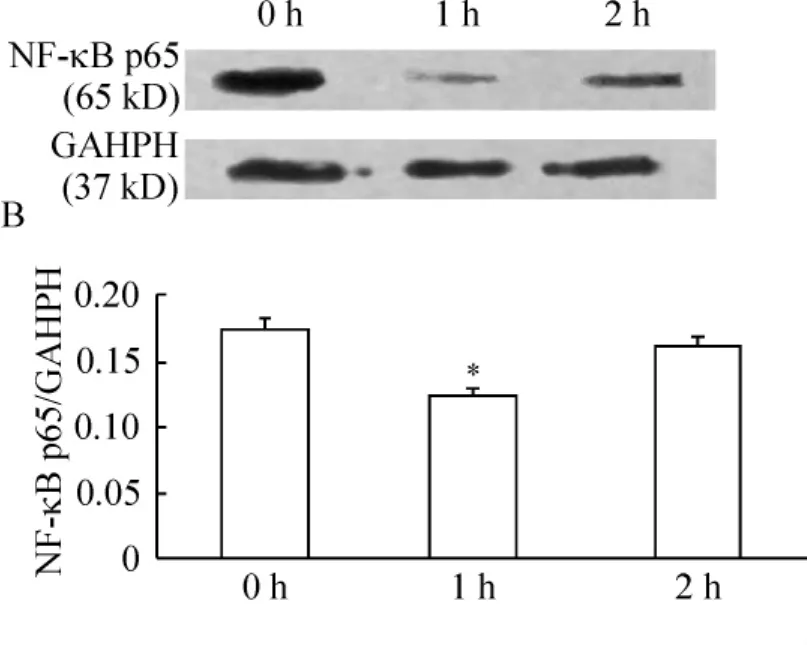
Figure 1.Effect of FKN on NF- κB activity in RA -FLS cytoplasm.NF-κB p65 protein of cytoplasm was detected by Western blotting 0 h,1 h and 2 h after treatment with 100 μg/L FKN..n=3.*P <0.05 vs 0 h group.图1 FKN对RA-FLS胞浆中NF-κB的作用
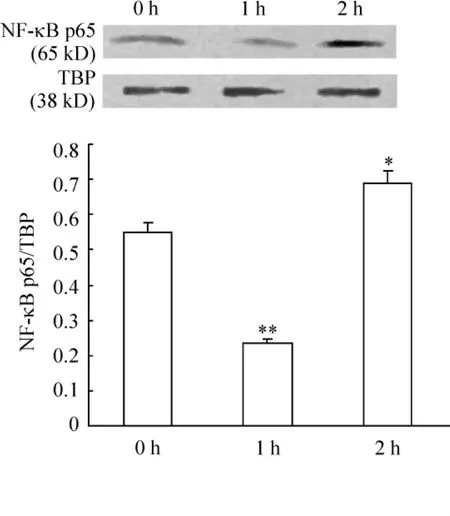
Figure 2.Effect of FKN on NF-κB activity in RA -FLS nucleus.NF - κB p65 protein in nucleus was examined by Western blotting.0 h,1 h and 2 h after 100 μg/L FKN treatment..n=3.*P <0.05,**P <0.01 vs 0 h group.图2 FKN对RA-FLS胞核中NF-κB的作用

Figure 3.Effect of FKN on the expression of FKN mRNA.RAFLS were stimulated with 100 μg/L FKN,and FKN mRNA expression was detected by RT-PCR at different time points.M:DNA marker 1..n=3.*P<0.05 vs 0 h group.图3 FKN对RA-FLS中FKN mRNA表达的影响
NF-κB是一种广泛表达的转录因子,诱导许多炎症细胞和炎症介质产生并导致疾病进展[6]。本实验运用了NF-κB活化后从胞浆转移胞核的原理,检测胞浆和胞核内p65蛋白表达的变化,以证明NF-κB通路是否被活化。实验中显示,当加入100 μg/L FKN 1 h后,胞浆中的p65蛋白即减少,而2 h后胞核中的NF-κB p65蛋白上升,提示当加入FKN后1h NF-κB p65开始转移至胞核,2 h后可检测出胞核内p65蛋白上升,即FKN可激活NF-κB通路。在类风湿滑膜中有丰富的NF-κB,免疫组化分析证实在滑膜衬里层的细胞核中存在p50和p65表达量比较丰富,尤其是 p65的表达[7]。NF-κB参与了RA炎症中许多细胞因子的表达,在与RA有密切关系的基因的表达中发挥关键作用,如单核细胞中的IL-1β、滑膜细胞中的 ICAM -1、TNF-α、IL-6和IL-8。同时滑膜细胞还产生许多酶,这些酶可以降解细胞外基质,破坏软骨和骨质。NF-κB抑制剂可抑制人巨噬细胞和初期RA滑膜细胞这些破坏性酶(如金属蛋白酶、蛋白聚糖酶)和炎症因子(如IL-1β、IL-6、IL-8和 TNF-α)的产生,提示 NF-κB是这些酶和炎症因子合成的基础因素[8]。因此,FKN对NF-κB的活化可促进炎症发展、软骨和骨质的破坏。
进一步实验发现,当加入外源的FKN刺激RA-FLS 18 h后,可表现出其促进内源性FKN mRNA表达的作用,提示RA-FLS中可能存在FKN正反馈现象。在RA患者关节中存在各种各样的炎症因子,部分还可提升FKN表达,起到放大作用,如IFNγ和TNF-α[9]。FKN的这种正反馈作用及其它炎症因子的放大作用可导致RA关节内FKN大量聚集。FKN有黏附、趋化、促进细胞渗出的作用,因此其大量聚集可影响前炎症细胞在关节内浸润和导致CX3CR1+细胞聚集。表达 CX3CR1的细胞包括Th1、Tc1、γδT、NK 细胞、大部分 CD16+NK 细胞、多数的CD14+单核细胞和部分的CD3+T细胞。Th1和Tc1细胞可分泌IFN-γ、TNF-β和IL-2,介导针对细胞内抗原的免疫反应和器官特异性的自身免疫反应。γδT细胞和 NK细胞可表达 CD57、CD11b(细胞毒淋巴细胞的有效标志)和分泌穿孔素和粒酶B。这些提示CX3CR1+细胞是高选择性的趋化细胞毒作用的淋巴细胞(包括NK细胞、细胞毒T细胞和γδT细胞)[10]。这致使大量细胞毒淋巴细胞在关节内聚集,炎症进一步扩大。
除了介导迁移,FKN和CX3CR1还可增强炎症细胞的破坏能力。游离FKN可诱导NK细胞渗出和增强其脱颗粒和溶解细胞的作用,表达CX3CR1的CD8+T细胞具有更强大的细胞毒作用[10]。Yoneda等[11]报道,用固化的FKN刺激NK细胞,或用表达FKN的细胞与NK细胞共培养,可明显上调IFN-γ。Nanki等[12]报道表达 CX3CR1的 CD4+和 CD8+T 细胞在RA患者中增多,这些T细胞都产生IFN-γ和TNF-α。IFN-γ又可促进内皮细胞中FKN的表达[13],这样一个旁分泌正反馈循环,导致RA关节中FKN进一步积聚,继而趋化更多细胞毒作用的淋巴细胞迁移至关节中,并且这些淋巴细胞的作用被加强,最终可能加重RA关节中炎症程度和关节的破坏。
在RA滑膜中,CX3CR1可在巨噬细胞、成纤维细胞、内皮细胞和树突状细胞中表达。这提示FKN还可能对这些细胞产生生物效应。CD68+CD16+[14]和CD14+CD16+单核细胞表达CX3CR1,细胞通过CD16与CX3CR1相互作用聚集在滑膜衬里层及滑膜下层中。CD14+CD16+单核细胞表达一些特殊类型的表面分子,而且可产生TNF-α、IL-1β和IL-6,低表达或不表达抗炎因子IL-8,因此这群细胞可迅速地迁移至炎症部位,迅速成熟为促炎症巨噬细胞。游离FKN还可诱导单核细胞分泌IL-1β和IL-6[15]。滑液中CD14+单核细胞表达FKN和CD3+T细胞表达CX3CR1分别与晨僵和肿胀关节数有关[15]。Volin等[16]发现 pmol/L 及 nmol/L 级的游离FKN对人微血管内皮细胞均有趋化和激动的作用,可诱导更多内皮小管形成,将固化有FKN的基质胶移植到小鼠中,可见新血管形成。FKN还可促进MMP的分泌,进而导致软骨的破坏[17]。
进入核内的NF-κB识别共同的DNA序列,调节一系列靶基因,特别是参与人体免疫系统和抵御病原体的基因的表达,包括许多细胞黏附分子、趋化因子及急性反应蛋白等[3]。RA发病中众多细胞因子和细胞黏附分子受到NF-κB的转录调控,如细胞因子(如 TNF-α、IL-1β、IL-6、IL-2、IL-12、IFN - γ、GM -CSF、EGF[18])、细胞黏附分子(如选择蛋白、VCAM -1、ICAM -1),化学增活素(如 IL-8、MIP-1α、MCP -1、RANTES、嗜酸细胞活化趋化因子)、基质金属蛋白酶(MMP-1、MMP-3、MMP-13)、受体(如 MHC)和诱导酶(如 COX-1、iNOS)[19]。本实验结果提示 RA-FLS中可能存在FKN正反馈现象,FKN对NF-κB有活化作用。在平滑肌细胞中,NF-κB的活化可增加 FKN的表达[3]。在 RA -FLS中,NF-κB的活化是否增加FKN的表达,FKN基因启动子中是否存在NF-κB的结合位点,有待后续研究进一步探讨。
[1]Roman-blas JA,Jimenez SA.NF-κB as a potential therapeutic target in osteoarthritis and rheumatoid arthritis[J].Osteoarthritis Cartilage,2006,14(9):839 -848.
[2]Lee YR,Kweon SH,Kwon KB,et al.Inhibition of IL -1β - mediated inflammatory responses by the IκBα super-repressor in human fibroblast- like synoviocytes[J].Biochem Biophys Res Commun,2009,378(1):90-94.
[3]Chandrasekar B,Mummidi S,Perla RP,et al.Fractalkine(CX3CL1)stimulated by nuclear factor κB(NF -κB)- dependent inflammatory signals induces aortic smooth muscle cell proliferation through an autocrine pathway[J].Biochem J,2003,373(2):547 -558.
[4]Volin MV,Huynh N,Klosowska K,et al.Fractalkine is a novel chemoattractant for rheumatoid arthritis fibroblastlike synoviocyte signaling through MAP kinases and Akt[J].Arthritis Rheum,2007,56(8):2512-2522.
[5]肖楚吟,潘云峰,郭兴华,等.滑膜成纤维细胞的原代培养及生物特性[J].中国医学工程,2010,18(2):1-4.
[6]韩 梅,温进坤,刘月平,等.大鼠血管新生内膜形成过程中NF-κB的活化和ICAM-1及COX-2表达的变化[J].中国病理生理杂志,2008,24(2):257 -260.
[7]Sioud M,Mellbye O,Forre O.Analysis of the NF-κB p65 subunit,Fas antigen,Gas ligand and Bcl-2 -related proteins in the synovium of RA and polyarticular JRA[J].Clin Exp Rheumatol,1998,16(2):125 - 134.
[8]Bondeson J,Lauder S,Wainwright S,et al.Adenoviral gene transfer of the endogenous inhibitor IκBα into humanosteoarthritis synovial fibroblasts demonstrates that several matrix metalloproteinases and aggrecanases are nuclear factor- κB - dependent[J].J Rheumatol,2007,34(3):523-533.
[9]Fraticelli P,Sironi M,Bianchi G,et al.Fractalkine(CX3CL1)as an amplification circuit of polarized Th1 responses[J].J Clin Invest,2001,107(9):1173 -1181.
[10]Umehara H,Bloom ET,Okazaki T,et al.Fractalkine and vascular injury[J].Trends Immunol,2001,22(11):602-607.
[11]Yoneda O,Imai T,Inoue H,et al.Membrane bound form of fractalkine induces IFN-γ production by NK cells:a role for Th1 response[J].Eur J Immunol,2003,33(1):53-58.
[12]Nanki T,Imai T, Nagasaka K, et al.Migration of CX3CR1-positive T cells producing type 1 cytokines and cytotoxic molecules into synovium of patients with rheumatoid arthritis[J].Arthritis Rheum,2002,46(11):2878-2883.
[13]Bazan JF,Bacon KB,Hardiman G,et al.A new class of membrane - bound chemokine with a CX3C motif[J].Nature,1997,385(6617):640 -644.
[14]Yano R,Yamamura M,Sunahori K,et al.Recruitment of CD16+monocytes into synovial tissues is mediated by fractalkine and CX3CR1 in rheumatoid arthritis patients[J].Acta Med Okayama,2007,61(2):89-98.
[15]Ruth J,Volin M,Haines K,et al.Fractalkine,a novel chemokine in rheumatoid arthritis and in rat adjuvant induced arthritis[J].Arth Rheum,2001,44(7):1568 -1581.
[16]Volin MV,Woods JM,Amin MA,et al.Fractalkine:A novel angiogenic chemokine in rheumatoid arthritis[J].Am J Pathol,2001,159(4):1521 - 1530.
[17]Murphy G,Caplice N,Molloy M.Fractalkine in rheumatoid arthritis:a review to date[J].Rheumatology,2008,47(10):1446-1451.
[18]Nah SS,Won HJ,Ha E,et al.Epidermal growth factor increases prostaglandin E2production via ERK1/2 MAPK and NF-κB pathway in fibroblast like synoviocytes from patients with rheumatoid arthritis[J].Rheumatol Int,2010,30(4):443-449.
[19]徐 波,邢 丞,李 敏,等.醛肽类蛋白酶体抑制剂对LPS诱导小鼠巨噬细胞炎症介质表达的影响[J].中国病理生理杂志,2009,25(5):988-992.
