慢性阻塞性肺疾病中转录因子ATF3/ATF4与Nrf2的表达及相互作用*
2011-08-02刘晓燕戴爱国谭双香
刘晓燕, 戴爱国, 谭双香
(1湖南省老年医院-老年医学研究所呼吸疾病研究室,湖南 长沙 410016;2南华大学研究生院,湖南 衡阳 421001)
转录因子ATF3/ATF4属于ATF/CREB转录因子家族,富含碱性亮氨酸拉链结构(basic leucine zippe,bZIP),广泛参与多种病理生理过程,如氧化应激、细胞凋亡和免疫调节等。红系衍生的核因子相关因子2(NF-E2-related factor 2,Nrf2)作为体内重要的转录激活因子,对氧化应激状况下多种抗氧化酶和Ⅱ相解毒酶的表达起着重要的调控作用,可有效缓解氧化损伤[1]。近来研究证实[2,3],ATF3 和ATF4可协同Nrf2调控抗氧化反应元件(anti-oxidant response element,ARE)依赖的Ⅱ相解毒酶和抗氧化酶基因的表达,如γ-谷氨酰半胱氨酸合成酶催化亚基(glutamyl-L-cysteine ligasecatalytic subuint,GCLC)、谷胱甘肽S转移酶(glutathione S-transferase,GST)、超氧化物歧化酶(superoxide dismutase,SOD)、血红素加氧酶1(heme oxygenase-1,HO-1)等。我室前期研究发现ATF3和ATF4在慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)大鼠肺组织中表达明显增强[4],但在 COPD患者中它们的研究较少。本实验拟通过观察ATF3、ATF4和Nrf2在COPD患者中表达情况的变化,初步探讨ATF3、ATF4与Nrf2之间的相互作用以及它们在COPD氧化/抗氧化失衡中的可能作用。
材料和方法
1 材料
芙蓉牌香烟(湖南中烟工业公司,尼古丁1 mg/支,焦油 14 mg/支);脂多糖(LPS)Sigma;ATF3、ATF4、Nrf2兔多克隆抗体均购自Santa Cruz;SP免疫组化试剂盒、ATF3、ATF4、Nrf2原位杂交试剂盒购自武汉博士德生物工程有限公司;RIPA总蛋白提取试剂盒、辣根过氧化物酶标记山羊抗兔IgG、protein A+G agarose及ECL化学发光剂均购自江苏碧云天生物技术研究所;BCA法蛋白质含量检测试剂盒购自南京凯基生物发展有限公司;蛋白电泳系统为Bio-Rad产品;小动物肺功能测定系统:HX200型呼吸流量换能器(北京新行兴业科贸有限公司)。
2 方法
2.1 动物模型复制及组织标本制备 成年雄性SD大鼠22只(湖南中医学院动物部提供,清洁级),平均体重(240±20)g,鼠龄10周,按随机数字表法分COPD组和对照组,每组11只。用每日熏香烟,其中第1 d、14 d气管内滴LPS(1g/L)200 μL建立COPD大鼠模型[5];对照组第1和14 d气管内注入生理盐水200 μL,其余不作任何干预,两组饲养条件相同。COPD模型组在第4 d死亡1只,原因不明。第28 d熏香烟后,两组大鼠均用1%戊巴比妥钠(50mg/kg)腹腔注射麻醉,操作步骤参照我室方法[5]用小动物肺功能测定仪测定大鼠0.3 s用力呼气容积(forced expiratory volume in first 0.3 s,FEV0.3)、0.3 s用力呼气容积占用力肺活量的比值(percentage of forced ecpiratory volume in first 0.3 s to forcedvital capacity,FEV0.3/FVC)、呼气峰流速(peak expiratory flow,PEF),2 h内将大鼠大动脉放血处死,取右肺置于液氮中保存用于免疫共沉淀(co-immunoprecipitation,Co-IP)分析。
2.2 临床组织标本留取 肺组织标本来自湖南省肿瘤医院胸外科2008年12月-2009年12月因早期肺癌行肺叶切除术者40例,所有患者术前均询问病史,进行体检、X线胸片或肺部CT和肺功能检测。COPD组20例:男15例,女5例,平均年龄(61±5)岁,临床诊断符合中华医学会呼吸病学分会2007年制定的《慢性阻塞性肺疾病诊治指南》标准[6]。第1秒用力呼气容积占预计值百分比(percentage of forced expiratory volume in one second to predicted value,FEV1%pred)为(69.60±4.45)%,第1秒用力呼气容积/用力肺活量(percentage of forced expiratory volume in first second to forced vital capacity,FEV1/FVC)为(66.46±3.00)%。肺标本右下肺12例,左下肺8例。对照组20例:男17例,女3例,平均年龄(59±6)岁,FEV1%预计值为(84.95±3.69)%,FEV1/FVC为(83.15±3.40)%。肺标本右下肺9例,左下肺11例。两组年龄、性别及取材部位比较差异无显著(均 P>0.05),FEV1%预计值、FEV1/FVC比较差异显著(均P<0.01)。受检者均排除合并患有心、肝、肾等其它疾病,并排除支气管扩张症、肺结核和其它可以影响肺功能的疾病。参照文献[7]取材,标本取材均远离癌组织5 cm以上,将肺组织于4%多聚甲醛(含1‰ DEPC)中固定,常规石蜡包埋、切片、保存,行免疫组化和原位杂交检测各指标的表达。
2.3 免疫组化检测 操作步骤按SP染色试剂盒说明书操作,Ⅰ抗用PBS稀释(稀释比例分别为ATF31∶50;ATF41∶50;Nrf21∶50),孵育Ⅰ抗均采取 4 ℃过夜。DAB显色,苏木精复染,阳性结果显棕黄色。用显微显影系统(Olympus)采集和分析图像:为了便于比较,随机选择内径为100-200 μm的细支气管和肺泡区各3个视野(×200)以JD系列病理图文形态分析系统(江苏省捷达科技发展有限公司)测量并计算阳性信号平均吸光度(A)值,取平均值作为每个样本阳性表达的相对强度。
2.4 原位杂交检测 地高辛标记的多相寡核苷酸探针序列:ATF3 mRNA:(1)5'-CAGAA CAAGC ACCTC TGCCA CCGGA TGTCC TCTGC - 3',(2)5'-TACAT GCTCA ACCTT CATCG GCCCA CGTGT ATTGT-3',(3)5'-TTTAT CCAAC AGATA AAAGA AGGAA CATTG CAGAG-3';ATF4 mRNA:(1)5'-GATTG GATGT TGGAG AAAAT GGATT TGAAG GAGTT-3',(2)5'-GATGA CACTT GTGAT CTCTT TGCCC CCCTA GTCCA -3',(3)5'- AGGTA CCGCC AGAAG AAGAG GGCGG AGCAG GAGGC-3';Nrf2 mRNA:(1)5'-AGCAG GACAT GGAGG AAGTT TGGCA GGAGG TATTT -3',(2)5'- GTAAA GCTTT CAACC AGAAG CACAC TGAAG GCACG - 3',(3)5'-ATGAC TTCAA TGAAA TGATG TCCAA GGAGC AATTC-3'。操作步骤按原位杂交试剂盒使用说明书进行,DAB显色,苏木素复染。检测方法同上。
2.5 免疫共沉淀检测 于液氮中取出大鼠肺组织按照RIPA总蛋白提取试剂盒说明书提取总蛋白,采用BCA法测定蛋白浓度。冰上裂解30 min,4℃12000×g离心5 min,收集上清,加入捕获抗体(Nrf21∶200),4 ℃轻摇孵育24 h,再加入20 μL protein A+G agarose,4℃缓慢摇动2 h沉淀抗体结合复合物。4℃、2500×g离心5 min弃上清,加入PBS重悬洗涤3次,再加入适量1×SDS-PAGE电泳上样缓冲液煮沸5 min,离心取上清,上样,12%SDSPAGE凝胶电泳分离蛋白后,转移至PVDF膜,5%脱脂奶粉室温封闭1 h,分别用ATF3抗体(1∶200)、ATF4抗体(1∶200)室温下摇床孵育2 h,Ⅱ抗(1∶10000稀释)室温孵育1 h,最后用ECL化学发光法胶片成像。
3 统计学处理
结 果
1 大鼠肺功能及肺组织的病理改变
COPD组 大 鼠 FEV0.3、FEV0.3/FVC和 PEF[(2.25 ±0.14)mL、(62.09 ±1.30)% 和(20.60±1.88)mL/s]较对照组[(4.05 ± 0.24)mL、(81.10±1.82)% 和(39.48±2.77)mL/s]显著降低(均P<0.01);光镜下观察肺组织病理改变:与对照组比较,COPD组大鼠支气管肺内出现炎症细胞浸润,上皮层、平滑肌层增厚;支气管黏膜增厚、脱落,基底细胞排列紊乱,腺体增生肥大;终末细支气管远端的气囊腔膨胀扩大,肺泡壁变薄,部分肺泡破裂融合成肺大泡,符合中华医学会2007年制定的标准[6]。
2 肺组织ATF3、ATF4和Nrf2 mRNA的表达
原位杂交结果(图1)显示:ATF3、ATF4和Nrf2 mRNA在2组患者肺组织中的表达部位基本一致,主要见于支气管上皮细胞、肺泡上皮细胞、平滑肌细胞血管内皮细胞以及炎症细胞中。ATF3、ATF4 mRNA在COPD组均显著高于对照组(均P<0.01),两组Nrf2 mRNA比较无明显差异(P>0.05),见表1。
3 肺组织中ATF3、ATF4和Nrf2蛋白的表达
免疫组化光镜下见ATF3、ATF4、Nrf2蛋白主要表达于支气管上皮细胞、肺泡上皮细胞、炎症细胞,小血管平滑肌中亦有少许表达,胞浆胞核均有免疫着色,以胞核表达为主,见图2。ATF3、ATF4、Nrf2蛋白在COPD组均呈阳性表达且显著高于对照组(均P <0.01),见表1。
4 Nrf2与ATF3、ATF4的相互作用
免疫共沉淀结果显示ATF3、ATF4与Nrf2可杂交出明显的蛋白条带,见图3,且COPD组显著高于对照组(P <0.05),提示 Nrf2与 ATF3、ATF4之间存在相互作用。

Figure 1.The expression of ATF3,ATF4 and Nrf2 mRNA in lung tissues of patients in each group(in situ hybridization,DAB,×200).A,C,E:control;B:ATF3 in COPD group;D:ATF4 in COPD group;F:Nrf2 in COPD group.图1 两组患者肺组织中ATF3、ATF4和Nrf2 mRNA的表达

Figure 2.The expression of ATF3,ATF4 and Nrf2 proteins in lung tissues of patients in each group(immunohistochemistry,DAB,×200).A,C,E:control;B:ATF3 in COPD group;D:ATF4 in COPD group;F:Nrf2 in COPD group.图2 两组患者肺组织中ATF3、ATF4和Nrf2蛋白的表达
表1 两组COPD患者肺组织ATF3、ATF4、Nrf2 mRNA及蛋白的表达Table 1.The mRNA and protein expression of ATF3,ATF4 and Nrf2 in control patient and COPD patient lung specimens(.n=20)
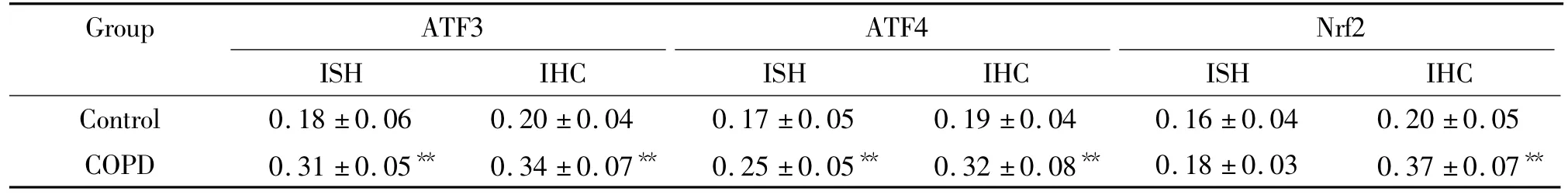
表1 两组COPD患者肺组织ATF3、ATF4、Nrf2 mRNA及蛋白的表达Table 1.The mRNA and protein expression of ATF3,ATF4 and Nrf2 in control patient and COPD patient lung specimens(.n=20)
**P <0.01 vs control group.ISH:in situ hybridization;IHC:immunohistochemistry.
Group ATF3 ATF4 Nrf2 ISH IHC ISH IHC ISH IHC Control 0.18 ±0.06 0.20 ±0.04 0.17 ±0.05 0.19 ±0.04 0.16 ±0.04 0.20 ±0.05 COPD 0.31 ±0.05** 0.34 ±0.07** 0.25 ±0.05** 0.32 ±0.08** 0.18 ±0.03 0.37 ±0.07**

Figure 3.Interactions of ATF3/ATF4 protein and Nrf2 protein in the rat lungs determined by co-immunoprecipitation..n=11.*P<0.05 vs control group.图3 免疫共沉淀检测大鼠肺组织中Nrf2与ATF3、ATF4的相互作用
讨 论
氧化失衡是COPD重要发病机制之一。机体在各种氧化应激状况下,体内活性氧簇(reactive oxygen species,ROS)增加,超出了抗氧化物质的清除能力,导致氧化/抗氧化失衡,从而造成肺部损伤,气流受限进行性加重。近年发现,Nrf2是氧化应激反应中的重要转录激活因子,并在COPD的发生发展中起着重要作用[8]。在静息状态下,Nrf2主要与 Keap1结合以失活的形式定位于胞浆;氧化应激时Keap1失活而Nrf2通过各种信号通路激活移位入核,与其它bZIP因子如Jun、ATF4、小Maf蛋白等形成异二聚体结合于其下游的靶基因如γ-GCS、HO-1、NAD(P)H:醌氧化还原酶1[NAD(P)H:quinone oxidoreductase 1,NQO1]等基因调控序列的ARE上发挥转录调控作用[1,9]。本实验发现虽然Nrf2蛋白在COPD组表达明显上调,以核内表达为主;但Nrf2 mRNA在2组表达无显著差异。考虑氧化应激状态下,Nrf2与负调控子Keap1解离,Nrf2降解减少,蛋白稳定性增加,激活的Nrf2移位入核影响其蛋白表达水平,进而在核内发挥上调抗氧化基因表达的作用[5,10,11]。但目前对于 Nrf2 的转录调控机制涉野较少,进一步研究有助于为COPD的抗氧化失衡机制提供有力的理论依据及实践意义。
近来研究发现,氧化应激状况下,转录因子ATF3基因缺失可导致体内重要抗氧化物质谷胱甘肽(glutathione,GSH)合成减少,同时可降低Nrf2下调ROS的水平,增加DNA损伤;但ATF3基因缺失并不影响Nrf2对其下游靶基因如HO-1、硫氧还蛋白1(sulfiredoxin 1,SRXN1)、NQO1 等的转录调控[11]。由此表明高表达的ATF3需与Nrf2相互作用,增强Nrf2对靶基因转录调控的活性,从而降低机体氧化损伤。本研究结果显示ATF3蛋白及 mRNA在COPD组均较对照组显著增高,胞核表达为主,且其表达部位与Nrf2蛋白及mRNA表达部位基本一致,提示在COPD氧化应激状况下,ATF3表达反应性明显上调,且其基因表达与Nrf2转录密切相关。Kim等[12]在研究中证实 ATF3启动子区域具有 ARE,Nrf2通过与之结合,从而调节ATF3基因表达。同时本研究中,免疫共沉淀显示以Nrf2抗体捕获的免疫沉淀中,ATF3抗体可杂交出明显的蛋白条带,并且这种结合在COPD组明显增强,从而证实Nrf2与ATF3蛋白之间存在直接相互作用。据以往报道,ATF3常常通过其bZIP区域与Nrf2形成异二聚体调控抗氧化基因表达,如 GCLC、GST等[2]。因此综合以上研究成果,我们推测氧化应激时ATF3表达上调,通过与核转位的Nrf2形成异二聚体,增强Nrf2的结合活性,可能转录调控Nrf2下游抗氧化酶基因的表达,在COPD氧化/抗氧化失衡中发挥作用,但其中的具体机制还有待于进一步研究。
氧化应激目前是人类多种疾病重要的发病机制之一,胞内氧化应激的精确调节主要是通过应激反应转录因子家族。既往研究表明,在氧化应激下,ROS产生增多可活化PERK/eIF2α/ATF4通路,促进GSH的合成,对细胞发挥保护性作用[13]。本实验结果显示ATF4蛋白及mRNA在COPD组均较对照组显著增高,以胞核表达为主,证实在氧化应激状况下,ATF4表达上调参与维持体内氧化/抗氧化平衡。然而应激状况下ATF4表达上调的调控机制究竟如何呢?Afonyushkin等[14]发现,这其中包括两个平行机制:(1)依赖于Nrf2与ATF4基因启动子区域ARE相结合的方式上调ATF4 mRNA水平;(2)与此相伴随的是通过PERK途径,eIF2α磷酸化,增强ATF4蛋白的合成。在本组实验中,我们也发现,ATF4表达部位与Nrf2蛋白及mRNA表达部位基本一致,佐证了Nrf2对ATF4表达的转录调控作用。值得注意的是,ATF4和Nrf2之间是否还存在其它关联?以往研究显示[3],ATF4能增强Nrf2的转录调控活性,形成ATF4·Nrf2异二聚体结合于抗氧化酶HO-1应激反应元件(stress response element,StRE)上,调控HO-1的表达。本研究利用Co-IP技术,显示在ATF4与Nrf2蛋白之间存在直接相互作用关系,且COPD组明显增强。由此我们推测,应激状况下ATF4可协同Nrf2对其下游靶基因发挥转录调控作用,调节细胞的氧化还原能力,从而对抗氧化损伤。
总之,我们的研究表明,在COPD的发病过程中,转录因子ATF3、ATF4与Nrf2形成异二聚体,可能参与对下游抗氧化酶基因表达的调控,在COPD的氧化失衡机制中发挥重要的生物学作用,进一步的深入研究可能会为COPD的防治提供新的途径。
[1]Goven D,Boutten A,Leçon - Malas V,et al.Altered Nrf2/Keapl-Bach1 equilibrium in pulongary emphysema[J].Thorax,2008,63(10):916 -924.
[2]Bakin AV,Stourman NV,Sekhar KR,et al.Smad3-ATF3 signaling mediates TGF-β suppression of genes encoding phase II detoxifying proteins[J].Free Radic Biol Med,2005,38(3):375 -387.
[3]He CH,Gong P,Hu B,et al.Identification of activating transcription factor 4(ATF4)as an Nrf2-interacting protein.Implication for heme oxygenase-1 gene regulation[J].J Biol Chem,2001,276(24):20858-20865.
[4]刘晓燕,戴爱国,李 洁.转录因子ATF3和ATF4在大鼠慢性阻塞性肺疾病中的表达及作用[J].中国呼吸与危重监护杂志,2011,10(2):121 -125.
[5]王梅芳,戴爱国,胡瑞成,等.转录因子Nrf2/Bachl及MAPK激酶调控γ-GCS在大鼠慢性阻塞性肺疾病中的作用[J].中国病理生理杂志,2009,25(5):959-964.
[6]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007年修订版)[J].中华结核和呼吸杂志,2007,30(1):8 -17.
[7]林书典,戴爱国,徐 平.慢性阻塞性肺疾病患者γ谷氨酰半胱氨酸合成酶活性及表达的变化[J].中华结核和呼吸杂志,2005,28(2):97 -101.
[8]Adair KT,Atkinson JJ,Griffin GL,et al.Distal airways in mice exposed to cigarette smoke:Nrf2-regulated genes are increased in Clara cells[J].Am J Respir Cell Mol Biol,2008,39(4):400 -411.
[9]Kensler TW,Wakabayashi N,Biswal S.Cell survival responses to environmental stresses via the Keap1-2-ARE pathway[J].Annu Rev Pharmacol Toxicol,2007,47:89–116.
[10]McMahon M,Itoh K,Yamamoto M,et al.Keapl-dependent proteasomal degradation of transcription factor Nrf2 contributes to the negative regulation of antioxidant response element- driven gene expression[J].J Biol Chem,2003,278(24):21592 -21600.
[11]Hsieh TC,Lu X,Wang Z,et al.Induction of quinone reductase NQO1 by resveratrol in human K562 cells involves the antioxidant response element ARE and is accompanied by nuclear translocation of transcription factor Nrf2[J].Med Chem,2006,2(3):275 -285.
[12]Kim KH,Jeong YJ,Surh YJ,et al.Expression of stress- response ATF3 is mediated by Nrf2 in astrocytes[J].Nucleic Acids Res,2010,38(1):48 -59.
[13]Malhotra JD,Kaufman RJ.Endoplasmic reticulum stress and oxidative stress:a vicious cycle or a double-edged sword?[J].Antioxid Redox Signal,2007 ,9(12):2277-2293.
[14]Afonyushkin T,Oskolkova OV,Philippova M,et al.Oxidized phospholipids regulate expression of ATF4 and VEGF in endothelial cells via NRF2-dependent mechanism:novel point of convergence between electrophilic and unfolded protein stress pathways[J].Arterioscler Thromb Vasc Biol,2010 ,30(5):1007 - 1013.
