芍药苷减轻小鼠LPS性急性肺损伤的作用机制研究*
2011-08-02李红梅王发强王一阳吕秀秀戚仁斌陆大祥王华东
张 斌, 李红梅, 王 媛, 王发强, 王一阳, 吕秀秀, 戚仁斌, 陆大祥, 王华东
(1中山大学附属第五医院胸心外科,广东 珠海 519000;2暨南大学医学院病理生理学系,国家中医药管理局病理生理学重点实验室,广东 广州 510632)
急性肺损伤(acute lung injury,ALI)是以中性粒细胞浸润的炎症反应、微血管和肺泡上皮弥漫性损伤、肺水肿及肺间质纤维化等为病理特征的一种临床综合征,严重者即为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),可由创伤、肺炎和脓毒症等引起[1,2]。文献报道,高达40%的脓毒症患者伴发ALI/ARDS[3];脓毒症的重要致病因子,革兰氏阴性细菌细胞壁的脂多糖(lipopolysaccharide,LPS),可通过多种途径导致 ALI[4,5];ALI/ARDS 是脓毒症患者死亡的重要原因[6]。因此,寻找有效策略防治脓毒症相关性ALI/ARDS和LPS诱导ALI对脓毒症的治疗具有重要临床意义,一直是人们高度关注的研究领域[7]。
我们前期研究发现,芍药苷(paeoniflorin,Pae)能显著降低内毒素血症小鼠的死亡率,抑制LPS诱导的肿瘤坏死因子(tumor necrosis factor α,TNF-α)、白细胞介素 -1β(interleukin-1β,IL-1β)的产生,促进抗炎因子IL-10的表达,减轻腹腔注射LPS 诱导 ALI[8]。随后,Zhou 等[9]的研究也进一步证实Pae能减轻气道滴注LPS引起的ALI。然而,Pae减轻LPS诱导ALI的机制尚缺乏充分研究。研究表明,炎症细胞因子、中性粒细胞与胞浆型磷脂酶A2(cytosolic phospholipase A2,cPLA2)在腹腔或静脉注射LPS诱导的 ALI的发病机制中发挥重要作用[2,10-13],因此,本研究旨在观察 Pae 对 LPS 攻击小鼠肺中性粒细胞聚集及cPLA2活化的影响,以进一步阐明Pae减轻内毒素性肺损伤的作用机制。
材料和方法
1 动物
清洁级雄性 BALB/c小鼠,6-8周龄,体重21-23 g,购自广东省实验动物中心,合格证号为SCXK(粤)2008-0002。小鼠分笼饲养,自由饮水进食,实验前置实验环境中适应3-4 d,实验环境温度控制在(24±2)℃,相对湿度为60%-80%。小鼠处理符合暨南大学实验动物管理的相关规定。
2 主要试剂与仪器
2.1 主要试剂 LPS(大肠杆菌O55∶B5)购自Sigma,芍药苷(Pae)购自广东省药品检验所。小鼠抗小鼠髓过氧化物酶 (myeloperoxidase,MPO)单克隆抗体购自 R&D;兔抗小鼠甘油醛 -3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自 Cell Signaling Technology;兔抗小鼠cPLA2、磷酸化的胞浆型磷脂酶A2(phospho-cPLA2,Ser505)抗体购自Cell Signaling Technology;辣根过氧化物酶标记的山羊抗兔Ⅱ抗和山羊抗小鼠Ⅱ抗购自北京鼎国昌盛生物科技有限责任公司。BCA-100蛋白定量试剂盒购自上海申能博彩生物公司。
2.2 主要仪器 Western blotting装置(Bio-Rad);BX40型光学显微镜(Olympus)。
3 方法
3.1 实验分组及模型建立 将雄性BALB/c小鼠随机分为4组:对照组(control)、(LPS)组、Pae+LPS组(Pae+LPS)、Pae组(Pae)。分别以双蒸水(0.1 mL/10 g)、Pae(20 mg/kg,0.1 mL/10g)灌胃,1 次/d,连续3 d,第3 d灌胃后1 h,腹腔注射生理盐水[normal saline(NS),0.2 mL/10 g]或 LPS(20 mg/kg,0.2 mL/10 g)。
3.2 肺组织病理学检查 腹腔注射NS或LPS后12 h处死小鼠,开胸取左肺,固定于4%甲醛溶液中,随后进行石蜡切片及常规HE染色,光学显微镜下观察肺组织病理学改变。由同一个实验者在光镜下观察以下组织学特征,根据Su等[14]提出的评估肺病理损伤方法,将肺中性粒细胞浸润和肺出血分为4级,0:正常;1:25%的视野有损伤;2:50%的视野有损伤;3:75%的视野有损伤;4:弥漫性肺损伤。肺中性粒细胞浸润(neutrophil infiltration)和肺出血(hemorrhage)评分最终结果以平均秩(mean rank)表示。
3.3 蛋白免疫印迹法检测肺组织 MPO、cPLA2及phospho-cPLA2的含量 腹腔注射NS或LPS后12 h处死小鼠,开胸取右肺,冰生理盐水(4℃)冲洗,滤纸吸干,加入0.5 mL的RIPA裂解液(含终浓度为1 mmoL/L的PMSF),充分匀浆,冰面静置30 min,13200 r/min离心30 min(4℃)。BCA-100蛋白定量试剂盒检测肺组织匀浆液中总蛋白含量。按每个泳道孔加入70 μg蛋白样品进行10%丙烯酰胺 SDS-PAGE凝胶电泳。Bio-Rad半干转印仪15 V恒压转印 18 min至硝酸纤维素膜上。TBST配制的5%脱脂奶粉室温封闭2 h,TBST洗膜。分别加入1∶1000稀释的小鼠抗小鼠MPO、兔抗小鼠cPLA2和phospho-cPLA2Ⅰ抗液,以GAPDH为内参照,4℃过夜孵育。加1∶4000稀释的辣根过氧化物酶标记山羊抗小鼠/兔Ⅱ抗孵育液,室温孵育1 h。化学发光法检测抗原抗体复合物含量,BI2000软件分析蛋白条带的积分吸光度值,以MPO/GAPDH和phosphocPLA2/cPLA2积分吸光度比值分析结果。
4 统计学处理
用SPSS 13.0统计软件分析。计量资料采用均数±标准误(E)表示,多组间比较用单因素方差分析ANOVA(SNK法)。等级资料用平均秩表示,两独立样本比较采用Wilcoxon秩和检验。
结 果
1 肺组织病理学改变
光学显微镜下可见,LPS注射12 h,肺泡间隔明显增厚,大量炎症细胞浸润,明显肺出血及肺水肿;Pae+LPS组肺组织炎症细胞浸润,出血明显轻于LPS组;空白对照组及Pae组肺组织结构完整,无出血、水肿,见图1。

Figure 1.Representative photomicrograph of lung from mice 12 h after LPS or normal saline injection in control(A),LPS(B),Pae+LPS(C),Pae(D)groups.The lung histological sections were stained with hematoxylin-eosin.Pae:paeoniflorin.Scale bars represent 50 μm.图1 腹腔注射LPS或生理盐水后12 h各组小鼠肺组织形态学改变
2 肺组织形态学评分
如图2所示,LPS注射12 h后,LPS组中性粒细胞浸润和出血显著增多;Pae+LPS组肺组织中性粒细胞浸润(4.75 vs 10.60)和出血(4.63 vs 10.80)评分的平均秩显著低于LPS组(P<0.01)。
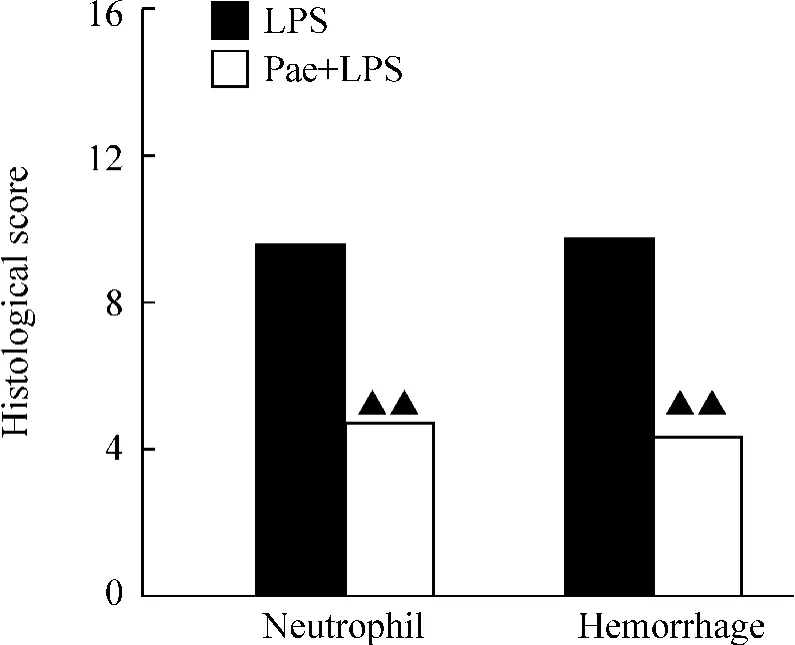
Figure 2.Histological scores(neutrophil infiltration and hemorrhage)of lung from mice 12 h after LPS or normal saline administration in LPS and Pae+ LPS groups.Pae:paeoniflorin.Values are presented as mean rank.n=8.▲▲P< 0.01 vs LPS group.图2 腹腔注射LPS或生理盐水后12 h小鼠肺组织形态学评分
3 Pae对LPS处理小鼠肺组织MPO含量的影响
如图3所示,小鼠腹腔注射LPS 12 h后,与对照组相比,LPS组肺组织 MPO含量明显增加(P<0.05);事先给予Pae灌胃能显著抑制LPS引起的小鼠肺组织MPO含量的增加(P<0.05)。Pae组与正常对照组相比,肺组织MPO水平未见显著差异。

Figure 3.Effect of Pae on MPO content in lung tissues 12 h after LPS administration.E.n=6.*P<0.05 vs control group;▲P< 0.05 vs LPS group.图3 Pae对LPS处理小鼠肺组织MPO含量的影响
4 Pae对LPS处理小鼠肺组织cPLA2磷酸化水平的影响
如图4所示,腹腔注射LPS 12h后,肺组织中磷酸化cPLA2水平明显高于正常对照组(P<0.05),事先给予Pae能显著抑制LPS引起的cPLA2的磷酸化(P<0.05)。Pae组与正常对照组相比,肺组织磷酸化cPLA水平未见明显差异。
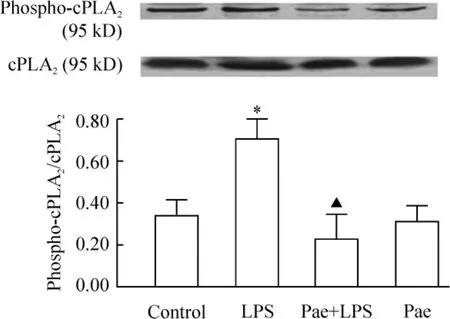
Figure 4.Effect of Pae on phospho-cPLA2protein expression in lung tissues.E.n=6.*P<0.05 vs control group;▲P< 0.05 vs LPS group.图4 Pae对LPS处理小鼠肺组织磷酸化cPLA2含量的影响
讨 论
本研究中,我们首先观察小鼠腹腔注射 LPS 12 h后肺组织形态学改变。光学显微镜下可见,LPS组肺组织损伤明显,肺泡间隔明显增厚,大量炎症细胞浸润,肺出血及肺水肿明显;预先给予芍药苷灌胃,可明显减轻LPS诱导的肺组织损伤,减少肺组织炎症细胞浸润、肺出血及肺水肿等。这些结果表明,Pae可显著减轻腹腔注射内毒素引起的ALI,进一步证实了我们先前报道的结果[8]。
Uchiba等[10]发现,静脉注射LPS 30 min后大鼠肺组织中即出现大量中性粒细胞聚集,随后肺血管通透性明显增加;用氨甲喋呤减少大鼠血中白细胞后,LPS诱导的肺血管损伤则明显减轻。Abraham等[11]进一步研究发现,用环磷酰胺或中性粒细胞抗体减少中性粒细胞后,腹腔注射LPS诱导的小鼠肺水肿则明显减轻,LPS诱导的肺组织转录因子核因子-kappa B活化被明显抑制,IL-1β等炎症细胞因子的表达明显减少。这些结果说明,中性粒细胞在腹腔或静脉注射LPS诱导的肺部炎症反应和急性肺损伤的启动环节中发挥重要作用。本研究发现,Pae预处理能明显减少LPS攻击小鼠肺组织中性粒细胞浸润,表明抑制中性粒细胞向肺组织浸润可能是Pae防止内毒素性ALI的机制之一。
为了进一步验证Pae防止内毒素性ALI的上述机制,我们采用Western blotting检测肺组织中MPO的含量,结果发现腹腔注射LPS明显增加了小鼠肺组织MPO水平,Pae预处理可显著降低LPS处理小鼠肺组织中MPO含量。MPO是一种高表达于中性粒细胞的蛋白酶,是中性粒细胞浸润的主要标记物[15]。上述结果进一步证实抑制中性粒细胞向肺组织浸润是Pae防止内毒素性ALI的重要机制。新近有研究表明,MPO缺乏可减轻 LPS诱导的肺损伤[15],我们研究发现,Pae能减少LPS处理小鼠肺组织中MPO的含量,提示减少肺组织中MPO的水平也可能参与了Pae防止内毒素性ALI的机制。然而,Pae通过何种机制减少LPS诱导的中性粒细胞向肺组织浸润,尚需进一步研究。Calkins等[16]研究发现,TNF受体p55基因敲除小鼠受到腹腔注射LPS攻击后,肺组织趋化因子的产生和中心粒细胞浸润程度明显低于野生型小鼠,说明TNF介导了腹腔注射LPS诱导的肺组织中性粒细胞浸润。我们先前的研究发现Pae可抑制 LPS诱导 TNF的产生[8]。因此,Pae可能通过抑制TNF的表达减少LPS诱导的中性粒细胞向肺组织浸润。
另一方面,Nagase 等[13]研究证实,cPLA2是内毒素血症诱导ALI的关键介质,抑制cPLA2的活化能显著抑制LPS诱导的ALI。cPLA2催化中心连接区域的Ser505位点被磷酸化后激活,形成具有酶催化活性的cPLA2(phospho-cPLA2),phospho-cPLA2通过催化细胞膜磷脂产生花生四烯酸 (araehidonieaeid,AA)和血小板活化因子,参与LPS诱导的ALI[13,17,18]。为了进一步阐明 Pae 减轻 LPS 性 ALI的作用机制,我们采用蛋白免疫印迹法检测肺组织中phospho-cPLA2(Ser505)的表达。结果表明,内毒素血症小鼠肺组织中磷酸化cPLA2水平显著增高,芍药苷可显著降低内毒素血症小鼠肺组织cPLA2的磷酸化。这些结果提示,Pae预防内毒素性肺损伤的机制与其抑制cPLA2的磷酸化有关。
综上所述,Pae能明显减轻腹腔注射LPS诱导的ALI,其作用机制与减少肺组织中性粒细胞浸润、MPO含量及抑制cPLA2活化有关。本研究发现Pae能抑制LPS攻击小鼠肺组织中cPLA2的活化,从一个新的角度阐明了Pae防治LPS性急性肺损伤的作用机制,为Pae用于脓毒症性肺损伤的治疗提供有力的实验依据。
[1]Matthay MA,Zimmerman GA,Esmon C,et al.Future research directions in acute lung injury:summary of a National Heart,Lung,and Blood Institute Working Group[J].Am J Respir Crit Care Med,2003,167(7):1027-1035.
[2]Tsushima K,King LS,Aggarwal NR,et al.Acute lung injury review [J].Intern Med,2009,48(9):621-630.
[3]Hudson LD,Milberg JA,Anardi D,et al.Clinical risks for development of the acute respiratory distress syndrome[J].Am J Respir Crit Care Med,1995,151(2 Pt 1):293-301.
[4]Chen H,Bai C,Wang X.The value of the lipopolysaccharide-induced acute lung injury model in respiratory medicine[J].Expert Rev Respir Med,2010,4(6):773-783.
[5]Togbe D,Schnyder-Candrian S,Schnyder B,et al.Toll-like receptor and tumour necrosis factor dependent endotoxin-induced acute lung injury [J].Int J Exp Pathol,2007,88(6):387-391.
[6]Sheu CC,Gong MN,Zhai R,et al.Clinical characteristics and outcomes of sepsis-related vs non-sepsis-related ARDS [J].Chest,2010,138(3):559-567.
[7]Varisco BM.The pharmacology of acute lung injury in sepsis[J].Adv Pharmacol Sci(Epub 2011 Jun 28).
[8]Cao WJ,Zhang W,Liu JJ,et al.Paeoniflorin improves survival in LPS-challenged mice through the suppression of TNF-α and IL-1β release and augmentation of IL-10 production[J].Int Immunopharmacol,2011,11(2):172-178.
[9]Zhou H,Bian D,Jiao X,et al.Paeoniflorin protects against lipopolysaccharide-induced acute lung injury in mice by alleviating inflammatory cell infiltration and microvascular permeability [J].Inflamm Res,2011,60(10):981-990.
[10]Uchiba M,Okajima K,Murakami K,et al.Endotoxininduced pulmonary vascular injury is mainly mediated by activated neutrophils in rats[J].Thromb Res,1995,78(2):117-125.
[11]Abraham E,Carmody A,Shenkar R,et al.Neutrophilsas early immunologic effectors in hemorrhage-or endotoxemia-induced acute lung injury[J].Am J Physiol Lung Cell Mol Physiol,2000,279(6):L1137-L1145.
[12]Arndt PG,Strahan B,Wang Y,et al.Leukocyte ADAM17 regulates acute pulmonary inflammation[J].PLoS One,2011,6(5):e19938.
[13]Nagase T,Uozumi N,Ishii S,et al.Acute lung injury by sepsis and acid aspiration:a key role for cytosolic phospholipase A2[J].Nat Immunol,2000,1(1):42-46.
[14]Su X,Bai CX,Hong QY,et al.Effect of continuous hemofiltration on hemodynamics,lung inflammation and pulmonary edema in a canine model of acute lung injury[J].Intensive Care Med,2003,29(11):2034-2042.
[15]Haegens A,Heeringa P,van Suylen RJ,et al.Myeloperoxidase deficiency attenuates lipopolysaccharide-induced acute lung inflammation and subsequent cytokine and chemokine production [J].J Immunol,2009,182(12):7990-7996.
[16]Calkins CM,Heimbach JK,Bensard DD,et al.TNF receptor I mediates chemokine production and neutrophil accumulation in the lung following systemic lipopolysaccharide[J].J Surg Res,2001,101(2):232-237.
[17]Nagase T,Uozumi N,Aoki-Nagase T,et al.A potent inhibitor of cytosolic phospholipase A2,arachidonyl trifluoromethyl ketone,attenuates LPS-induced lung injury in mice [J].Am J Physiol Lung Cell Mol Physiol,2003,284(5):L720-L726.
[18]Zhang HQ,Wang HD,Lu DX,et al.Berberine inhibits cytosolic phospholipase A2and protects against LPS-induced lung injury and lethality independent of the α2-adrenergic receptor in mice[J].Shock,2008,29(5):617-622.
