盐碱地不同菊芋品系菊糖含量的比较
2011-07-26李国琴唐文文晋小军
李国琴,唐文文,晋小军
(甘肃农业大学,兰州 730070)
菊芋(Helianthus tuberosus L.)俗称洋姜、鬼子姜,为菊科(Compositae)向日葵属多年生草本植物。自然界含有菊糖(又称菊粉,系多聚果糖)的36000种植物中,以菊芋和菊苣块茎的菊糖含量最高[1]。除此之外,菊芋还含有一定数量的蛋白质、果胶、有机酸、纤维素及其他成分,菊糖已成为国内外高度重视的功能性食品添加剂[2-3],菊芋中菊粉能增殖肠道内的双歧杆菌,预防肠道感染;控制血脂,减少心血管疾病的危害;降低血氨的浓度;促进矿物质的吸收;防治便秘,适宜于糖尿病人。菊糖(Inulin)是由D-呋喃果糖经β-(2-1)-糖苷键聚合而成的果聚糖,呈直链结构,末端再以α-(l-2)糖苷键连接一分子葡萄糖基,多糖分子约含30~50个果糖残基,聚合度通常为2~60,平均聚合度为10,水解后生成果糖和少量葡萄糖。
本实验用紫外-可见分光光度法测定了不同品系的菊芋中菊糖的含量。其中,以蒽酮-硫酸法显色测定总多糖,以DNS法显色测定还原糖[4-5]。
1 材料与方法
1.1 材料
菊芋:品系 R3,R4,B1,B5,B8,采自兰州秦王川盐碱地。 将菊芋清洗,切开置沸水浴烫 5 min(灭 PPO 酶)后,切丝,在80℃烘干至恒重,用植物粉碎机粉碎,过60目筛,备用。
1.2 仪器设备与试剂
1.2.1 仪器设备 UV-2100双光束紫外-可见分光光度计(日本,岛津);LDZ4-0.8低速自动平衡微型离心机(北京医用离心机厂);恒温水浴箱(上海申光仪器仪表有限公司);SHZ-D(Ⅲ)循环式真空泵;RE-52AA旋转蒸发器(上海亚荣生化仪器厂);高速植物粉碎机6202(北京环亚天元机械技术有限公司),23000 r/min;万分之一电子天平(BD224S型,北京赛多利斯仪器系统有限公司)。
1.2.2 试剂 3,5-二硝基水杨酸(简称DNS试剂),熟石灰,蒽酮,酒石酸钾钠,氯仿,正丁醇,无水乙醇,磷酸,亚硫酸钠,浓硫酸等,试剂均为分析纯。自制的二次蒸馏水。
蒽酮试剂:称取0.20 g蒽酮溶于100.0 mL浓硫酸。DNS试剂:将3.15 g DNS和131.0 mL 2 mol/L的NaOH加入到250 mL含92.5 g酒石酸钾钠的热水溶液中,再加2.5 g酚和2.5 g亚硫酸钠,冷却后加蒸馏水定容至 500.0 mL。Sevag试剂:氯仿∶正丁醇=5∶1(体积比)。
1.3 实验方法
1.3.1 菊芋多糖的提取 称取5种菊芋样品各3份,每份30.00 g置于500 mL的烧瓶中,各加400 mL蒸馏水,于恒温水浴箱80℃浸提90min,过滤,收集滤液。滤渣重复提取2次,每次加水350 mL,过滤,合并3次滤液,减压浓缩至适当体积即粗多糖溶液。
1.3.2 菊芋多糖的纯化 在上述多糖溶液中加石灰乳调pH≈11.0,置80℃水浴中保温1h[6],减压过滤,弃去沉淀。滤液用磷酸调pH至8.0,于4000 r/min离心10 min,弃去沉淀。在上清液中加入Sevag试剂脱蛋白3次[7],收集的菊芋多糖溶液,加入适量活性炭脱色后,得到较纯的多糖溶液。
将多糖溶液用3倍体积95%乙醇沉淀出多糖[8],离心分离,回收乙醇。收集的菊芋多糖,用蒸馏水定容至50.0 mL,备用。
1.3.3 菊芋中菊糖的测定 ⑴总多糖含量的测定:取1.0 mg/mL的葡萄糖标准溶液1.00、2.00、3.00、4.00、5.00、6.00、7.00 mL于7个50 mL容量瓶,用蒸馏水定容,迅速置于冰浴中。再分别取葡萄糖系列溶液2.00 mL于7个试管中,再取2.00 mL蒸馏水于另一试管(参比溶液),各管中分别加入4.00 mL蒽酮试剂后,同时放到沸水浴中,加热7 min,立即取出置于冰浴中,迅速冷却,然后从冰浴中取出各试管放置至室温,用UV-2100双光束紫外可见分光光度计扫描葡萄糖溶液显色后的吸收光谱,在最大吸收波长处测定系列标准溶液的吸光度[9]。
分别吸取“1.3.2”中各菊芋多糖溶液1.00 mL于100 mL容量瓶中,用蒸馏水定容至100.0 mL,再分别吸取1.00mL定容至10.0mL。依次吸取各溶液1.00mL放入20个10mL容量瓶,再分别加入4.00 mL蒽酮试剂后用蒸馏水定容至10.0 mL,反应条件同上述葡萄糖溶液的显色。在最大吸收波长下测其吸光度。
c-菊芋总糖的测定浓度,单位:mg/mL;m样-菊芋的质量,单位:g。
⑵还原糖含量的测定:取 10.0mg/mL 的葡萄糖溶液 2.00、4.00、6.00、8.00、10.00、12.00、14.00 mL 分别于7个50mL容量瓶中并定容。再分别取不同浓度的葡萄糖溶液各5.00 mL于7个10 mL容量瓶中,另取5.00 mL蒸馏水于另一10 mL容量瓶中(参比溶液),分别加入DNS试剂2.00 mL,混匀后,同时放入沸水浴中加热5 min,取出置冰浴中迅速冷却,定容至10.0 mL。用UV-2100双光束紫外可见分光光度计扫描葡萄糖标准溶液显色后的吸收光谱[10],在最大吸收波长处测定系列标准溶液的吸光度。
分别取“1.3.2”中各菊芋多糖溶液5.00 mL,用二次蒸馏水定容至50.0 mL,混匀,再各取1.00mL于10 mL容量瓶中,并分别加入DNS试剂2.00mL,混匀后同时放入沸水浴中加热5 min,取出后置冰浴中迅速冷却并定容至10.0 mL,在最大吸收波长处测其吸光度。
c-菊芋中还原糖的测定浓度,单位:mg/mL;m样-菊芋的质量,单位:g。
⑶菊糖含量:菊芋中菊糖的含量计算关系式为:W菊糖(%)=W总糖(%)-W还原糖(%)
2 结果与分析
2.1 葡萄糖标准溶液显色后的标准曲线
2.1.1 蒽酮-硫酸法 由葡萄糖溶液显色后的吸收光谱知,λmax=500 nm。于500 nm处测得系列标准溶液的吸光度得标准曲线见图1,回归方程为:y=62.981x-0.0514,相关系数r=0.9835。
2.1.2 DNS法 由葡萄糖溶液显色后的吸收光谱知,λmax=490 nm。于490 nm处测得系列标准溶液的吸光度得标准曲线见图2,回归方程为:y=1.7543x+0.0563,相关系数r=0.9906。

图1 测定总糖含量的葡萄糖溶液的标准曲线

图2 测定还原糖的葡萄糖溶液标准曲线
2.2 不同品系菊芋中多糖、还原糖和菊糖的含量
不同品系菊芋中总多糖的含量R4的最高(见表1),达18.11%,与其他品系存在极显著差异;R3次之,为13.10%;品系B1、B5、B8皆较低,其中B1最低,仅为9.99%,比品系R4低了近8个百分点。菊芋中还原性多糖的含量较低,只有R3含量比较高,为3.11%,与其他品系比较差异极显著。
菊芋中含有丰富的菊糖,各品系菊糖的含量为R4>B5>R3>B8>B1,其中,品系R4中菊糖的含量最高,达16.78%,与其他品系之间差异极显著,B1与品系B5、R3、B8差异显著,R4的产量在5个品系里排第二位[11],B1的产量虽然高,但其中的菊糖含量最低,仅为8.37%。
3 小结
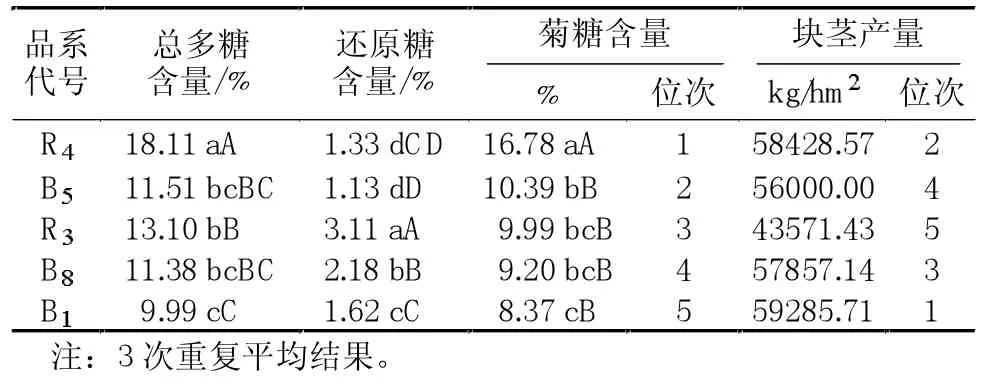
表1 不同菊芋品系产量及糖含量
实验结果表明:测定的5个不同菊芋品系中菊糖的含量为8.37%~16.78%,品系间差异极显著,各品系菊糖的含量为 R4>B5>R3>B8>B1。
菊糖作为一种新兴的食品配料,具有安全无毒并能显著改善食品风味品质及促进人体健康的优势,具有一定的使用价值和开发前景。
[1]Vandamme E I,Deryck D G.Microbial inulinase,Fermentation process,properties,and applications[J].Appl.Microbiol,1983,29:139-176.
[2]饶志娟,郑建仙,贾呈祥.功能性食品基料-菊粉的研究进展[J].中国甜菜糖业,2002(4):26-30.
[3]屠用利.菊糖的功能与应用[J].食品工业,1997(4):45-46.
[4]胡娟,金征宇,王静.菊芋菊糖的提取与纯化[J].食品科技,2007(4):62-65.
[5]吴立军.天然药物化学[M].北京:人民卫生出版社,2006:102,32-45.
[6]王启为,张境,张霞,等.用微波法提取菊芋中的菊糖[J].宁夏大学学报(自然科学版),2002,23(4):350-351.
[7]易华西,熊善柏,赵山,等.预处理对菊芋中菊糖提取精制的影响[J].食品研究与开发,2002,23(5):9-11.
[8]Zhao Zhi-fu,Zhu Hong-ji,Yu Jin-jin,Li Chao,Gao Gui-yan,Zeng Yi-wei.Impurity Removal from Inulin Extract of Jerusalem artichoke Tubers by Carbonation[J].Agric.Food Chem.,2009,30(14):14-71.
[9]郑文竹,姚炳新,魏文玲,等.从菊芋制备菊粉糖液的方法和菊芋干片成分分析[J].厦门大学学报(自然科学版),1996,35(l):112-115.
[10]刘德蔚.含菊糖类中草药的综合利用[J].中成药,1999,21(12):659.
[11]李世煜,晋小军,席旭东,等.内陆干旱灌区次生盐渍化土壤适宜种植菊芋品种筛选[J].中国农学通报,2010,26(15):198-202.
