海带热休克蛋白70基因体外原核表达研究
2011-07-12付万冬姚建亭段德麟
付万冬 ,姚建亭 ,段德麟
(1.浙江省海洋开发研究院,浙江舟山 316100;2.中国科学院海洋研究所,山东青岛 266071)
热休克蛋白是一组在结构上高度保守的蛋白质,广泛存在于原核和真核细胞中,正常情况下与应激条件下都发挥重要的生理功能,但在胁迫条件(包括热激、物理、化学和生物等胁迫因子)下,HSPs表达量显著增加。HSPs参与维持蛋白质空间构象,保护细胞生命活动,折叠和跨膜运输新生的蛋白,修复错误折叠的蛋白,帮助降解变性的蛋白,稳定细胞骨架和核骨架、增加细胞的抵抗能力等功能。
HSP70是热休克蛋白家族中重要成员,广泛分布于细胞核、细胞质、内质网、线粒体和叶绿体等细胞的各个部分[1-3]。HSP70在生物对逆境的适应,对减轻逆境胁迫引起的伤害和帮助生物度过不良环境中起到很大的作用。作为分子伴侣参与所有细胞内蛋白质的从头合成和定位、蛋白质的加工和错误折叠蛋白质的降解及其调节过程,因而在正常条件或胁迫条件下,对于细胞的功能和代谢都起到重要的作用[4-7]。
海带是潮间带典型的褐藻,有重要的经济价值和生态价值。固着藻类随潮汐变化,无法逃脱不利的生活环境,面临严重的环境胁迫。因此,固着藻类必须有适当的生理生化改变以应对环境胁迫。到目前为止,已在一些藻类中开展了有关胁迫应激的研究[8-15],但有关HSP70在海藻抗逆环境胁迫中的作用一直未得到深入了解,因此,开展研究海藻受胁迫后,HSP70在抗逆中的作用具有重要的理论意义和潜在的应用价值。在前期克隆得到海带细胞质定位的HSP70基因全长cDNA序列基础上[16-17],将海带HSP70基因的开放阅读框区域克隆到表达载体,并转化到原核表达系统,进行体外表达。以期为进一步研究藻类HSP70的生物学功能和海藻抗逆分子机制打下基础。
1 材料和方法
1.1 实验材料与仪器试剂
1.1.1 材料处理
海带cDNA由海带总RNA为模板反转录合成,大肠杆菌表达菌株BL21(DE3)pLysS由本实验保存。
1.1.2 仪器和试剂
仪器:高压灭菌锅YXQ-LS-S(上海博讯实业有限公司医疗设备厂,上海);电子天平AB104-N(梅特勒-托利多仪器有限公司,上海);台式冷冻离心机5417R、常温高速离心机5415D、Mastercycler Gradient PCR仪(Eppendorf仪器公司,德国);电泳仪及水平电泳槽(大连捷迈科贸有限公司,辽宁);水平电泳槽AE-7300(ATTO仪器公司,日本);ImageMaster VDS成像系统(Pharmacia Biotech,瑞典);Millipore纯水系统(Millipore公司,美国);超低温冰箱(三洋仪器公司,日本);超净工作台(苏净集团安泰公司,江苏)。
试剂:Taq DNA 聚合酶(附带 PCR buffer及 dNTPs)、RNA PCR Kit(AMV)Ver.3.0、PMD-18T(大连宝生物工程有限公司,中国)FastaGen小量胶回收试剂盒(飞捷生物技术有限公司,上海);pEASY-E2 Expression Kit(北京全式金生物技术有限公司,北京);LA Taq聚合酶(大连宝生物公司);DNA Marker(天根生化科技有限公司,北京);Nde I、Xho I内切酶(Promega公司,美国);其他试剂均为国产分析纯。
1.2 海带HSP70基因ORF的克隆
1.2.1 扩增海带HSP70 ORF引物的设计及合成
根据已克隆测序的海带HSP70基因核酸序列(Genbank Accession number:FJ375359),设计特异性引物扩增海带HSP70基因开放阅读框,引物信息如下:上游引物LJHSP70-EF:5′-ATGACAGCCGTCGAGGGAGAGAGCG-3′;下游引物 LJHSP70-ER:5′-GTCGATCTCCTCGATCTTGGGCCCG-3′。上游引物起始于起始密码子,下游引物终止于终止密码子前(不包括终止密码子)。从海带总RNA反转录成的cDNA中PCR扩增出HSP70基因开放阅读框,扩增产物为1 971 bp。引物由上海生工生物工程技术服务有限公司协助合成。
1.2.2 PCR 扩增海带 HSP70 基因 ORF
根据设计的引物LJHSP70-EF和LJHSP70-ER从海带cDNA中扩增HSP70 ORF。PCR反应体系的组成(共50 μL):10×buffe(rMg2+,25 mM),5 μL;dNTP Mixture(10 mM each),2 μL;Ex Taq聚合酶(2.5 U/μL),0.25 μl;海带 cDNA,2 μL;引物(各 10 μM),2 μL;dH2O,36.75 μL。PCR 反应条件:预扩增 94 ℃,3 min;扩增反应35个循环;变性94℃,30 s;退火58℃,30 s;延伸72℃,2 min;最后延伸72℃,10 min。
1.3 HSP70表达质粒的构建和鉴定
1.3.1 pEASY-E2(+)/HSP70 表达质粒的构建
取PCR产物在1%琼脂糖凝胶,100 V电泳30 min,在253 nm波长下观察拍照。目的产物用Fastagen小量DNA胶回收试剂盒纯化,按说明书所示方法进行。将纯化的目的片段HSP70和pEASY-E2以体积比2:1混匀,在25℃下连接5 min。将连接好的重组质粒命名为pEASY-E2(+)/HSP70。BL21(DE3)感受态细胞的制备、pEASY-E2(+)/HSP70质粒的连接和转化等步骤参照《分子克隆实验指南》(第3版)。
1.3.2 pEASY-E2(+)/HSP70 表达质粒的鉴定
(1)PCR法鉴定正确表达方向的阳性重组子
挑选阳性克隆于10 μL无菌水中,涡旋混匀作为反应模板,15 μL PCR反应体系组成如下:2×Taq Mixer,7.5 μL;菌液,2 μL;LJHSP70-EF(10 μM),1 μL;T7 terminator primer(10 μM),1 μL;dH2O,3.5 μL。PCR反应条件:预扩增94℃,3 min;扩增反应35个循环;变性94℃,30 s;退火58℃,30 s;延伸72℃,2 min;最后延伸温度72℃,10 min。取PCR产物在1%琼脂糖凝胶,100 V电泳30 min,在253 nm波长下观察拍照。阳性克隆重组子在2 000 bp左右会有1条电泳条带。
(2)限制性酶切分析阳性重组子
挑选正确表达方向的阳性重组子过夜培养。用碱裂解法提取质粒,具体步骤参照《分子克隆实验指南》(第3版)。对提取的重组质粒pEASY-E2(+)/HSP70,用Nde I和Xho I双酶切,酶切反应于37℃条件下保温3~4 h,使酶切反应完全。1%琼脂糖凝胶电泳鉴定筛选的阳性克隆并照相。阳性克隆由上海生工生物工程技术服务有限公司进行克隆片段的DNA测序,测序结果与HSP70核酸序列进行比对。将含正确序列的阳性重组质粒的表达菌株BL21(DE3)命名为BL21(DE3)/pEASY-E2(+)/HSP70。
1.4 海带HSP70的体外表达和电泳检测
将重组菌BL21(DE3)/pEASY-E2(+)/HSP70接种于5 mL含有100 μg/mL氨苄青霉素的LB液体培养基中,于37℃振荡过夜培养。次日分别取出1 mL菌液接入3瓶50 mL相同的培养基继续培养2~3 h(OD600约0.6)后,加入终浓度分别为0 mM、1 mM和5 mM的IPTG诱导表达,于37℃振荡培养不同时间,以BL21(DE3)/pEASY-E2(+)作为空白对照。每小时取出菌液1 mL,5 000×g离心10 min,收集菌体备用。
取上述不同时间阶段的1 mL菌液离心得到的菌体加100 μL dH2O,分别与等体积的2×上样缓冲液混合,100℃水浴5~8 min。上样前8 000×g离心5 min。配制12%的SDSPAGE分离胶和5%的浓缩胶,取20 μL加样于凝胶,在浓缩胶中20 mA,分离胶中40 mA进行SDS-PAGE(Laemmli,1970)恒流电泳,电泳结束后将凝胶用聚丙烯酰胺凝胶染色液,染色15 min。染色结束后用脱色液将聚丙烯酰胺凝胶背景颜色脱色干净,此时蛋白质条带可以清楚显现出来。
2 结果与分析
2.1 PCR扩增海带HSP70的ORF
根据本研究得到海带HSP70 cDNA序列信息,设计了表达海带HSP70蛋白的引物,从海带cDNA中扩增出1 970 bp左右的DNA片段(图1),和预期要扩增的片段大小一致,是否目的片段还要进一步验证以确定。

图1 PCR扩增海带HSP70 ORF结果Fig.1 The result of ORF fragment of L.japonica HSP70 of PCR amplication
2.2 HSP70表达质粒的鉴定
2.2.1 PCR 扩增鉴定阳性的重组子
将扩增得到的目的片段进行了胶回收,和PMD-18T载体进行连接,再转化大肠杆菌DH5α,将阳性克隆送往上海生工生物工程有限公司测序。确定是扩增的目的片段后,将回收的目的片段和/pEASY-E2表达载体连接,再转化表达菌株BL21(DE3),挑选阳性克隆利用表达蛋白上游引物LJHSP70-EF和表达载体T7终止引物序列进行PCR扩增鉴定阳性的重组子。检测结果如图2所示。根据结果可知挑选2个阳性重组子插入方向正确,可以进行下步蛋白表达实验。

图2 PCR检测阳性克隆的结果Fig.2 The result of detection of positive cloning fragment by PCR
2.2.2 限制性酶切分析阳性重组子
对提取的重组质粒pEASY-E2(+)/HSP70,用Nde I和Xho I双酶切,结果表明阳性克隆的质粒能被两种酶酶切成线性的质粒片段和目的片段(图3)。

图3 pEASY-E2(+)/HSP70表达质粒的Nde I和Xho I双酶切图谱Fig.3 Restriction patterns of plasmid pEASY-E2(+)/HSP70 digested with Nde I and Xho I
2.3 海带HSP70基因体外表达
将构建好的表达质粒pEASY-E2(+)/HSP70转化到大肠杆菌表达菌株BL21(DE3),挑选阳性重组子进行LB液体培养,当菌液的OD600约0.6时,加入终浓度分别为0 mM,1 mM和5mM的IPTG在37℃下培养诱导,以空载体pEASY-E2(+)重组子作为对照。每小时取样1次,检测外源蛋白的表达量。结果表明空载体重组子在SDS-PAGE图谱上无72 kDa左右的蛋白条带(图4);无IPTG诱导的阳性重组子在SDS-PAGE图谱上在72 kDa左右有1条非常微弱条带(图5);而阳性重组子在1 mM或5 mM的IPTG诱导下,SDS-PAGE图谱上在72 kDa左右有1条明显的条带(图6,图7),这与海带HSP70的预测分子量72.03 kDa的结果相符合,说明海带HSP70基因在体外成功地获得了表达。不同时间对海带HSP70蛋白诱导表达结果表明,海带HSP70蛋白的产生与体外诱导时间显著相关,未诱导的培养液中几乎没有HSP70蛋白的产生。在1 mM或5 mM的IPTG诱导下,伴随诱导时间的增长,HSP70蛋白的表达量显著增加,当诱导5 h以后,基因的表达达到平台,继续培养,HSP70的表达并不显著增高。本研究中,5mM的IPTG诱导外源蛋白HSP70的表达量要高于相应时刻1 mM的IPTG诱导外源蛋白HSP70的表达量。

图4 不同培养时间下,BL21(DE3)/pEASY-E2(+)的SDS-PAGE分析Fig.4 Analysis of BL21(DE3)/pEASY-E2(+)by SDSPAGE in different cultured times

图5 无IPTG,不同培养时间下,BL21(DE3)/pEASY-E2(+)/HSP70的SDS-PAGE分析Fig.5 Analysis of the E.coli BL21(DE3)/pEASY-E2(+)/HSP70)by SDS-PAGE in different cultured times at IPTG concentration of 0 mM.Lane M:Protein Marker;
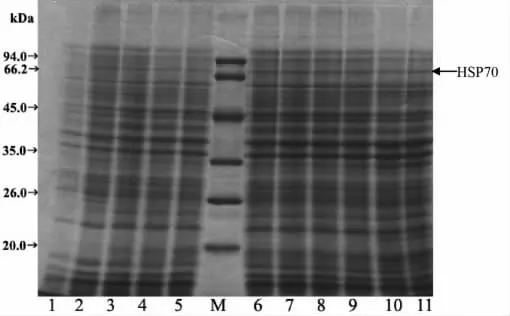
图6 1 mM IPTG诱导不同时间后,BL21(DE3)/pEASYE2(+)/HSP70的SDS-PAGE分析Fig.6 Analysis of the E.coli BL21(DE3)/pEASY-E2(+)/HSP70)by SDS-PAGE in different induced times at IPTG concentration of 1 mM.Lane M:Protein Marker;

图7 5 mM IPTG,不同诱导时间,BL21(DE3)/pEASY-E2(+)/HSP70的SDS-PAGE分析Fig.7 Analysis of the E.coli BL21(DE3)/pEASY-E2(+)/HSP70)by SDS-PAGE in different induced times at IPTG concentration of 5 mM.Lane M:Protein Marker;
3 讨论
重组子成功构建是实现基因体外表达的关键。根据海带HSP70基因的蛋白序列分析,将编码HSP70成熟肽的开放阅读框序列克隆到pEASY-E2表达载体上并转化到大肠杆菌BL21(DE3)中。转化子经PCR筛选、序列测定以及SDS-PAGE电泳等多重鉴定,结果显示,HSP70基因的插入方向正确、序列结构完整、且基因片断正确的插入到表达载体相应的位置,成功地构建了海带HSP70基因的重组子。SDS-PAGE电泳分析显示,与无插入片段的阴性对照相比,在预测大小区域内,有72 kDa蛋白插入,证明海带HSP70重组蛋白获得了表达。
重组蛋白的高效表达,是体外获得大量重组蛋白的基础。体外表达受多种因素影响,包括培养温度,诱导时间,诱导剂量等。不同诱导时间对重组蛋白表达的影响实验结果表明,经IPTG诱导,菌体很快就能产生重组蛋白,重组蛋白的产量随诱导时间而增加。约5 h后,其表达量达到平台期,过长时间的表达,重组蛋白的产量并没有显著增加。由于选择质粒带有氨卞青霉素的抗性,在重组蛋白的表达过程中,氨卞青霉素具有很强的选择作用,保证了重组质粒的正常生长。但是,氨卞青霉素本身很不稳定,在细菌培养液中容易被降解,而失去对重组质粒的保护。因此在重组蛋白的表达过程中,缩短培养时间对保证重组蛋白的纯度、预防污染,都有重要的意义。
重组蛋白的纯化方法很多,包括葡聚糖层析、等电点分离、亲和层析、透析等多种技术。一般地,为获得较高纯度的蛋白质,一般需要结合一种或几种不同的纯化技术共同进行。本研究选用的表达载体是pEASY-E2,其上带有6个组氨酸,6个组氨酸在高pH值时与Ni亲和柱形成共价结合,从而可将其它菌体杂蛋白逐渐洗脱掉。然后逐渐降低pH,在低pH条件下6个组氨酸与Ni亲和柱分离,从而将重组蛋白洗脱,最终获得较纯的重组蛋白。获得的经纯化的重组蛋白,须经离体和在体的活性鉴定,才可最终确定其生物学活性和潜在应用价值,这部分的研究工作正在进行中。
[1]BOSTON R S,VIITANEN P V,VIERLING E.Molecular chaperones and protein folding in plant[J].Plant Mol Biol,1996,32(1/2):191-222.
[2]KIANG J G,TSOKOS G C.Heat shock protein 70 kDa:molecular biology,biochemistry,and physiology[J].Pharmacol Ther,1998,80:183-201.
[3]RENNER T,WATERS E R.Comparative genomic analysis of the Hsp70s from five diverse photosynthetic eukaryotes[J].Cell Stress Chaperon,2007,12:172-185.
[4]YANG X D,FEIGE U.Heat shock proteins in autoimmune disease:from causative antigen to specific therapy[J].Experientia,1992,48:650-656.
[5]JOLLY C,MORIMOTO R I.Stress and the cell nucleus:dynamics of gene expression and structural reorganization[J].Gene Expr,1999,7:261-270.
[6]MAYER M P,BUKAU B.Hsp70 chaperones:cellular functions and molecular mechanism[J].Cell Mol Life Sci,2005,62:670-684.
[7]TANAKA K I,NAMBA T,ARAI Y,et al.Genetic evidence for a protective role for heat shock factor 1 and heat shock protein 70 against colitis[J].J Biol Chem,2007,282:23 240-23 252.
[8]VAYDA M E,YUAN M L.The heat shock response of an Antarctic alga is evident at 5 ℃[J].Plant Mol Biol,1994,24:229-233.
[9]LEWIS S,MAY S,DONKIN M E,et al.The influence of copper and heat shock on the physiology and cellular stress response of Enteromorpha intestinalis[J].Mar Environ Res,1998,46:421-424.
[10]IRELAND H E,HARDING S J,BONWICK G A,et al.Evaluation of heat shock protein 70 as a biomarker of environmental stress in Fucus serratus and Lemna minor[J].Biomarkers,2004,9:139-155.
[11]LI R,BRAWLEY S H.Improved survival under heat stress in intertidal embryos(Fucus spp.)simultaneously exposed to hypersalinity and the effect of parental thermal history[J].Mar Biol,2004,144:205-213.
[12]ROEDER V,COLLÉN J,ROUSVOAL S,et al.Identification of stress genes from Laminaria digitata(Phaeophyceae)protoplast cultures by expressed sequence tag analysis[J].J Phycol,2005,41:1 227-1 235.
[13]COLLÉN J,GUISLE-MARSOLLIER I,LEGER J J,et al.Response of the transcriptome of the intertidal red seaweed Chondrus crispus to controlled and natural stresses[J].New Phytol,2007,176:45-55.
[14]HENKEL S K,HOFMANN G E.Differing patterns of hsp70 gene expression in invasive and native kelp species:evidence for acclimation-induced variation[J].J Appl Phycol,2008a,20:915-924.
[15]HENKEL S K,HOFMANN G E.Thermal ecophysiology of gametophytes cultured from invasive Undaria pinnatifida(Harvey)Suringar in coastal California harbors[J].J Exp Mar Biol Ecol,2008b,367:164-173.
[16]FU W D,YAO J T,LIU F L,et al.Molecular cloning and expression analysis of a HSP70 gene from Laminaria japonica(Laminariaceae,Phaeophyta)[J].Marine Biotechnology,2009,11:738-747.
[17]FU W D,SHUAI L,YAO J T,et al.Molecular Cloning and Analysis of a Cytosolic Hsp70 Gene from Enteromorpha prolifera(Ulvophyceae,Chlorophyta)[J].Plant Mol Biol Rep,2010,28:430-437.
