酶水解制备鲤鱼肉蛋白抗氧化肽
2011-07-09孔保华
施 雪,孔保华,刘 骞
(东北农业大学食品学院,哈尔滨 150030)
鲤鱼(Common carp,Cyprinus carpio)是我国养殖量最大的一种淡水鱼,是非常重要的淡水鱼资源。鲤鱼的蛋白质不但含量高,而且质量也佳,人体消化吸收率可达96%。蛋白的酶水解作用能够提供更多具有市场价值和附加价值的鱼蛋白产品[1]。近年来许多研究表明,蛋白质酶解有助于改善其营养价值和功能特性[2-3]。多肽具有比蛋白质易于消化吸收、能迅速给机体提供能量、无蛋白质变性、分子量小、易溶于水等特点[4]。因此有越来越多的研究者把目光投到酶解鱼肉蛋白和鱼副产物的研究上,盘赛昆和顾小红等筛选出复合蛋白酶作为酶解鲤鱼肉制备具有清除羟自由基活性酶解物的水解酶[5]。丁利君和钟森辉优化出枯草杆菌蛋白酶对鳕鱼肉蛋白行酶解的工艺参数[6]。游丽君等用不同酶水解泥鳅肉蛋白,优化出最佳工艺条件[7]。周燕芳等研究木瓜蛋白酶水解罗非鱼蛋白质的工艺条件[8]。国外的学者对酶解抗氧化肽工艺参数的筛选和水解物抗氧化性的研究也很深入,Yang等研究军曹鱼皮凝胶在四种不同酶水解条件下得到的水解产物的抗氧化性[9]。Samaranayaka等研究了风味蛋白酶水解大洋鳕鱼的酶解条件和水解物的抗氧化性[10]。
氧化是食品生产和贮藏中面临的最大问题,而且防止脂肪氧化最直接的方法就是添加抗氧化剂[11]。人工合成的抗氧化剂(如BHA、BHT、PG等)具有很强的抗氧化能力。然而,合成抗氧化剂的安全性限制其在食品中的应用[12]。人们把目光逐渐转向了天然抗氧化剂,研究发现一些植物和动物蛋白质在水解后具有一定的抗油脂和脂肪酸氧化的功效,其中最具有代表性的有:大豆蛋白[13],卵黄蛋白[14],鲔鱼蒸煮汁液[15],鲱鱼肉蛋白[16],鯖鱼肉蛋白[17],毛鳞鱼肉蛋白[18]等。本文采用碱性蛋白酶、风味蛋白酶、中性蛋白酶和胰蛋白酶水解鲤鱼肉蛋白,研究了鲤鱼肉蛋白水解条件的工艺,以卵磷脂脂质氧化体系的抑制作用和还原能力为参数,优化出最适的水解条件,从而获得具有抗氧化活性的鲤鱼肉蛋白肽。
1 材料和方法
1.1 材料与主要试剂
鲤鱼(购自哈尔滨大润发超市),碱性蛋白酶(Alcalase)、风味蛋白酶(Flavourzyme)、中性蛋白酶(Dispase)、胰蛋白酶(Trpsin)(购自北京奥博星生物科技有限公司);大豆卵磷脂、丁基羟基茴香醚(butylated hydroxyanisole,BHA)、三吡啶三吖嗪(2,4,6-Tris(2-pyridyl)-s-triazine,TPTZ)(购自Sigma试剂公司)。其他试剂均为国产分析纯。
1.2 主要仪器设备
pH S-25型pH计(购自上海精科雷磁仪器厂)、高速离心机TGL-16C(购自上海安亭科学仪器厂)、JD500-2型电子天平(购自沈阳龙腾电子称量仪器有限公司)、精密电子天平AL-104(购自上海梅特勒-托利多仪器设备有限公司)、紫外可见分光光度计UT-1800(购自北京普析通用仪器有限公司)、电热恒温水浴锅DK-8B(购自上海精宏实验设备有限公司)、精密增力电动搅拌器JJ-1(购自常州国华电器有限公司)。
1.3 实验方法
1.3.1 蛋白水解产物的制备
超市购得的新鲜活鲤鱼在4℃低温下运回实验室,然后去头、去尾、去鳞、去皮,剔下鱼肉,用水清洗干净并沥干,将鱼肉用绞肉机绞碎。参照文献[19]方法稍作修改,将一定量的鱼肉(湿重蛋白含量为16.05%),与适量的水混合,配制成底物浓度为4%(w/w)的样品溶液,用均质机在7 000 r·min-1下均质1 min。在酶水解之前把样品置于90℃下预热10 min,用1 mol·L-1的NaOH调节溶液的pH到各种酶的最适pH,加入(E/S)的浓度比均是1.5∶100,在最适温度下振荡水解,反应过程中不断添加1 mol·L-1的NaOH,使pH保持恒定,记录下所消耗的氢氧化钠的量,用于计算水解度。当反应到所需的时间后,用1 mol·L-1的HCl将水解液的pH调整到7.0,水解结束,在90℃水浴下保温5 min使酶失去活性。待酶解液冷却后以6 000 r·min-1的速度4℃下离心10 min,弃去沉淀,溶液即为水解液。各种酶的水解条件按照供应商提供的最佳条件,碱性蛋白酶的水解温度55℃,pH 8.0;风味蛋白酶水解温度50℃,pH 7.0;中性蛋白酶水解温度50℃,pH 7.5;胰蛋白酶水解温度50℃,pH 7.0。
1.3.2 水解度的测定
参照pH-Stat法[20],水解度计算公式为:
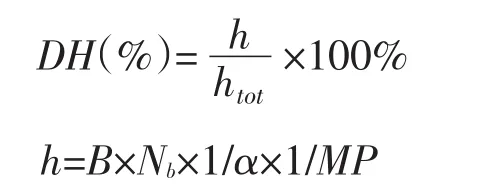
式中,h-单位质量蛋白质中被水解的肽键的量(mmol·g-1);htot-单位质量蛋白质中肽键的总量(mmol·g-1),鲤鱼肉蛋白htot-7.2 mmol·g-1;B-水解过程中所消耗的碱量(mL);Nb-碱液的浓度(mol·L-1);MP-水解液中蛋白质的质量(g);1/α-校正系数。
1.3.3 脂肪氧化体系(Liposome)的制备
大豆卵磷脂脂质体氧化体系(Soybean phosphatidylcholine liposome,Liposome), 采用 Decker 和Hultin方法[21]并进行一些修改。将大豆卵磷脂溶解在 0.12 mol·L-1的 KCl,5 mmol·L-1组氨酸缓冲溶液(pH 6.8)中,均质,并在4℃下进行超声波处理45 min,大豆卵磷脂最后浓度为0.2 mg·mL-1。取5 mL liposome加入1 mL的酶水解样品溶液,空白用1 mL水代替1mL的样品溶液与5 mL Liposome溶液混合,同时以未水解的鲤鱼肉蛋白样品作为对照。脂质氧化是由铁的氧化还原反应引发的,将0.1 mL 50 mmol·L-1FeCl3和 0.1 mL 10 mmol·L-1抗坏血酸钠加入Liposome混合物中。样品在37°C水浴中保温1 h,并迅速测定TBARS值。
1.3.4 TBARS的测定
TBARS测定参照Sinnhuber和Yu的方法[22],并进行一些改进。取1 mL上述处理好的样品加入3 mL硫代巴比妥酸溶液、17 mL三氯乙酸-盐酸溶液,混匀后,沸水浴中反应30 min,冷却,从中吸取5 mL加入等体积的三氯甲烷,3 000 r·min-1下离心10 min,532 nm下读取吸光值。TBARS值以每升脂质氧化溶液中丙二醛(MDA)的毫克数表示。计算公式为:

式中,A532-溶液的吸光值;Vs-样品的体积(1 mL);9.48-常数。
1.3.5 还原能力的测定
FRAP测定参照Benzie与Strain的方法[23]。取6.0 mL新配的FRAP试剂(由100 mL pH 3.6的30 mmol·L-1醋酸盐缓冲溶液,10 mL 10 mmol·L-1三吡啶三吖嗪(TPTZ)溶液,和10 mL 20 mmol·L-1FeCl3·6H2O溶液混合在一起组成)预热到37℃。然后向其中加入0.2 mL水解产物样品和0.6 mL蒸馏水,在593 nm下读取吸光值,为进行比较,同时作对照试验。以100~1 000 μmol·L-1FeSO4·7H2O 制作标准曲线。样品抗氧化能力以达到同样吸光度所需的FeSO4·7H2O毫摩尔数表示。
1.3.6 碱性蛋白酶水解条件的优化
酶与底物浓度比对抗氧化效果的影响:在pH为8.0、温度为55℃,底物浓度3%的条件下,酶与底物浓度比分别为0.5%、1%、1.5%、2%,水解时间为4 h,测定水解液的TBARS值以及还原能力。
不同底物浓度对抗氧化效果的影响:在pH为8.0、温度为55℃的条件下,对鲤鱼肉蛋白进行酶解。选用2%、3%、4%、5%的底物浓度,酶与底物浓度比为1.5%,水解时间为4 h,测定水解液的TBARS值以及还原能力。
水解时间对抗氧化效果的影响:在pH为8.0、温度为55℃,底物浓度为4%的条件下,酶与底物浓度比为1.5%,水解时间为0.5、1、2、3、4、5、6 h,测定水解液的TBARS值以及还原能力。
1.3.7 鲤鱼肉蛋白水解物与常用抗氧化剂之间的比较研究
将碱性蛋白酶水解制得的鲤鱼肉蛋白水解物与BHA、抗坏血酸(Vc)等常用抗氧化剂的抗氧化性进行比较研究,测定他们之间的抗氧化活性差异。
1.3.8 统计分析
每个试验重复3次,结果表示为平均数±标准差。数据统计分析采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序,采用Sigmaplot 9.0软件作图。
2 结果与分析
2.1 不同蛋白酶不同水解时间的水解度(DH)
由碱性蛋白酶、风味蛋白酶、中性蛋白酶、和胰蛋白酶在最适条件下对鲤鱼肉蛋白分别进行酶解,结果见图1。

图1 不同蛋白酶在不同水解时间的水解度Fig.1 Degree of hydrolysis of different protease at different hydrolysis times
由图1可知,四种蛋白酶随着水解时间的延长,水解度不断增大,但其增大的速度与所选用的蛋白酶的种类、水解时间密切相关。风味蛋白酶、中性蛋白酶,胰蛋白酶在水解初期水解度增加稍快,水解1 h后,水解度曲线趋于平缓。但是碱性蛋白酶水解初期的时候水解度增加最迅速,到4 h时水解曲线趋于平缓。在所有的水解样品中,碱性蛋白酶水解产物的水解度最高,在4 h时碱性蛋白酶、风味蛋白酶、中性蛋白酶、和胰蛋白酶的水解度分别为13.39%、0.85%、3.27%和0.85%。碱性蛋白酶具有很强的水解能力、耐碱能力和耐热能力,同时还具有一定的酯酶活力,它不但能水解肽键,还具有水解酯键、酰胺键和转酯及转肽的功能。在蛋白质的水解过程中,会使蛋白的结构展开,使氨基酸残基充分暴露出来从而使蛋白质的水解更加充分。另外蛋白质分子在水解前进行预热,使蛋白质变性,使一些能形成氢键的基团和疏水基团充分暴露,所以酶能够更加充分的对变性的蛋白质进行水解。
2.2 水解产物对卵磷脂脂质氧化的抑制作用
结果见图2。

图2 不同蛋白酶和不同水解时间对卵磷脂脂质氧化的抑制作用Fig.2 Inhibition of lipid oxidation in a liposome system of different protease and different hydrolysis time
由图2可知,相对于未水解鲤鱼肉,酶水解鲤鱼肉蛋白后所得到的水解产物都对卵磷脂脂质氧化体系中TBARS具有显著地抑制作用(P<0.05)。同一水解时间条件下,碱性蛋白酶水解所获得的水解产物的抗氧化能力要高于其它三种蛋白酶水解产物的抗氧化能力。蛋白水解产物抑制脂肪氧化的能力与水解度有关,因为蛋白本身的结构使其只有很小的抗氧化能力,而经过酶水解后使蛋白质结构发生改变,使得具有抗氧化能力的活性氨基酸残基以及肽链暴露在外边,使得抗氧化能力大大增强。然而抗氧化能力与水解度并不呈线性关系,而是与其在一定水解度条件下形成的特定结构有关(如肽链的长度、活性氨基酸残基的比率等),这与Kong等的研究结论一致[24]。以TBARS值作为评价指标时,碱性蛋白酶是理想的酶,并且在4 h的时候TBARS值最低,即丙二醛(MDA)的含量最低。MDA的含量在一定程度上反映脂质过氧化损伤的程度。
2.3 水解产物还原能力的测定
结果见图3。
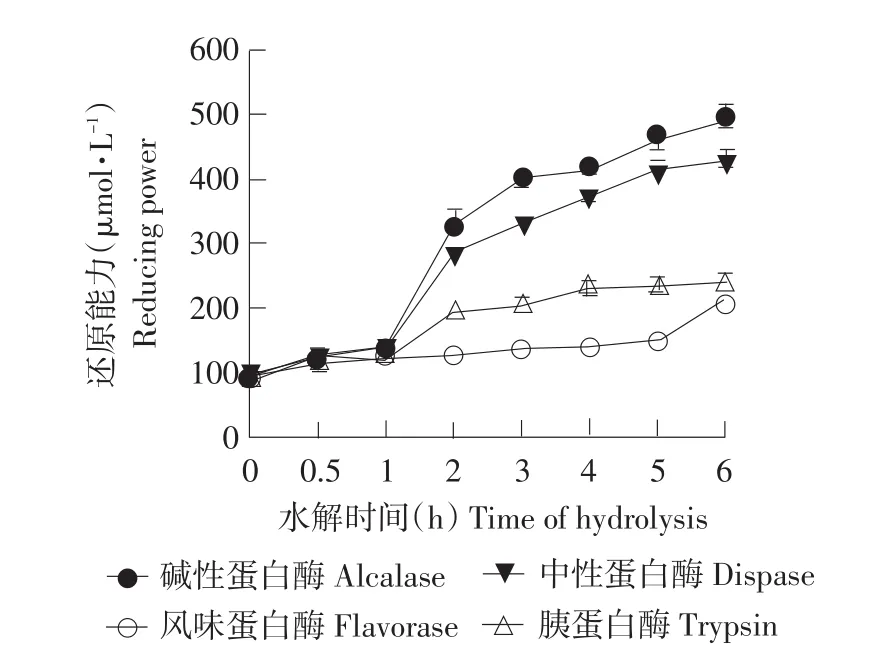
图3 水解时间对鲤鱼肉蛋白水解产物还原能力的影响Fig.3 Effect of hydrolysis time on the reducing power of carp protein hydrolysates
由图3可知,鲤鱼肉蛋白水解产物的FRAP值随着水解时间的延长而显著增加(P<0.05)。未水解的鲤鱼肉蛋白虽然也具有一定的还原能力,但效果要远远小于水解物的还原能力。与水解度变化趋势相似,反应初期四种酶的FRAP值增加迅速,碱性蛋白酶酶解产物的FRAP值最高。FRAP法实质是基于氧化还原反应的比色法,非酶抗氧化剂可以看作还原剂,把氧化物质还原,从而起到抗氧化剂的作用,在波长593 nm处测定的吸光值越大,则样品的还原能力越强[25]。蛋白水解产物的还原能力是由于肽链的断裂增加了还原剂氢离子的数量。此外,由于水解后蛋白质结构破坏,导致了水解产物具有很强的清除自由基能力[26]。因而鲤鱼肉蛋白水解产物的还原能力与其水解后的蛋白结构及其肽链断裂的位置有很大关系。随着水解时间的延长,FRAP值持续上升,在4 h后上升幅度迟缓。综合考虑各种因素选择碱性蛋白酶在4 h时的FRAP值最好。
2.4 碱性蛋白酶水解工艺的优化
2.4.1 酶与底物浓度比对抗氧化能力的影响
酶与底物浓度比([E]/[S])对抗优化效果的影响见图4。试验选用的蛋白质浓度为3%,碱性蛋白酶与底物浓度比分别为0.5%、1%、1.5%、2%,反应时间为4 h的条件。

图4 酶与底物浓度比对水解产物抗氧化能力的影响Fig.4 Effect of different(E/S)on the antioxidant activity of hydrolysates
从图4中可以看出,在底物浓度确定的条件下,随着酶与底物浓度比的增大,水解度呈上升趋势,但是酶与底物浓度比在1.5%~2%之间时水解度变化不大。在整个酶与底物浓度比变化区间内,TBARS值呈下降趋势,表明抑制作用逐渐增强,酶与底物浓度比在2%时的抗氧化效果最好。在酶与底物浓度比为0.5%~1.5%之间时,FRAP值呈上升趋势,表明水解产物的还原能力逐渐增加,但是酶与底物浓度比在1.5%~2%之间时,还原能力略有下降。因此综合考虑以上几个因素,选定酶与底物浓度比为1.5%。
2.4.2 底物浓度对抗氧化能力的影响
结果见图5。在底物浓度为2%、3%、4%、5%,酶与底物浓度比为1.5%,水解时间为4 h的条件,测定水解液的水解度、TBARS值和FRAP值来确定底物浓度对水解产物抗氧化效果的影响。
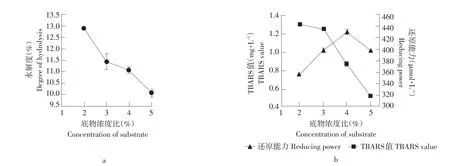
图5 不同底物浓度对水解产物抗氧化能力的影响Fig.5 Effect of different substrate concentrations on the antioxidant activity of hydrolysates
由图5可知,从不同底物浓度的鲤鱼肉蛋白水解产物对脂质氧化体系的抑制曲线趋势看来,在2%~5%之间水解度随着底物浓度的增加,略有下降的趋势,说明并不是底物浓度越大抗氧化效果越好;TBARS值随着底物浓度的增加呈下降趋势,即对卵磷脂脂质氧化体系的抑制作用增强,抗氧化效果增强;而且随着底物浓度的增加,FRAP值呈上升趋势,即抗氧化效果增强,当底物浓度为4%时,还原能力效果最好。这是由于鲤鱼肉蛋白肽键的断裂,增加了还原剂氢离子的数量,此外肽中的氨基酸残基数量和肽键断裂位点直接影响水解产物的抗氧化能力。Peña-Ramos等研究表明蛋白水解产物中富含大量的氨基酸残基[27],包括亮氨酸、脯氨酸、丙氨酸和苯丙氨酸,这些氨基酸残基与蛋白水解产物的抗氧化能力有着很大关系,而且碱性蛋白酶水解产物增加了抗氧化氨基酸残基的数量,其抗氧化能力也得到进一步的增加[27]。随着底物浓度的增大,酶与底物能够充分接触,致使更多的肽键断裂,所以抗氧化能力增强,而当浓度继续增大时,酶与底物的结合达到饱和,酶的水解反应趋于平衡。从以上阐述来看,综合考虑水解度、TBARS值和FRAP值,底物浓度为4%的水解产物抗氧化作用最好,因此选定4%为最佳底物浓度。
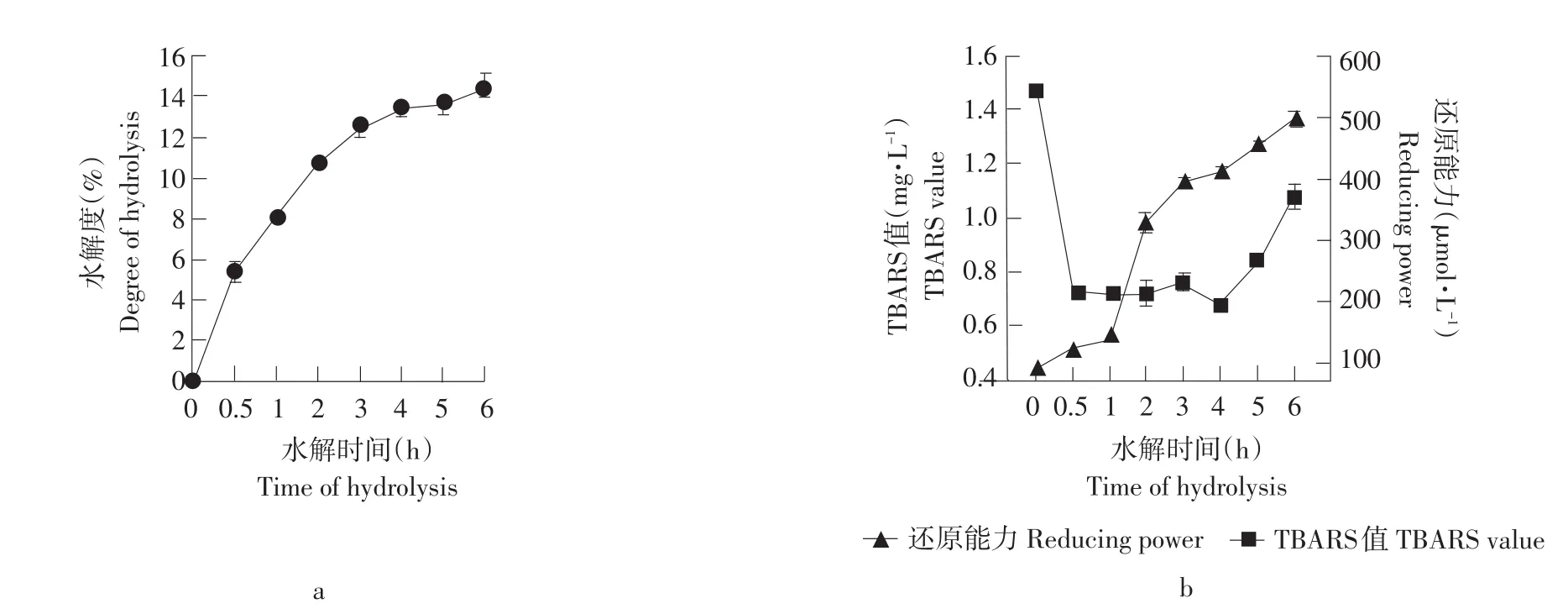
图6 不同水解时间对水解产物抗氧化能力的影响Fig.6 Effect of different hydrolysis time on the antioxidant activity of hydrolysates
2.4.3 水解时间对抗氧化能力的影响
本试验在底物浓度为4%,酶与底物浓度比为1.5%,测定不同水解时间的水解产物的TBARS值和FRAP值来确定水解时间对水解产物抗氧化效果的影响。结果见图6。
由图6可知,随着水解时间的增加,在0~3 h水解度增加迅速,之后水解度曲线变化缓慢;在0~0.5 h之间TBARS值迅速下降,随着水解时间的增加,TBARS值趋于平缓,水解4 h后TBARS值又逐渐上升,由于TBARS值和抗氧化活性成反比,当TBARS值越低则抗氧化活性越高,由此得知4 h的水解产物具有较强的抗氧化效果;同样随着水解时间的延长,鲤鱼肉蛋白水解产物的还原能力逐渐增强,但水解4 h后的水解产物的FRAP曲线变化十分缓慢,说明抗氧化效果增长缓慢。综合考虑水解度、TBARS值和FRAP值,最后确定最佳水解时间为4 h。因此也就表明水解时间越长,鲤鱼肉蛋白水解产物的抗氧化效果不是越好,而是只有在特定的水解条件下,水解产物具有最大的抗氧化效果。
2.4.4 鲤鱼肉蛋白水解物与常用抗氧化剂之间的比较研究
鲤鱼肉蛋白水解产物与常用抗氧化剂之间的比较见表1。4 h的碱性蛋白酶水解物对TBARS抑制效果低于0.01%BHA及0.01%抗坏血酸(P<0.05),而FRAP值比0.01%抗坏血酸高(P<0.05),即还原能力较强。但是与未水解的鲤鱼肉蛋白相比,其抗氧化效果有明显优势(P<0.05)。

表1 鲤鱼肉蛋白水解物与常用抗氧化剂之间的比较Table 1 Comparison of antioxidative activities between carp peptides and common antioxidant
3 讨论与结论
本试验使用4种不同的蛋白酶,首先测定四种蛋白酶的DH、TBARS和FRAP,选出碱性蛋白酶为最佳水解酶。因此用碱性蛋白酶在不同的底物浓度、不同酶与底物浓度比、不同水解时间条件下,对鲤鱼肉蛋白进行水解,最后选择出最适的水解工艺条件为:底物浓度为4%,酶与底物浓度比为1.5%,水解时间为4 h,综合考虑DH、TBARS和FRAP,认为此时的水解产物具有较好的抗氧化效果。研究还表明水解产物的抗氧化能力在某一最适水解条件下,其抗氧化效果才能达到最佳。当水解度在4 h左右时,鲤鱼肉蛋白碱性蛋白酶水解产物具有良好的抗氧化能力。因此鲤鱼肉蛋白的水解产物可以作为一种天然抗氧化剂用于食品中,可以有效防止食物氧化,对于食品天然抗氧化剂方面的发展具有实际意义。结合我国的具体情况和人们的饮食习惯,本试验选择含有大量蛋白质的鲤鱼,通过酶解等手段,可制备低分子肽制品、精制氨基酸、等高质量水解蛋白制品。这不仅可提高其附加值,改善蛋白质的功能特性,提高其品质,同时减少环境污染,为开创良好的经济与社会效益服务。但是利用水产品制备的高质量的水解蛋白制品仍然有许多问题没有解决,如鱼腥味的残留、苦味肽的产生,鱼蛋白的水解度不高等。因此,如何利用水产品来制备高质量的水解蛋白制品仍然是个亟待解决的问题,是未来的研究方向。
[1]Guerard F,Guimas L,Binet A.Production of tuna waste hydrolysates by a commercial neutral protease preparation[J].Journal of Molecular Catalysis B.Enzymatic,2002,19-20:489-498.
[2]冯怀蓉,张慧涛,茆军,等.多肽简介及应用[J].新疆农业科学,2002,39(1):38-39.
[3]赵锐,顾谦群,管华诗.天然活性多肽的研究进展[J].天然产物研究与开发,2000,12(4):84-91.
[4]Siemensma A D,Weijer W J,Bak H J.The importamce of peptide lengths in hypoallergenic imfant formulae[J].Trends in Food Science and Fechnology,1993,4(1):16-21.
[5]盘赛昆,顾小红,汤坚,等.鲤鱼肉酶解物清除羟自由基的研究[J].食品研究与开发,2009,30(9):23-27.
[6]丁利君,钟森辉.鳕鱼蛋白酶解工艺优化及其酶解液抗氧化研究[J].食品科学,2008,29(8):398-401.
[7]游丽君,崔春,赵谋明,孙为正.不同酶水解泥鳅蛋白的特性研究[J].四川大学学报,2008,40(1):74-80.
[8]周燕芳,林燕如,李粉玲,等.木瓜蛋白酶水解罗非鱼蛋白质的工艺研究[J].安徽农业科学,2008,36(8):3360-3362.
[9]Yang J I,Ho Hsin-Yi,Chu Yuh-Jwo,et al.Characteristic and antioxidant activity of retorted gelatin hydrolysates from cobia(Rachycentron canadum)skin[J].Food Chemistry,2008,110:128-136.
[10]Samaranayaka Anusha G P,Li-Chan Eunice C Y.Autolysis-assisted production of fish protein hydrolysates with antioxidant properties from Pacific hake(Merluccius productus)[J].Food Chemistry,2008,107:768-776.
[11]Kong B H,Xiong Y L.Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action[J].Journal of Agriculture and Food Chemistry,2006,54:6059-6068.
[12]Lertittikul W,Benjakul S,Tanaka M.Characteristics and antioxidative activity of maillard reaction products form a porcine plasma protein-glucose model system as influenced by pH[J].Food Chemistry,2007,100:669-677.
[13]Peña-Ramos E A,Xiong Y L.Whey and soy protein hydrolysates inhibit lipid oxidation in cooked pork pattie[J].Meat Science,2003,64:259-563.
[14]Sakanaka S,Tachibana Y,Ishihara N,et al.Antioxidant activity of egg-yolk protein hydrolysates in a linoleic acid oxidation system[J].Food Chemistry,2004,86:99-103.
[15]Jao C L,Ko W C.1,1-Diphenyl-2-picrylhydrazyl(DPPH)radical scavenging by protein hydrolysates from tuna cooking juice[J].Fisheries Science,2002,68:430-435.
[16]Sathivel S,Bechtel P J,Babbitt J,et al.Biochemical and functional properties of herring(Clupea harengus)byproduct hydrolysates[J].Journal of Food Science,2003,68:2196-2200.
[17]Wu H C,Chen H M,Shiau C Y.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus)[J].Food Research International,2003,36:949-957.
[18]Amarowicz R,Shahidi F.Antioxidant activity of peptide fractions of capelin protein hydrolysates[J].Food Chemistry,1997,58:355-359.
[19]Liu Q,Kong B H,Xiong Y L,et al.Antioxidant activity and functi-onal properties of porcine plasma protein hydrolysate as influenced by the degree of hydrolysis[J].Food Chemistry,2009,56:237-241.
[20]Alder-Nissen J.Enzymic hydrolysis of food proteins[M].New York:Elsevier Applied Science,1986.
[21]Decker E A,Hultin H O.Factors influencing catalysis of lipid oxidation by the soluble fraction of mackerel muscle[J].Journal of Food Science,1990,55:947-950,953.
[22]Sinnhuber R O,Yu T C.2-thiobarbituric acid method for the measurement of rancidity in fishery productsⅡThe quantitative determination of malonaldehyde[J].Food Technology,1958(12):9-12.
[23]Benzie I F F,Strain J J.The ferric reducing ability of plasma(FRAP)as a measure of“antioxidant power”:The FRAP assay[J].Analytical Biochemistry,1996,239:70-76.
[24]Kong B H,Xiong Y L.Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action[J].Journal of Agricultural and Food Chemistry,2006,54:6059-6068.
[25]Siddhuraju P,Becker K.The antioxidant and free radical scavenging activities of processed cowpea(Vigna unguiculata(L.)Walp.)seed extracts[J].Food Chemistry,2007,101:10-19.
[26]Kawashima K,Itoh H,Miyoshi M,etal.Antioxidant properties of branched-chain amino acid derivatives[J].Chemical and Pharmaceutical Bulletin,1979,27:1912-1916.
[27]Peña-Ramos E A,Xiong Y L,Arteaga G E.Fractionation and characterization for antioxidant activity of hydrolyzed whey protein[J].Journal of the Science of Food and Agriculture,2004,84(14):1908-1918.
