鹿茸水提取物及其蛋白酶解物对小鼠脾淋巴细胞增殖的影响
2011-07-06王成涛籍保平
赵 磊, 王成涛, 籍保平
鹿茸是我国有史记载以来的名贵动物药之一,与人参、冬虫夏草并列为三大补品,在国内外享有很高声誉.鹿茸做为保健品,具有生精补髓、养血益阳、强筋健骨、延年益寿等功效.研究报道,鹿茸中主要含有蛋白质、肽类、氨基酸、磷脂、糖类、固醇类、激素样物质、核酸、多胺及各种无机物质[1-2].
鹿茸水提取物是鹿茸最为广泛的服用形式之一[3].研究报道,鹿茸水提取物有着较好的免疫调节作用.金光湖等[4]报道鹿茸水提取物可增强迟发性免疫反应,并可增加脾细胞中玫瑰花结细胞的数量,同时可显著提高绵羊红细胞的凝集素值和溶血素值,对细胞免疫功能和体液免疫功能有促进作用.然而,韩国学者[5-6]在研究鹿茸水提取物对Ⅱ型胶原诱导的关节炎大鼠的作用时,发现鹿茸水提取物具有免疫抑制作用.Kim等[6]报道鹿茸水提取物体外可以抑制抗原刺激的T细胞活化,并在高浓度下能够降低巨噬细胞的吞噬作用.可见,鹿茸对免疫系统可能具有双向调节作用,从而使人体内环境达到稳定状态.我们前期研究发现,鹿茸水提取物在模拟胃肠消化过程中,随着蛋白质逐渐酶解,其对小鼠脾细胞增殖的促进作用消失,对ConA诱导的小鼠脾T淋巴细胞增殖的抑制作用增强[7],但具体原因还有待进一步阐明.
本研究报道了鹿茸水提取物中非蛋白成分(AEVA-S)、粗蛋白酶解物及分离组分对小鼠脾淋巴细胞增殖作用的影响,并进行了初步鉴定,旨在探讨其免疫调节活性及功能成分,为进一步的开发利用提供一定的理论依据.
1 材料与方法
1.1 材料与仪器
马鹿茸冻干超微粉,东北大兴安岭区科技局;SPF级Balb/c小鼠(合格证号:SCXK-(军)2007-004),6~8周龄,雄性,中国人民解放军军事医学科学院实验动物中心;胃蛋白酶、胰酶、碱性蛋白酶、刀豆蛋白 A(ConA),美国 Sigma化学公司;RPMI-1640高糖培养基,美国Gibico公司;青链霉素混合液、红细胞裂解液、CCK-8试剂盒、Hepes,碧云天生物技术研究所;胎牛血清,杭州四季青生物工程材料有限公司;超滤管,德国Sartorius公司;其他试剂均为国产分析纯.
LGJ-18型冷冻干燥机,军事医学科学院实验仪器厂;XDOS-1B型倒置显微镜,重庆光电有限公司;SW-CJ-2FD型双人单面净化工作台,苏州净化设备有限公司;MCO-20AIC型二氧化碳培养箱,日本Sanyo公司;Multiskan MK3型自动酶标仪,美国Thermo公司;TGL-20M型高速台式冷冻离心机,湘仪离心机厂;SHIMADZU LC-10A型高效液相色谱仪,日本岛津公司.
1.2 实验方法
1.2.1 鹿茸水提取物非蛋白成分及粗蛋白的制备
根据有机溶剂沉淀法[8],略做调整,将AEVA-S和粗蛋白进行分离.向鹿茸水提取物的水溶液中缓慢加入无水乙醇,使乙醇终体积分数达到75%,4℃静置过夜.将悬浮液以12 000 r·min-1的转速离心20 min,沉淀物用75%乙醇洗涤.上清液和沉淀物分别进行冷冻干燥,得到AEVA-S和粗蛋白,冷冻干燥物粉末于4℃保存备用.
1.2.2 鹿茸水提取物非蛋白成分分离组分的制备[9]
采用半制备RP-HPLC技术对AEVA-S进行分离,得到AEVA-S(Ⅰ~Ⅴ)的半制备HPLC图谱,见图1.色谱条件:色谱柱采用Kromasil C18(10×250 mm,5μm),流动相A为0.1%TFA水溶液,流动相B为0.1%TFA乙腈溶液,流速为3 mL/min,检测波长为260 nm,洗脱梯度为0~5%A,0~30 min;5% ~50%A,30~40 min;50%A,40~50 min.
1.2.3 鹿茸水提取物粗蛋白酶解物及其分离组分的制备
采用蛋白酶水解鹿茸水提取物粗蛋白6 h,制备不同的蛋白酶酶解物.鹿茸水提取物中粗蛋白以50 g/L的质量浓度溶于蒸馏水中,调节反应温度、pH值,加入一定量的蛋白酶进行水解.水解过程中通过不断加入1 mol/L NaOH或HCl来保持pH值不变,并保持温度恒定.胃蛋白酶、胰酶及碱性蛋白酶的反应条件见图2.
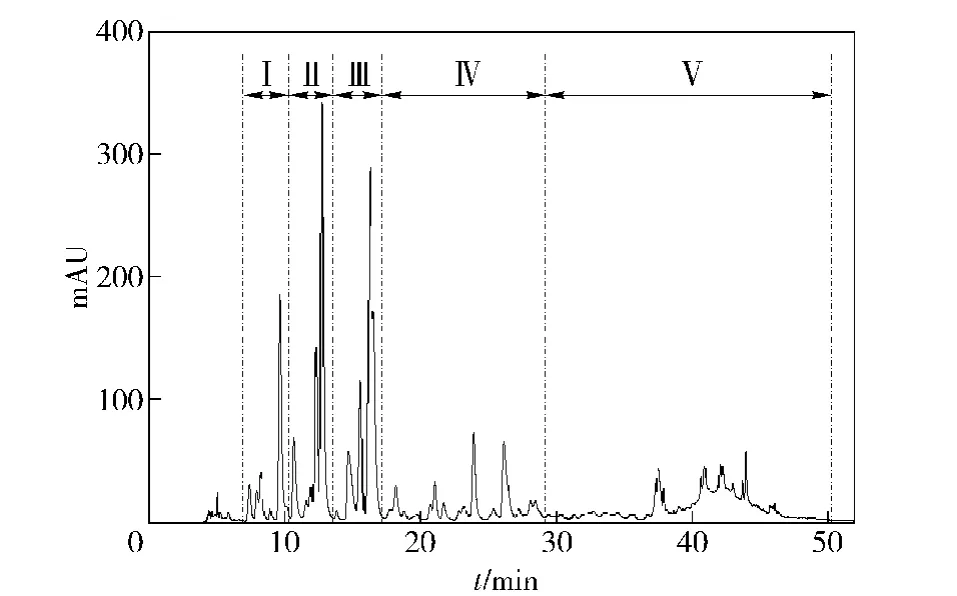
图1 鹿茸水提取物中非蛋白成分的半制备HPLC图谱Fig.1 Semi-preparative HPLC chromatogram at 260 nm of AEVA-S.

图2 鹿茸水提取物的不同粗蛋白酶解物的制备流程Fig.2 Flow chart for the preparation of AEVA crude protein hydrolysates
采用超滤法对酶解产物进行分离,称取一定量鹿茸水提取物粗蛋白的不同酶解产物,选用截留分子量为10,5,3 kDa的超滤膜分别超滤,将超滤后不同分子量范围的酶解产物分别收集并冷冻干燥.
1.2.4 小鼠脾细胞悬液的制备
将小鼠(Balb/c)拉颈处死,无菌分离完整脾脏,用PBS冲去浮血,剥除结缔组织及脂肪成分.脾组织剪碎后置于小烧杯上的200目不锈钢滤网上,用注射器针芯研磨,PBS液洗涤,用吸管收集冲洗液至离心管,1 200 r/min离心5 min,弃上清液,加入3 mL红细胞裂解液,静置2 min,加入10 mL PBS终止反应,1 200 r/min离心5 min,弃上清液.用PBS液洗两次,不完全RPMI-1640洗一次,加适量RPMI-1640完全培养基(含10%胎牛血清、100 U/mL青霉素、100μg/mL链霉素、10 mM Hepes)重悬细胞.调整浓度至2×106个细胞/mL,台盼兰染色测细胞存活率大于95%.
1.2.5 脾淋巴细胞增殖实验
将脾细胞悬液按100μL/孔加入到96孔培养板中,再添加10μL ConA(终质量浓度为5μg/mL)或不添加ConA,10μL样品溶液,每个处理设6个复孔.同时做正常对照组和ConA对照组,正常对照组为100μL脾细胞悬液,ConA对照组是在100μL细胞悬液中添加10μL ConA(终质量浓度为5μg/mL).然后将培养板置于37℃、5%CO2的培养箱中培养72 h.
1.2.6 细胞增殖程度的测定及计算分析
选用CCK-8试剂盒测定细胞增殖程度.结果用刺激指数(Simulation index,SI)表示,计算如下:

1.2.7 液质联用分析
HPLC条件:Agilent ZORBAX SB-C18(4.6 mm×250 mm,5μm);流速0.8 mL/min,检测波长260 nm,柱温30℃;流动相A相:0.05%甲酸水溶液,B相:0.05%甲酸乙腈溶液.梯度洗脱条件:(1)AEVA-SⅢ:0~5%A,0~30 min;(2)AEVA-SⅣ:0~5%A,0~30 min;5%~50%A,30~40 min;50%A,40~48 min.
质谱条件:microTOF-QⅡ四级杆飞行时间串联质谱仪.电喷雾离子源(ESI)喷射电压为4.5 kV;正离子模式;喷雾压力为0.6 bar;干燥气(N2)流速为7 L/min,温度为180℃;离子扫描范围为50~1 000 m/z.
1.3 统计分析
每个实验重复6次,结果以均值±标准偏差(Mean±S.D.)表示,采用组间t检验,P<0.05具有显著性差异,P<0.01具有极显著性差异.
2 结果与讨论
2.1 鹿茸水提取物中非蛋白成分及其分离组分免疫调节功能的研究
本研究通过体外各分离组分对小鼠脾细胞增殖的影响来评价其免疫调节作用.各分离组分对小鼠脾细胞增殖的影响见图3.结果表明,低、高浓度的AEVA-S单独作用均可显著促进小鼠脾细胞增殖,SI值分别为1.05±0.03和1.13±0.02,与空白对照组相比增长了5%(P<0.05)和13%(P<0.01).低、高剂量的AEVA-S(Ⅰ,Ⅱ,Ⅳ,Ⅴ)本身均对小鼠脾细胞增殖无影响.高剂量的AEVA-SⅢ本身对小鼠脾细胞增殖有明显的抑制作用(P<0.05),抑制率为4.5%.推测AEVA-S本身对小鼠脾细胞增殖的促进作用是其各分离组分协同作用的结果.

图3 非蛋白分离组分对小鼠脾细胞增殖活性的影响Fig.3 Effects of separated fractions from AEVA-Son the proliferation of murine splenocytes
由图3可知,低、高浓度的AEVA-S,SⅠ,SⅡ均对ConA诱导的小鼠脾细胞增殖无影响.然而,低、高浓度的 AEVA-SⅢ和AEVA-SⅣ可显著抑制ConA诱导的小鼠脾细胞增殖,尤以高浓度时最为明显.在高浓度时(200μg/mL),AEVA-SⅢ和AEVASⅣ对ConA诱导的小鼠脾细胞增殖抑制率分别达到了58.4%和36.5%.高浓度的AEVA-SⅢ对ConA诱导的小鼠脾细胞增殖的高抑制率与其本身具有脾细胞毒性有关.此外,AEVA-SV在低剂量时对ConA诱导的小鼠脾细胞增殖无影响,而在高剂量时对ConA诱导的小鼠脾细胞增殖有轻微的抑制作用.
ConA是T淋巴细胞的有丝分裂原,可促进T淋巴细胞活化,进而使细胞产生细胞因子合成、细胞因子受体表达、细胞分化及细胞增殖等变化.T淋巴细胞是一类胸腺依赖型淋巴细胞,是血液和再生循环中的主要淋巴细胞,它在接受抗原刺激后可以发生特异性免疫应答.T淋巴细胞介导的细胞免疫应答主要针对细胞内微生物的感染,也参与Ⅳ型超敏反应、移植排斥反应和某些自身免疫疾病的发生发展.机体内T淋巴细胞的数量越大,增殖活性越高,机体由T淋巴细胞介导的细胞免疫功能越强[10].
绝大多数研究表明,在加入样品的同时加入ConA,样品的免疫调节活性较大.本研究结果显示,鹿茸水提取物非蛋白分离组分——AEVA-SⅢ或AEVA-SⅣ与ConA同时加入,淋巴细胞增殖受到强烈抑制.Barta等[11]报道将乳清蛋白制剂与丝裂原同时加入淋巴细胞培养基时,淋巴细胞增殖被抑制,而将丝裂原与淋巴细胞共同孵育一定时间后再加入乳清制剂,则其对淋巴细胞增殖的抑制作用变得不明显.发生该现象的机理有待进一步探讨,推测是由于样品影响了小鼠淋巴细胞对ConA的敏感性或是由于样品预先与小鼠脾细胞膜上的ConA受体相结合,影响了ConA与小鼠脾细胞间的作用,使信号转导途径中断,甚至根本不能形成,从而抑制了细胞的活化和增殖.后续实验可采取先加样品再加ConA的顺序,来验证AEVA-SⅢ和AEVA-SⅣ对ConA诱导的小鼠脾细胞增殖的抑制作用.
2.2 AEVA-SⅢ和AEVA-SⅣ成分的初步鉴定
AEVA-SⅢ和AEVA-SⅣ的 HPLC-ESI-HRMS分析见表1.结合已报道鹿茸中存在的成分[1]以及质谱结果,初步鉴定AEVA-SⅢ中主要含有8种化合物,分别为:鸟嘌呤、胞苷、黄嘌呤、尿苷、3′-AMP、2′-AMP 、3′-GMP 和 2′-GMP;初步鉴定 AEVA-SⅣ中主要含有5种化合物,分别为:腺嘌呤、肌苷、鸟苷、环磷酸腺苷和环磷酸鸟苷.
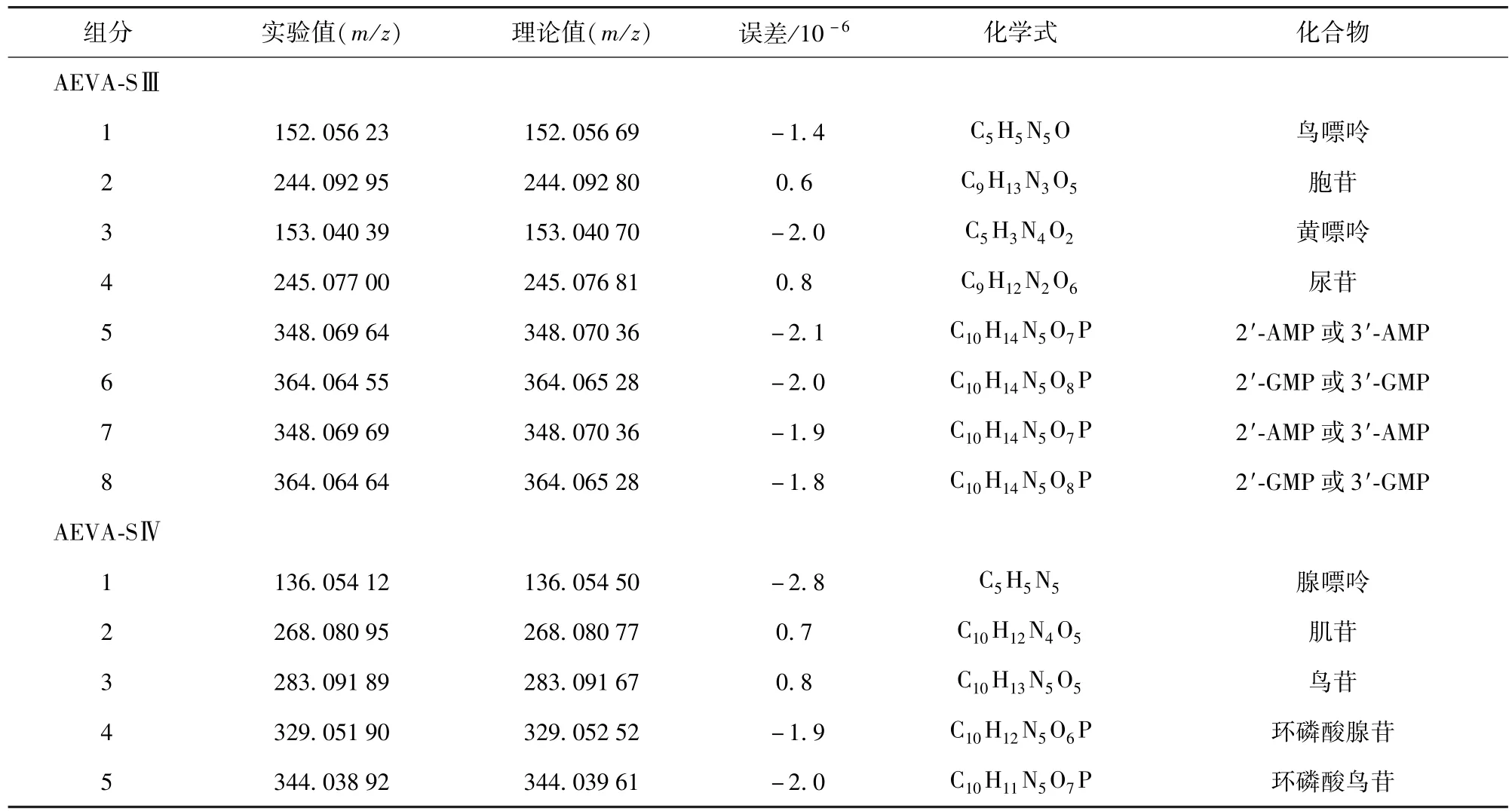
表1 AEVA-SⅢ和AEVA-SⅣ主要成分的正离子HRMS分析Tab.1 Positive ion HRMSanalysis of main compounds in AEVA-SⅢ and AEVA-SⅣ
2.3 不同酶解产物免疫调节功能的比较
分别选取100μg/mL和500μg/mL两个质量浓度,测定3种酶解产物对小鼠脾细胞增殖的影响,结果如图4.在100μg/mL的质量浓度下,3种酶解产物单独均不能刺激小鼠脾细胞增殖.质量浓度为500μg/mL时,碱性蛋白酶酶解物单独均可刺激小鼠脾细胞增殖,并有显著性差异(P<0.05).在低浓度和高浓度的条件下,3种酶解产物均可以抑制ConA诱导的小鼠T淋巴细胞增殖,抑制程度有所不同,且存在一定的量效关系.在低浓度下,对ConA诱导的小鼠T淋巴细胞增殖的抑制程度相对于高浓度时较低.在3种酶解产物中,碱性蛋白酶酶解物对ConA诱导的小鼠T淋巴细胞增殖的抑制程度远低于其他两种酶解产物.
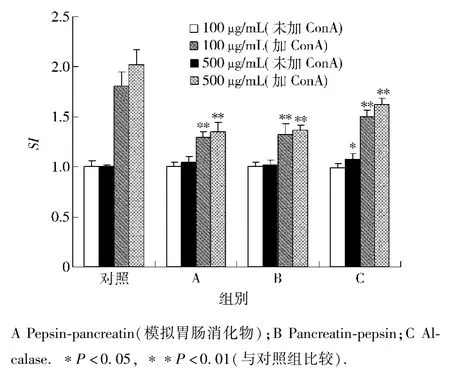
图4 鹿茸水提取物粗蛋白酶解物对小鼠脾细胞增殖活性的影响Fig.4 Effect of AEVA crude protein hydrolysates on the proliferation of murine splenocytes
同种蛋白不同酶解物的免疫调节活性差别取决于水解用酶的种类[12].肽的氨基酸组成、数量和序列对免疫活性也有重要影响,较强的疏水作用可能促使免疫活性肽与细胞膜相互作用而增强其免疫活性[13]. 疏水性氨基酸有 Tyr、Trp、Phe、Val、Leu、Ile、Pro和Ala.疏水性氨基酸在酶和基质、抗体和抗原间的相互作用等各种非共价键的分子结合方面,具有重要作用.碱性蛋白酶和中性蛋白酶可为制备出肽链末端具有疏水性氨基酸的小肽提供先决条件.
2.4 不同酶解产物分子量分布的比较
采用超滤法分析3种蛋白酶酶解产物中大于10 kDa、5~10 kDa、3~5 kDa及小于3 kDa肽段的分子量分布,见图5.数据表明,3种蛋白酶酶解物中主要由5~10 kDa及3 kDa以下肽组成,分别占总组成的30%以上.各蛋白酶解物以模拟胃肠消化物中大分子肽段含量最高,10 kDa以上肽段占总量的23.07%;而碱性蛋白酶水解物中10 kDa以上肽段仅占总量的5.3%,小分子肽段(<5 kDa)达到了总量的62.5%.改变酶的水解顺序也可影响酶解物的分子量分布.与模拟胃肠消化物相比,胰酶-胃蛋白酶酶解物中的大分子肽段(>5 kDa)含量减少,同时小分子肽段(<5 kDa)含量增加.在相同的时间内(6 h),碱性蛋白酶对鹿茸水提取物中粗蛋白水解程度最大.
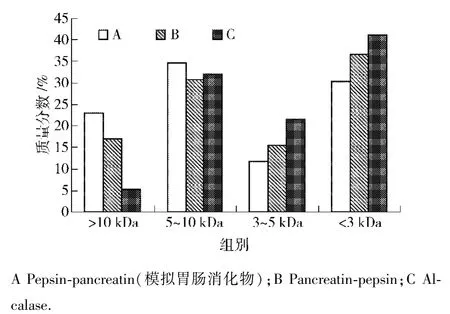
图5 鹿茸水提取物粗蛋白酶解物相对分子量分布Fig.5 Molecular size distribution of AEVA crude protein hydrolysates
2.5 不同分子量范围肽段免疫调节活性研究
不同分子量范围肽段 1(MW >10 kDa)、2(MW:5~10 kDa)、3(MW:3~5 kDa)和4(MW <3 kDa)对小鼠脾细胞增殖活性的影响见图6.研究结果表明,不同分子量范围肽段1,2,3和4单独对小鼠脾细胞增殖的影响不同.分子量>10 kDa的肽段在高、低浓度下单独均能刺激小鼠脾细胞增殖,呈现丝裂原作用;其他分子量范围肽段(2,3和4,除B4外)单独对小鼠脾细胞增殖均无影响.这与Mercier和Diane等的研究结果一致,Mercier等[13]和Diane等[14]在小鼠脾细胞的体外培养体系中发现,分子量大于10 kDa的乳清蛋白和分子量小于2 kDa的酶解肽类,均能够明显促进脾细胞的增殖,且这种作用呈现剂量依赖性.胰酶-胃蛋白酶联合酶解物中B4(分子量<3 kDa的肽段)单独亦对小鼠脾细胞增殖有促进作用,这可能与肽的氨基酸组成有关.
不同酶解物中不同分子量肽段对ConA诱导的小鼠脾T淋巴细胞增殖的影响不同.图6(a)显示了模拟胃肠消化物中不同分子量肽段对ConA诱导的小鼠脾T淋巴细胞增殖的影响.A1(分子量>10 kDa的肽段)在高、低浓度下均能够抑制ConA诱导的小鼠脾T淋巴细胞增殖,并有显著性差异.其他分子量肽段(A2,A3和A4)对ConA诱导的小鼠脾T淋巴细胞增殖无影响.
图6(b)显示了胰酶-胃蛋白酶联合酶解物中不同分子量肽段对ConA诱导的小鼠脾T淋巴细胞增殖的影响.结果表明,B1和B4(分子量>10 kDa和<3 kDa的肽段)在高、低浓度下均能够抑制ConA诱导的小鼠脾T淋巴细胞增殖,并有显著性差异.B2和B3(分子量在5~10 kDa、3~5 kDa的肽段)对ConA诱导的小鼠脾T淋巴细胞增殖无影响.
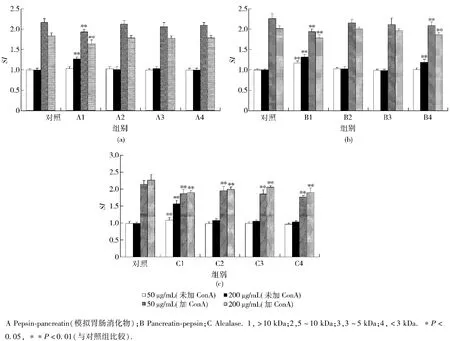
图6 鹿茸水提取物粗蛋白酶解物中不同分子量肽段对小鼠脾细胞增殖的影响Fig.6 Effect of peptide fractions with different MW from AEVA crude protein hydrolysates on the proliferation of murine splenocytes
此外,碱性蛋白酶酶解物中不同分子量肽段对ConA诱导的小鼠脾T淋巴细胞增殖的影响见图6(c).我们发现,C1,C2,C3和C4在高、低浓度下均能够抑制ConA诱导的小鼠脾T淋巴细胞增殖,并有显著性差异.造成这种现象的原因有:1)肽段影响了小鼠脾淋巴细胞对ConA的敏感性;2)酶解产物预先与小鼠脾淋巴细胞膜上的ConA受体结合,影响了ConA与小鼠脾淋巴细胞间的作用,使信号转导途径中断,从而抑制了细胞的活化和增殖.发生该种现象的机理有待进一步探讨.
上述结果表明,肽段的分子量是影响小鼠脾细胞增殖的主要因素之一.此外,酶解选用酶的种类也是重要影响因素.不同蛋白酶的底物特异性不同,酶切位点各异,酶的选择影响了蛋白酶解物中肽段的分子量大小及氨基酸组成,从而导致的酶解产物免疫活性的差异.总的来说,鹿茸蛋白酶解物中大分子量肽段(>10 kDa)对小鼠脾细胞的免疫活性影响最大.在有或无有丝分裂原存在时,酶解产物对脾淋巴细胞的作用差异机制还有待探讨.酶解过程中释放出的生物活性肽的氨基酸组成和肽序还需进一步研究.
3 结 论
本研究主要针对鹿茸水提取物,将其分为大分子蛋白和小分子非蛋白成分进行研究.以提高蛋白质功能活性为目的,采用多种蛋白酶对粗蛋白进行酶解.非蛋白成分和粗蛋白酶解物分别采用HPLC和超滤法进行分离,并研究各分离组分对小鼠脾细胞增殖作用的影响,初步评价其免疫调节活性.结果表明,鹿茸水提取物非蛋白成分对未经丝裂原诱导的小鼠脾细胞增殖的促进作用优于其分离组分,对ConA诱导的小鼠脾T淋巴细胞增殖无影响.Fr.Ⅲ和Ⅳ对ConA诱导的T淋巴细胞增殖有抑制作用,初步鉴定均为碱基和核苷酸的混合物.分子量大于10 kDa的肽段,单独可刺激小鼠脾细胞增殖,且对ConA诱导的T淋巴细胞增殖有抑制作用.分子量小于10 kDa的肽段,单独对小鼠脾细胞增殖无影响,对ConA诱导的T淋巴细胞增殖的抑制作用不同,但总体相对较弱.肽段分子量大小对蛋白质酶解物的免疫调节活性影响较大,但并没有呈现直接的相关性.肽的氨基酸组成、序列及构型等等也是影响其活性的重要因素.
[1] 范玉林.鹿茸化学成分研究概述[J].吉林农业大学学报,1980(1):72--78.
[2] 郑虎占,董泽宏,余靖.中药现代研究与应用[M].北京:学苑出版社,2003:5055--5056.
[3] 巩振东,李翠娟,赵景军.鹿茸——走进中药[M].北京:北京科学技术出版社,2004:41--51.
[4] 金光湖,崔平洛.鹿茸对氨甲喋呤引发的免疫功能低下的影响[J].黑龙江中医药,1993(2):40--42.
[5] Kang K S,Kim K S,Kim SI,et al.Immunosuppressive activity of deer antler extracts of Cervus korean TEMMINCK var.mantchuricus Swinhoe,on typeⅡcollageninduced arthritis in rats[J].In Vitro Cellular and Developmental Biology-Animal,2006,42(3/4):100--107.
[6] Kim Y K,Kim K S,Chung K H,et al.Inhibitory effects of deer antler aqua-acupuncture,the pilose antler of Cervus korean TEMMINCK var.mantchuricus Swinhoe,on typeⅡcollagen-induced arthritis in rats[J].International Immunopharmacology,2003(3):1001--1010.
[7] Zhao L,Ji B P,Li B,et al.Immunomodulatory effects of aqueous extract of velvet antler(Cervus elaphus Linnaeus)and its simulated gastrointestinal digests on immune cells in vitro[J].Journal of Food and Drug Analysis,2009,17(4):282--292.
[8] 李校堃,袁辉.药物蛋白质分离纯化技术[M].北京:化学工业出版社,2005:45--46.
[9] Zhao L,Pei R S,Ji B P,et al.Antioxidant activity of aqueous extract fractions of velvet antler(Cervus elaphus Linnaeus)[J].Journal of Food and Drug Analysis,2010,18(5):319--327.
[10] 朱力平,陈学清.免疫学常用试验方法[M].北京:人民军医出版社,2000:151--190.
[11] Barta O,Barta V D,Crisman M V,et al.Inhibition of lymphocyte blastogenesis by whey[J].American Journal of Veterinary Research,1991,52:247--253.
[12] Otani H,Monnai M.Inhibition of proliferative responses of mouse spleen lymphocytes by bovine milk kappa-casein digests[J].Food and Agricultural Immunology,1993(5):219--229.
[13] Mercier A,Gauthier S F,Fliss I.Immunomodulating effects of whey proteins and their enzymatic digests[J].International Dairy Journal,2004,14:175--183.
[14] Diane S,Sylvie F G,Yvan B,et al.Immunomodulating properties of a whey protein isolate,its enzymatic digest and peptide fractions[J].International Dairy Journal,2008,18:260--270.
