温度对莲草直胸跳甲成虫繁殖特性和卵孵化的影响
2011-07-05傅建炜郭建英李赞斌史梦竹李建宇万方浩福建省农业科学院植物保护研究所福建福州500中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室北京009河北科技师范学院生命科技学院河北秦皇岛066004
傅建炜,郭建英,李赞斌,史梦竹,李建宇,万方浩福建省农业科学院植物保护研究所,福建福州500;中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 009;河北科技师范学院生命科技学院,河北秦皇岛 066004
喜旱莲子草Alternanthera philoxeroides(Mart.)Griseb.属苋科 Amaranthaceae莲子草属AlternantheraForsk.,又名空心莲子草、水花生、革命草,英文名alligator weed,是多年生宿根草本植物(刁正俗,1990)。其原产于南美洲巴西,是一种世界性恶性杂草(Coulson,1977;林冠伦等,1988)。20世纪30年代末被用作养马饲料引至我国上海郊区栽培,后来在我国南方一些省市作为猪羊饲料草种植(王韧和王远,1988a)。现已广泛传播至华东、华中、华南和西南等地区,其中以长江中下游地区发生面积广,危害程度高,对种植、水产、水利、航运、物种资源、环境等均造成极为不利的影响,成为我国亟待防除的重要外来恶性杂草之一(王韧和王远,1988a、1988b;马瑞燕,2008)。
莲草直胸跳甲Agasicles hygrophilaSelman and Vogt属鞘翅目Coleoptera叶甲科Chrysomelidae,又名曲纹叶甲、水花生叶甲,原产于阿根廷,对喜旱莲子草的取食及抑制作用明显,是喜旱莲子草的有效天敌(Spencer& Coulson,1976;王韧等,1987;林冠伦等,1988),并具有取食喜旱莲子草的寄主专一性(王韧等,1987;吴珍泉等,1994a)。国内外对莲草直胸跳甲的发育和繁殖生物学特性的研究较多(Stewartet al.,1999a、1999b、2000;吴浪明等,2000;赵鑫等,2009)。就莲草直胸跳甲的应用而言,目前通常采用田间少量释放,待种群达到一定数量时再移殖扩散的方法。由于田间温度变化幅度较大,莲草直胸跳甲的发育和繁殖适合度会受其影响。在室内控温条件下大量繁殖莲草直胸跳甲,然后加以人工助增释放,可以克服其在田间自然繁殖的不利因素。本文研究莲草直胸跳甲成虫在25~35℃的存活、取食和产卵特性,及莲草直胸跳甲卵在15℃下冷藏不同时间对其孵化率的影响,以期为确定人工繁殖莲草直胸跳甲的温度条件、田间释放的适宜时期及卵的低温保存条件等生防实践提供依据。
1 材料与方法
1.1 供试昆虫与植物
喜旱莲子草,栽培于福建省农业科学院植物保护研究所南通中试基地的大棚内。部分移栽于长方形塑料盆(45 cm×35 cm×15 cm)的腐殖质土壤中,每盆45~50株,每周浇水2次以保持适度的土壤湿度,待植株长至20~30 cm时取顶端5~6节的茎秆供试。
莲草直胸跳甲,2009年5月采自基地附近的池塘,饲养于该基地的人工气候室内[(25±1)℃,RH85% ±5%,12 h光照],以上述盆栽喜旱莲子草饲养3代,分别取初产卵和初羽化成虫供试。
1.2 试验方法
1.2.1 温度对莲草直胸跳甲成虫取食与繁殖特性的影响 将吸足水的花泥放入塑料盒(19 cm×12 cm×8 cm)底部,在花泥上插入5株新鲜的、叶片完整的、长约7 cm的喜旱莲子草植株,接入10对莲草直胸跳甲成虫。此后,每天更换新鲜的寄主植物茎秆,记录跳甲死亡数和产卵量,并用透明坐标纸标记寄主植物的被取食面积。然后从同批次喜旱莲子草中随机打取10块1 cm2叶片,用电子天平(型号AB204-S,Mettler Toledo,Switzerland)称重,计算单位叶面积的平均重量,据此将跳甲取食的喜旱莲子草面积换算成其取食量。观察至跳甲成虫全部死亡为止,期间适时向花泥内补水以保持湿度。设5个温度处理,分别为25、27、30、32、35 ℃,温度变幅均为±0.5℃,每个处理重复3次。试验在智能人工气候箱(型号PRX-450D,宁波海曙赛福实验仪器厂)中进行,均设置为RH85% ±5%、12 h光照,光照度为额定光照度的60%(18000 lx)。
1.2.2 短期低温保存对莲草直胸跳甲卵孵化的影响 在底部铺有滤纸保湿的塑料盒(19 cm×12 cm×8 cm)内,放入15片产有莲草直胸跳甲卵块(12 h)的喜旱莲子草叶片,卵面朝上,塑料盒加盖(盖上均匀扎8个小洞以保持通气)并置于(15±0.5)℃的人工气候箱内。分别冷藏1、4、7、10 d后取出,置于(25±0.5)℃的人工气候箱内,逐日观察、记录每个卵块的总卵数、孵化数和孵化日期,直至卵块全部孵化为止,期间适时用毛笔向滤纸补水保湿。以未经冷藏的卵作为对照。共5个处理,每个处理观察480~510粒卵。
1.3 试验设计与分析方法
取食量数据未经转换,产卵量数据经平方根转换(square root transformation)后,经 Bartlett's test检验(Sokal&Rohlf,1995),均符合正态分布和方差齐性(数据略)。因此,采用单因素方差分析(one-way ANOVA:LSD)进行分析。采用二元变量相关分析(Pearson相关)进行成虫期取食量和产卵量的分析。采用Kolmogorov-Smirnor test分析雌雄成虫的生存曲线数据(Pyke&Thompson,1986;Sokal&Rohlf,1995)。以上数据分析采用统计分析软件SPSS11.0 和 Excel进行。
2 结果与分析
2.1 温度对莲草直胸跳甲成虫存活率的影响
在25~35℃,莲草直胸跳甲成虫的生存曲线差异显著,随着温度的升高,雌雄成虫寿命呈缩短趋势(图1~2)。雌成虫存活率表现为25℃ >32℃ >35℃ (Kolmogorov-Smirnov test,D25℃&32℃=0.367 >D0.05,29=0.357,D32℃&35℃=0.500 >D0.05,23=0.400);27和30℃的生存曲线与25℃差异不显著(D25℃&27℃=0.267 <D0.05,29=0.357,D25℃&30℃=0.233 <D0.05,29=0.357),与 32 ℃ 差 异 也不显著(D27℃&32℃=0.267 <D0.05,26=0.377,D30℃&32℃=0.233 <D0.05,27=0.370)(图 1)。雄成虫存活率也表现为25℃ >32℃ >35℃ (Kolmogorov-Smirnov test,D25℃&32℃=0.400 >D0.05,31=0.345,D32℃&35℃=0.433 >D0.05,24=0.392);27 和30 ℃的生存曲线与25℃差异不显著(D25℃&27℃=0.3007 <D0.05,31=0.345,D25℃&30℃=0.333 <D0.05,31=0.345),与 32 ℃差异也不 显 著 (D27℃&32℃=0.267 <D0.05,27=0.370,D30℃&32℃=0.300 <D0.05,26=0.377)(图 2)。

图1 温度对莲草直胸跳甲雌成虫存活率的影响Fig.1 Effects of temperature on the survivorship in adult females of A.hygrophila

图2 温度对莲草直胸跳甲雄成虫存活率的影响Fig.2 Effects of temperature on the survivorship in adult males of A.hygrophila
2.2 温度对莲草直胸跳甲成虫取食量和产卵量的影响
温度对莲草直胸跳甲成虫的取食量和产卵量均有显著影响,在25~35℃,随着温度的升高,跳甲的取食量和产卵量呈下降趋势(表1)。25、27和30℃时跳甲的日均取食量显著高于32和35℃;成虫期取食量表现为25℃ >27℃、30℃ >32℃ >35℃;其中,35℃下的日均取食量为25℃的50.4%,世代取食量仅为25℃的18.8%;日均取食量和成虫期取食量的变化趋势略有不同,这与成虫寿命随着温度增高而显著缩短(图1~2)有关。日均产卵量和世代产卵量表现为25℃ >27℃、30℃ >32℃>35℃,与成虫期取食量的变化趋势相同;其中,35℃下的日均产卵量仅为25℃的10.4%,世代产卵量仅为25℃的4.1%。相关分析表明,莲草直胸跳甲成虫期取食量和世代产卵量呈显著正相关,相关系数r=0.960(n=15,P<0.001)。这可能是因为产卵的生理过程需要消耗巨大的能量,跳甲需要通过取食叶片为产卵储备大量的营养物质。

表1 温度对莲草直胸跳甲成虫取食量和产卵量的影响Table 1 Effects of temperature on the leaf consumption and fecundity of A.hygrophila adults
2.3 15℃低温保存对莲草直胸跳甲卵孵化的影响
将莲草直胸跳甲卵在15℃下冷藏1~10 d后转移至25℃,其孵化率均可达100%,但孵化进度则有差异,孵化高峰期随着冷藏时间的延长而提前(表2)。与对照相比,在15℃下冷藏1 d,莲草直胸跳甲卵的始孵化日提前1 d,但高峰期不变;在15℃下冷藏4、7、10 d后,其孵化高峰期分别在第4天、第3天、第2天,分别较对照提前1、2、3 d。
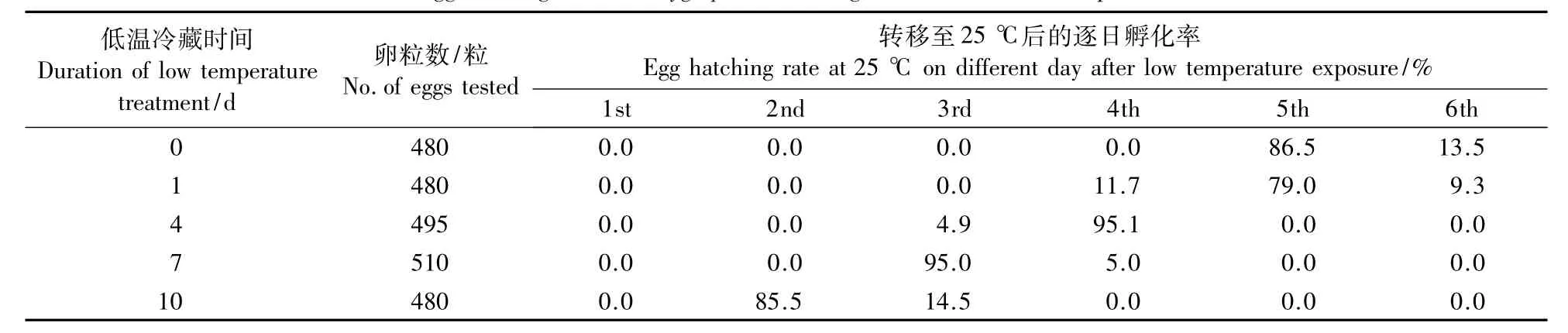
表2 15℃低温冷藏不同时间莲草直胸跳甲卵的孵化率Table 2 Egg hatching rate of A.hygrophila following various durations of exposure at 15 ℃
3 讨论
利用莲草直胸跳甲防治喜旱莲子草,是一种针对性强、对环境无害、经济效益高的防治方法。人工饲养释放莲草直胸跳甲可以在一定程度上控制喜旱莲子草的大发生(吴珍泉等,1994b)。由于莲草直胸跳甲食性专一,冬季食料来源少,且该虫生活史中无滞育现象,因而有必要在寒冬季节对其进行室内大量繁殖饲养(吴珍泉和曾明星,1994)。研究莲草直胸跳甲成虫在不同温度条件下的存活、取食和产卵特性,探讨不同虫态的冷藏条件,对于确定其室内大量饲养条件具有重要意义。
昆虫是变温动物,温度可影响其体温变化和新陈代谢速度等,从而对昆虫的生殖、存活及行为活动产生影响(丁岩钦,1994)。Stewartet al.(1999a)对莲草直胸跳甲在15、20、25及30℃下繁殖特性的研究表明,20和25℃是其产卵和卵孵化的最适温度;其寿命随着温度的升高而缩短。本研究也表明,温度对莲草直胸跳甲成虫的存活、取食和产卵均有显著影响,在25~35℃,随着温度的升高,雌雄成虫寿命呈缩短趋势,取食量和产卵量表现为25℃ >27℃、30℃ >32℃ >35℃。因此,25℃是莲草直胸跳甲成虫存活、取食和产卵的最适宜温度,35℃则最不适合。此外,35℃下的世代产卵量仅为25℃的4.1%。这与莲草直胸跳甲田间种群在夏季骤然下降(7~8月,虫口数<2头·m-2,作者调查数据,未发表)的现象相吻合,可见,高温导致跳甲成虫产卵量骤减是其种群崩溃的重要原因之一。与Stewartet al.(1999a)的研究相比,本研究旨在比较莲草直胸跳甲在适温到高温条件下的繁殖特性,试验设置5个温度条件,温度梯度间隔2~3℃,旨在模拟跳甲在春夏季可能遭遇的田间环境条件;除了测定存活率和产卵量等指标外,还测定了跳甲成虫的取食量,指标更为全面;此外还得出跳甲的产卵量与其取食量呈显著正相关。这些对于根据田间环境温度确定适宜释放时期具有重要意义。
莲草直胸跳甲卵孵化的起点温度为13.3℃(Stewartet al.,1996)。将其在15 ℃下冷藏1~10 d,卵已发生一定程度的发育,因此,将卵冷藏后转移至25℃,其孵化进度产生差异,孵化高峰期随着冷藏时间的延长而提前。其中,在15℃下冷藏1 d,孵化高峰期与对照没有差异;冷藏4、7和10 d后,其孵化高峰期分别较对照提前1、2和3 d。但莲草直胸跳甲卵在15℃冷藏1~10 d,孵化率均可达100%。因此,在室内人工繁殖莲草直胸跳甲的过程中,可以通过卵的短期冷藏来分批次饲养,从而在规模化饲养的同时,调节和保持不同虫态的相对齐性。
本研究在温度相对恒定的室内进行,但自然界的温度通常在1 d内呈周期性变化,因此,模拟田间变温条件,对莲草直胸跳甲发育和繁殖特性的影响,尚有待深入研究。此外,本文仅测定了莲草直胸跳甲卵在15℃冷藏1~10 d对其孵化率的影响,对于莲草直胸跳甲的低温冷藏虫态、温度和适期等条件有待进一步筛选。
刁正俗.1990.中国水生杂草.重庆:重庆出版社.
丁岩钦.1994.昆虫数学生态学.北京:科学出版社.
林冠伦,孙进东,王远,王韧.1988.美国、澳大利亚空心莲子草的生物防治研究.生物防治通报,4(2):94-96.
马瑞燕.2008.第十章喜旱莲子草的生物防治∥万方浩,李保平,郭建英.生物入侵:生物防治篇.北京:科学出版社,216-242.
王韧,王远.1988a.我国南方水花生危害及生物防治调查.杂草学报,2(1):38 -40.
王韧,王远.1988b.我国南方水花生发生危害及生物防治可行性的调查论证.杂草科学,3(1):36-40.
王韧,王远,张格成,李继祥.1988.空心莲子草叶(虫甲)的寄主专一性测验.生物防治通报,4(1):14-17.
吴浪明,田世尧,王晓容,麦燕玲,陈荣溢.2000.广东莲草直胸跳甲生物学的观察.中国生物防治,16(3):144.
吴珍泉,蔡元呈,郭振铣,王天宝.1994a.空心莲子草叶甲寄主专一性测验.华东昆虫学报,3(2):98-100.
吴珍泉,蔡元呈,郭振铣,王天宝.1994b.利用野生空心莲子草繁殖空心莲子草叶甲.福建农业大学学报,23(4):421-425.
吴珍泉,曾明星.1994.空心莲子草叶甲Agasicles hygrophila(鞘翅目:叶甲科)发育速率的研究.武夷科学,11:37-42.
赵鑫,傅建炜,万方浩,郭建英,王进军.2009.短时高温暴露对莲草直胸跳甲生殖特性的影响.昆虫学报,52(10):1110-1114.
Coulson J R.1977.Biological control of alligatorweed 1959-1972:a review and evaluation.Technical Bulletin No.1547,98-100.
Pyke D A and Thompson J N.1986.Statistical analysis of survival and removal rate experiments.Ecology,67:240 -245.
Sokal R R and Rohlf F J.1995.Biometry.3rd ed.New York:W.H.Freeman and Company.
Spencer N R and Coulson J R.1976.The biological control of alligatorweed,Alternanthera philoxeroides.Aquatic Botany,2(3):177-190.
Stewart C A,Chapman R B,Barrington A M and Frampton C M A.1999a.Influence of temperature on adult longevity,oviposition and fertility ofAgasicles hygrophilaSelman&Vogt(Coleoptera:Chrysomelidae).New Zealand Journal of Zoology,26(3):191 -197.
Stewart C A,Chapman R B,Emberson R M,Syrett P and Frampton C M A.1999b.The effect of temperature on the development and survival ofAgasicles hygrophilaSelman&Vogt(Coleoptera:Chrysomelidae),a biological control agent for alligator weed(Alternanthera philoxeroides).New Zealand Journal of Zoology,26(1):11 -20.
Stewart C A,Chapman R B and Frampton C M A.2000.Growth ofalligatorweed [Alternantheraphiloxeroides(Mart.)Griseb.(Amaranthaceae)] and population development ofAgasicles hygrophilaSelman&Vogt(Coleoptera:Chrysomelidae)in northern New Zealand.Plant Protection Quarterly,15(3):95 -101.
Stewart C A,Emberson R M and Syrett P.1996.Temperature effects on the alligator weed flea-beetle,Agasicles hygrophila(Coleoptera:Chrysomelidae):implications for biological control in New Zealand∥Moran V C and Hoffman J H.Proceedings of the9th International Symposium on Biological Control of Weeds.South Africa:University of Cape Town,393-398.
