X线引导下放置植入式输液港在乳腺癌化疗中的应用
2011-06-12赵凤琴杨德启佟富中曹迎明刘宏军张嘉庆
程 琳 赵凤琴 杨德启 佟富中 曹迎明 刘宏军 张嘉庆
(北京大学人民医院乳腺中心,北京 100044)
乳腺癌是对化疗比较敏感的肿瘤,化疗在乳腺癌综合治疗中发挥着重要作用,但由于化疗患者需要频繁进行静脉输液,并且许多化疗药物血管毒性较大,容易引起静脉炎,直接影响患者接受化疗。因此建立可靠、方便、舒适的深静脉通路是重要临床课题。2006年 2月~2009年 12月,我中心共 65例需化疗的乳腺癌接受输液港植入术,建立了稳定、安全、舒适的深静脉输液通路。X线术中引导可提高输液港植入术手术精度,降低导管堵塞等风险。术中 X线引导下输液港植入可作为建立乳腺癌化疗深静脉通路的一个理想方式。
1 临床资料与方法
1.1 一般资料
本组 65例均为女性,中位年龄 51岁(34~69岁)。术后辅助化疗 2例,复发转移后解救化疗 63例。解救化疗患者中骨转移 21例、肺转移 30例、肝转移 12例,其中 2个及以上部位转移 21例。32例接受输液港植入前已进行 2~4疗程化疗,45例 6个月内曾接受锁骨下静脉穿刺置管。
输液港植入适应证:需建立长期深静脉输液通路者;辅助化疗对生活质量要求较高者;外周血管穿刺困难无法留置经外周中心静脉插管(PICC)。输液港植入术的禁忌证:有明显凝血功能障碍、穿刺部位存在皮肤软组织感染、大量胸腔积液难于平卧无法耐受手术者,和已知对高分子人工材料不耐受者。
1.2 方法
采用美国巴德公司单腔标准型植入式静脉输液港。输液港植入术均在手术室 C形臂 X线机引导下完成。术前进行凝血功能、胸片检查。
局麻,采用 Seldinger法行常规深静脉穿刺、放置输液港导管,其中右锁骨下静脉 52例、左锁骨下静脉 9例、右颈内静脉 4例。术中以第 8后肋水平作为解剖定位标志,透视证实导管位于上腔静脉右心房入口水平。在同侧上胸壁锁骨下窝处做 3cm切口,向尾端游离皮瓣,皮瓣厚度 0.5cm,做出一个恰能容纳泵体的囊袋植入输液泵,将输液港导管经皮下隧道与囊袋中输液港连接,并将输液港和周围组织缝合固定,避免穿刺座翻转。术中给予抗生素预防感染。术后常规进行胸片 X线检查明确导管尖端位置并记录(图1),证实导管位置正确、双肺无新发的气胸或积液即可开始使用。根据切口张力情况,术后 12~14天拆线。
2 结果
术后 X线胸片显示导管尖端位置理想(位于7~9后肋)62例,2例位于 5~6后肋,1例位于第10后肋者有心悸不适,立即局麻下拆除缝线,将导管和输液港分离后向外拉出 3cm后剪断重新连接,患者心悸不适消失。
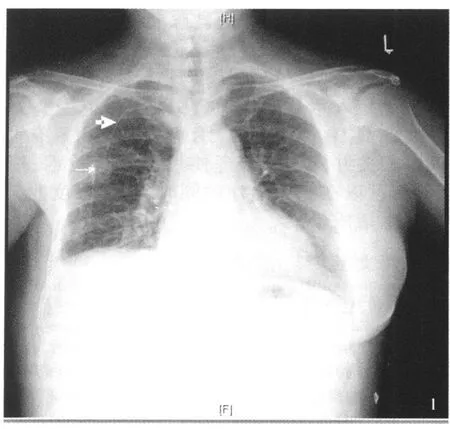
图1 右锁骨下静脉穿刺输液港植入术后 X线图像(细箭头:输液港;粗箭头:输液港导管;虚线箭头:输液港导管尖端位于第 8后肋)
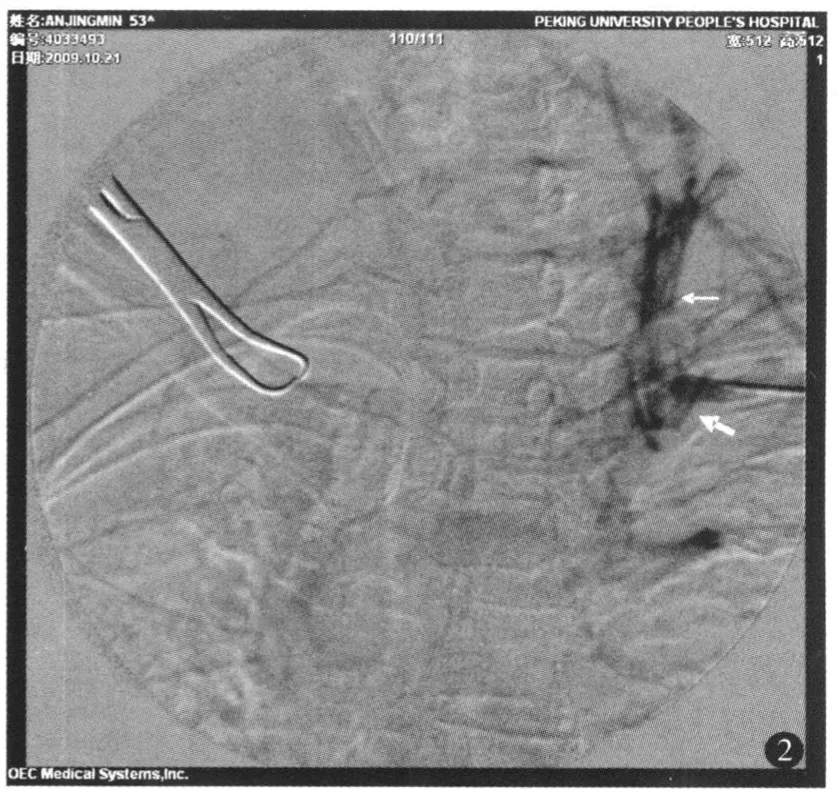
图2 输液港植入术中左锁骨下静脉造影提示左锁骨下静脉血流中断,侧支循环建立(粗箭头:左锁骨下静脉;细箭头:周围建立的侧支循环)
围手术期并发症包括深静脉穿刺相关并发症和伤口并发症,发生率分别为 7.7%(5/65)和 3.1%(2/65)。穿刺中误入锁骨下动脉 2例,经术中加压10min后无血肿形成,重新穿刺并将进针角度向尾端偏 10°,成功穿刺锁骨下静脉;气胸 3例,右侧 1例,左侧 2例,其中 2例气胸肺压缩比例 <25%,未特殊处理,1例左侧大量气胸行胸腔闭式引流 5天后气胸消失,顺利拔除闭式引流管。2例输液泵植入部位愈合不良,1例因迁延不愈合输液港外露而取出;另 1例因胸壁软组织条件良好,将皮下埋置的输液港向侧方移位并注意保留皮瓣厚度 0.8cm后愈合。1例行左锁骨下静脉穿刺中穿刺可见回血,但导丝无法完全置入,将导丝撤出后术中行左锁骨下静脉造影,显示左锁骨下静脉内血栓形成,广泛侧支循环建立(图2),因该患者治疗急需建立深静脉通路,故选右侧颈内静脉穿刺植入输液港装置。因治疗结束不愿继续留置输液港而取出 4例,其余均持续保留输液港装置。至末次随访,65例带管时间4~35个月,中位带管时间 22个月,其中 24例因肿瘤进展死亡,其他病人无导管相关性感染、导管阻塞、导管断裂等远期并发症。
3 讨论
目前临床常用的深静脉置管方法有锁骨下静脉穿刺置管和经外周中心静脉穿刺置管(PICC),前者留置时间较短,需要经常进行导管的护理,使用不便;后者虽留置时间有所延长,但仍需要每周进行导管的护理,导管有部分暴露在体外,长期留置仍会给患者带来不便。完全植入式静脉输液港(totally imp lantable central venous access port)是一种可植入皮下可长期留置在体内的静脉输液装置,由供穿刺的注射座和静脉导管系统组成,可建立一个长期稳定的深静脉通路,可用于化疗药物、完全肠外营养液等刺激性药物输注,并且完全埋置于皮下,患者不需要频繁换药,可以沐浴,生活质量得以改善。转移性乳腺癌患者需要接受长期治疗,如输注对外周静脉刺激性较强的化疗药物等,因而建立一个长期、可靠、相对舒适的深静脉通路,对这些患者完成治疗并提高生活质量十分重要。相比外置式深静脉导管,完全植入式输液港更为安全、方便,留置时间更长[1]。
输液港植入手术方法总的来说分为两类[2]。一种采取直视下游离静脉,远心端结扎,近心端置入静脉导管并结扎固定,可选择的静脉包括颈外静脉、头静脉等;另一种为深静脉穿刺置管,可在超声等引导下进行,也可根据深静脉解剖定位直接穿刺,超声引导下进行深静脉穿刺更为准确、安全。输液港装置是埋置在体表皮下一个人工游离的皮袋之中的,一般皮瓣厚度在 0.5cm左右,过厚会给将来穿刺定位带来不便,过薄会使局部皮肤营养障碍增加伤口裂开或不愈合的风险。本组切口愈合不良的 2例,分析其原因:其中 1例因右乳腺癌接受过右侧胸壁放疗,局部组织纤维化,手术后由于可供游离的软组织量不足,导致术后伤口张力较大,放疗后皮肤营养状态较差也是伤口愈合不良的因素之一;另 1例系操作初期,皮瓣厚度选择不合适,皮瓣较薄血供不良引起伤口愈合不良,重新制备皮袋注意保留足够的皮下组织后,切口愈合良好。
文献报道输液港主要的并发症包括气胸、血栓形成、局部疼痛不适、输液港埋置处感染、导管阻塞、导管断裂等[2]。Vardy等[3]报道 110例输液港的近期和远期并发症,其中气胸 2例、血栓形成 2例、局部疼痛 9例、感染 4例。本组出现 1例需接受胸腔闭式引流的气胸,系左锁骨下静脉穿刺病例。患者为右侧乳腺癌接受了右乳腺癌改良根治术,并进行了胸壁放疗。右侧胸壁没有做皮袋的合适部位,故行左锁骨下静脉穿刺。术中 X线及听诊未发现异常,次日患者诉憋气,查体发现左侧气胸,给予胸腔闭式引流后 5天痊愈出院。本组 3例气胸均在半年内曾接受过锁骨下静脉穿刺,放置输液港中穿刺困难,多次穿刺。这提示左侧锁骨下静脉穿刺、穿刺困难多针穿刺者是气胸并发症的高危人群,术中、术后应加强观察。
术中 X线引导下参照体内骨性解剖标记可以准确引导导管末端准确位于右心房上腔静脉入口水平。一般当导管尖端位于第 8后肋水平可认为接近上腔静脉右心房入口水平。位置相对偏浅会因血流相对慢而增加导管阻塞机会,位置过深进入心房有可能引起患者心悸等不适。根据体表测量而相对盲目放置导管其导管位置正确率会明显减低。因此,应尽量在 X线引导下放置输液港装置。
输液港装置可以在体内长期存留,具体可以保留的时间不同文献报道不一[4,5]。理论上只要输液港穿刺部位没有渗漏、导管没有阻塞,该装置就可以长期保留。但由于血栓形成、导管阻塞、输液不畅等并发症,限制了输液港的使用寿命。对预期生存期相对有限的转移性乳腺癌患者,埋置式输液港长期保留更有助于患者在解救化疗和终末期支持治疗时的给药。本组病例最长时间已经留置 35个月,仍保持输液通畅。由于输液港装置长期留存,并经常输注刺激性药物如化疗药物、高渗的肠外营养液等,需要严格按照输液港使用护理规范进行操作。在输入高黏滞性液体(如肠外营养液)时每 1~2小时后应换用生理盐水冲洗管道,防止药液沉积导致管道阻塞。每月应进行输液港冲洗护理,可采用肝素生理盐水,使用 10 ml注射器进行脉冲式正压冲洗管道,防止一些纤维素等成分附着在导管尖端,影响导管通畅。本组最长随访 35个月尚无导管阻塞发生,可能和本组病例均由我中心专科护士进行输液港系统使用维护管理,同时所采用巴德导管系统具有的三向瓣膜设计可有效减少导管阻塞的发生有关。正确使用,精心护理可以明显延长输液港使用寿命,并减低并发症发生率。
在使用中常见的问题包括回抽无回血、输液不畅等。回抽无回血首先应确认输液港和导管是否正常,有无导管打折或穿刺针有没有穿刺入输液港腔内等情况。有时因为导管末端贴壁也会出现回抽无回血,此时可以嘱患者活动上肢,或咳嗽后再试行回抽。如反复操作均无回血,X线提示导管位置无异常,可尝试小量推注生理盐水,如果通畅无阻力,可注入造影剂后再次摄片确认导管在血管内后再正式输入治疗液体。另外一个少见而严重的并发症是夹闭综合征(pinch-off综合征),系导管在锁骨和第一肋骨夹角中受到挤压而输液不畅,严重者可引起导管断裂[6]。Lin等[7]报道夹闭综合征约一半均发生在植入术后 1年内,主要表现为输液不畅。夹闭综合征应预防为主,穿刺锁骨下静脉可尽量在锁骨肋骨夹角较大处进行,导管和穿刺座连接应顺滑,避免成角。
植入式输液港是乳腺癌化疗有效、安全、相对舒适的静脉化疗给药途径。X线引导可以帮助精确导管尖端定位。根据病人具体情况选择恰当术式,输液港植入术是安全、可靠的。本组主要并发症均发生在前 10例患者,提示手术经验积累有助于减少手术相关并发症。合理使用输液港技术,精心护理管理,可以在完成治疗的同时,最大限度改善乳腺癌患者生活质量。
1 Biffi R,De Braud F,Orsi F,et al.A randomized,prospective trial of central venous ports connected to standard open-ended or Groshong catheters in adult oncology patients.Cancer,2001,92:1204-1212.
2 陈明远,夏良平,陈直华,等.植入式静脉输液港不同植入术式在恶性肿瘤患者中的应用.中山大学学报(医学科学版),2007,28(6):145-147.
3 Vardy J,Engelhardt K,Cox K,et al.Long-term outcome of radiological-guided insertion of implanted central venous access port devices(CVAPD)for the delivery of chemotherapy in cancer patients:institutional experience and review of the literature.Br J Cancer,2004,91:1045-1049.
4 Hou SM,Wang PC,Sung YC,et al.Comparisons of outcomes and survivals for two central venous access port systems.J Surg Oncol,2005,91:61-66.
5 Ohno H,Mizumoto C,OtsukiY,et al.The duration of functioning of a subcutaneous implantable port for the treatment of hematological tumors:a single institution-based study.Int J Clin Oncol,2010,15:172-178.
6 Mirza B,Vanek VW,Kupensky DT,et al.Pinch-off syndrome:case report and collective review of the literature.Am Surg,2004,70(7):635-644.
7 Lin CH,Wu HS,Chan DC,et al.The mechanisms of failure of totally implantable central venous access system:Analysis of 73 cases with fracture of catheter.Eur JSurg Oncol,2010,36:100-103.
