不同时间电针对急性脑出血大鼠氧化应激反应的影响
2011-06-07张英黄俊涛段轶轩汤园园
张英,黄俊涛,段轶轩,汤园园
不同时间电针对急性脑出血大鼠氧化应激反应的影响
张英1,黄俊涛2,段轶轩3,汤园园4
(1.江汉大学,武汉 430056;2.宜昌市葛洲坝中心医院,湖北 443002;3.武汉市武昌区惠民医院,湖北 430060; 4.湖北中医药大学2009级硕士生,武汉 430060)
观察不同时间点针刺治疗对急性脑出血大鼠氧化应激反应的影响。Wistar雄性大鼠随机分为7组,正常组、模型组(模型1组、模型2组、模型3组、模型4组)、3 h电针组和72 h电针组,采用胶原酶Ⅶ诱发大鼠尾壳核脑出血模型。3 h电针组和72 h电针组分别于造模后3 h、72 h时开始针刺,每日1次,共针刺5次。检测血红素氧合酶-1(Heme Oxygenase-1,HO-1)和血红素氧合酶-2(Heme Oxygenase-2,HO-2)。造模后脑组织内见大量脑出血,神经纤维缠结、断裂;3 h电针组脑组织仍可见泡沫细胞浸润及出血;72 h电针组脑组织内坏死灶明显缩小、小胶质细胞浸润、极少量出血。正常大鼠脑组织均有HO-1和HO-2表达,脑出血大鼠HO-1表达明显增高,并与时间变化有一定联系。3 h电针组、72 h电针组HO-1均降低,两组之间比较差异无统计学意义(>0.05)。造模后5 d大鼠脑组织内未出现HO-2表达,造模后8 d出现表达,3 h电针组、72 h电针组均出现HO-2表达,72 h电针组较3 h电针组高,差异有统计学意义(<0.05)。电针可以改善急性脑出血后脑组织出血状况,降低脑出血后氧化应激反应,对急性脑出血后神经元损伤有一定的修复作用。脑出血后72 h电针比3 h电针疗效好,提示急性期脑出血早期应该慎重选择电针治疗。
脑出血;电针;氧化应激;大鼠
脑出血(Intracerebral hemorrhage,ICH)是严重危害人类生命和健康的疾病,是中老年人致残和死亡的主要原因之一。脑出血后损伤组织的氧化应激反应在脑水肿的发生和神经元损伤过程中起重要作用,与患者急性期的存活和后期的康复效果关系密切[1]。针灸治疗脑出血的临床和实验研究很多[2,3],但是关于针灸治疗脑出血的时机仍然存在着较大的争议。由此我们以胶原酶Ⅶ诱导大鼠尾壳核脑出血为模型,从氧化应激反应角度,研究不同时间点电针对脑组织HO-1和HO-2表达的影响,以期为临床针刺治疗脑出血提供可靠的实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
健康Wistar雄性大鼠56只,体重在200~250 g,由湖北省疾病预防控制中心提供。
1.1.2 主要实验用品
主要实验器械用脑立体定位仪SR-6N型(日本产)、脑立体定位钻SD-101型(日本产)、G6805-2型针灸治疗仪(中国上海)。
主要实验试剂为胶原酶Ⅶ(1500 U,由南京建成生物试剂有限公司提供);HO-1、HO-2免疫组化染色试剂盒,DAB显色试剂盒,0.01 mol/L PBS(pH7.2~7.6)(由武汉博士德生物试剂有限公司提供)。
1.2 实验方法
1.2.1 动物分组
将大鼠按体重编号,随机分为7组,正常组、模型组(模型组分为模型1组、模型2组、模型3组、模型4组)、3 h电针组和72 h电针组,每组8只。造模后死亡3只,立即进行补充,所用动物均在江汉大学动物中心饲养。
1.2.2 造模方法
采用胶原酶Ⅶ诱发大鼠尾壳核脑出血模型[4]。动物经10%水合氯醛腹腔麻醉(400 mg/kg)后固定于脑立体定位仪上,以前囟为坐标原点,向后1 mm,矢状缝向右4 mm,确定注射点坐标,用脑立体定位钻(直径1.0 mm)在注射点钻透颅骨,用1mL的微量注射器吸取0.5mL的胶原酶溶液(1 U/mL)注入,钻孔处填入医用无菌棉球止血。腹腔注射氨苄青霉素8万U,动物清醒后放回笼内饲养。
1.2.3 处理方法
①正常组不进行任何处理。②模型组造模同上。③模型1组和模型2组分别于造模后3 h、72 h时处死,灌注取样本;分别作为3 h电针组、72 h电针组治疗前对照;模型3组和模型4组分别在造模后3 h+5 d、72 h+5 d处死,灌注取样本。分别作为3 h电针组、72 h电针组治疗后对照。④电针组造模同上。
针刺用0.30 mm×15 mm毫针针刺水沟、内关(双侧)、三阴交(双侧)。取穴标准及针刺深度参照《常用动物腧穴图谱》[5]标准而定。接G6805-2型针灸治疗仪,选连续波,频率2 Hz,强度1 mA,留针30 min。
3 h电针组和72 h电针组分别于造模后3 h、72 h时即刻针刺1次,此后4天,每日1次,针刺5次后处死取材。
1.2.4 检测指标及检测方法
各组大鼠均用10%水合氯醛腹腔注射麻醉,开胸经升主动脉依次灌入生理盐水100 mL、4℃预冷的含4%多聚甲醛的0.01 mol/L磷酸缓冲液(PBS,pH7.4) 400 mL。灌毕取脑,置于4%多聚甲醛溶液过夜后固定。以注射点为中心冠状石蜡切片,片厚5mm,连续切10片,贴于APES防脱片胶处理的载玻片备染。
1.2.4.1 HE染色
石蜡切片,常规脱蜡水化,苏木精5 min,水洗,盐酸乙醇分化20 s,充分水洗,弱氨水返兰20 s,充分水洗并浸泡10 min,伊红染色20 min,梯度乙醇脱水,二甲苯透明,中性树胶封片。
1.2.4.2 脑组织HO-1、HO-2测定
采用免疫组化ABC法。
1.2.5 统计学方法
所有实验数据以均数±标准差表示,运用SPSS14.0 统计软件进行方差分析,统计学处理采用单因素方差分析(one-way ANOVA),多个样本均数之间的两两比较采用检验。
2 结果
2.1 各组脑组织HE染色比较
正常脑组织未见明显异常改变;模型1组脑组织内见大量脑出血,神经纤维缠结、断裂,脑组织内未见明显小胶质细胞浸润;模型2组脑组织内见少量出血,少许小胶质细胞浸润及大量液化性坏死;模型3组脑组织内可见大量小胶质细胞浸润、坏死伴少量出血;模型4组脑组织内可见液化灶缩小及大量小胶质细胞浸润; 3 h电针组脑组织内可见泡沫细胞浸润及出血;72 h电针组脑组织内可见坏死灶明显缩小、小胶质细胞浸润、极少量出血。
2.2 各组脑组织HO-1表达的比较
正常组大鼠脑组织有HO-1表达,4个模型组脑组织HO-1表达较正常组均升高(<0.01),差异有统计学意义,并随着时间延长而增高,造模5 d后达到高峰,造模后8 d稍有下降;3 h电针组较模型1组HO-1表达增高(<0.01),较模型3组表达降低(<0.01); 72 h电针组HO-1表达较模型2组明显增高,有显著性差异(<0.01),较模型4组表达降低,但差异无统计学意义(>0.05);72 h电针组较3 h电针组稍高,但差异无统计学意义(>0.05)。详见表1。
2.3 各组脑组织HO-2表达的比较
正常组大鼠脑组织有HO-2表达,模型1组、模型2组、模型3组均未见HO-2表达,模型4组出现HO-2表达,与正常组相比,差异有统计学意义(<0.05); 3 h电针组出现HO-2表达,但较正常组表达低,差异有统计学意义(<0.01);72电针组HO-2表达与正常组相比,差异有统计学意义(<0.05),与模型4组比,差异有统计学意义(<0.05),较3 h电针组增高,差异有统计学意义(<0.05)。详见表1。
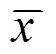
表1 各组脑组织HO-1、HO-2表达的比较 (±s)
注:与正常组比较1)<0.05,2)<0.01;与模型1组比较3)<0.01;与模型2组比较4)<0.01;与模型3组比较5)<0.01;与模型4组比较6)<0.05;与3 h电针组比较7)<0.05
3 讨论
3.1 急性脑出血与氧化应激反应
脑出血后由于缺血、缺氧产生大量的氧自由基,破坏机体正常的氧化/还原的动态平衡,造成生物大分子(核酸、蛋白质、脂质)的氧化损伤,形成严重的氧化应激状态,诱导细胞凋亡。HO系统作为含铁血红素代谢的限速酶参与了氧化应激反应,HO-1主要在应激状态下保护细胞和组织,对抗应激反应;HO-2则主要在正常生理状态下发挥调节作用,对神经元的保护作用更为重要。脑出血大鼠HO-1蛋白表达在出血后12 h到2 d逐渐增强,到2 d时达到高峰,后期的下降则与heme大量降解有关。正常情况下大鼠前脑、中脑、基底节、丘脑区、小脑和脑干等神经元均有强而稳定的HO-2表达。
从本实验结果来看,HO-1、HO-2均在正常脑组织中出现阳性表达,急性脑出血后大鼠血肿周围脑组织HO-1表达增高,出血3 h后表达增加,72 h达高峰,持续1星期仍有表达,HO-2在出血后3 h至5 d时均无表达,而在8 d出现表达。说明氧化应激反应可能参与了脑出血后的脑水肿和神经细胞的损害,并与发病时间密切相关,这与其他研究者的研究结果基本一致[6-9]。
3.2 中医对脑出血的认识
急性“脑出血”与中风一病相近,阳亢风动,气升血逆为本病的病因病机。本研究参照醒脑开窍法[10]选用内关、水沟、三阴交为主穴,内关、水沟开窍醒神通络,三阴交生髓醒脑,滋水熄风,补泻兼施,可收标本兼顾之效。
3.3 不同时间电针对急性脑出血后氧化应激反应的影响
电针对急性脑出血后氧化应激反应具有一定的影响,并因介入的时间不同而出现作用差异。实验结果提示,3 h电针组疗效不及72 h电针组。脑出血后3 h开始电针治疗的大鼠,脑组织仍有大量出血和炎症反应,HO-1的表达较治疗前下降,HO-2表达均较治疗前增高;脑出血后72 h电针治疗的大鼠脑组织坏死病灶较治疗前明显缩小,HO-1表达较治疗前降低,HO-2表达较治疗前增高,说明电针可能通过降低脑出血后脑组织HO-1表达,提高HO-2表达,通过催化血红素生成CO、铁、胆红素,发挥抗炎、抗氧化、抗凋亡、调节微循环的作用,从而对脑出血后脑水肿及神经元的修复产生一定的影响,但不同时机进行针刺治疗存在疗效差异,提示临床治疗脑出血应注意针刺时机的选择。
所以出现以上结果,可能与以下因素有关。①急性脑出血极早期采用电针治疗,可能形成了较强的刺激,有加重脑出血可能;②脑出血后1星期内,氧化应激反应处于上升阶段,可能影响电针治疗效果评价;③动物的自我修复能力较强。在实验中我们发现,未接受针刺治疗,即造模后自然存活至实验结束大鼠与72 h电针组大鼠相比,脑组织出血、HO-1表达无明显差异,HO-2表达尚高于72 h电针组,可能与大鼠急性脑出血后的自我修复有关。
[1] Nakamura T, Keep RF, Hua Y,. Oxidative DNA injury after experimental intracerebral hemorrhage[J]. Brain Res, 2005,1039(1): 30-36.
[2] LI Jing-jing, DONG Gui-rong. Scalp Acupoints Penetration in Trea- ting Acute Hypertensive Intracerebral Hemorrhage and Its Correlat- ivity with Serum S100B Protein[J]. J Acupunct Tuina Sci, 2006,4 (5):274-278.
[3] ZHU Wen-zeng, NI Jin-xia, BAO Chun-ling,. Clinical Study on 28 Cases of Acute Cerebral Hemorrhage Treated by Scalp Acupun- cture plus Rehabilitation Therapy[J]. J Acupunct Tuina Sci, 2006,4 (5):296-299.
[4] Rosenberg GA, Mun-Bryce S, Wesley M,. Collagenase-in-duced intra cerebral hemorrhage in rats[J]. Stroke, 1990,21(5):801-807.
[5] 李忠仁.实验针灸学[M].北京:中国中医药出版社,2003:327-328.
[6] Bertrand DMN, Prigent-Tessie A, Stanimirovic A,. Differential Mn SOD and HO-1 expression in cerebralendothelial cells in response to sublethal oxidative stress[J]. Brain Res, 2004,103(1-2): 151- 158.
[7] 唐涛,罗团连,张花先,等.胶原酶诱导脑出血大鼠脑内氧化应激反应研究[J].中国康复医学杂志,2006,1(5):1001-1242.
[8] Litvinov DY, Prasolov VS, Bouton S,. Influence of antioxidants on NO-dependent induction of heme oxygenase-1 in U937 monocytes [J]. Mol Biol, 2005,39(1):77-83.
[9] Wang J, Zhuang H, Dore S. Heme oxygenase 2 is neuroprotective against intracerebral hemorrhage[J]. Neurobiol Dis, 2006,22(3):473 -476.
[10] 石学敏.“醒脑开窍”针刺法治疗中风病9005例临床研究[J].湖南中医药导报,2005,11(1):3-5.
Effects of Electroacupuncture at Different Times on Oxidative Stress Reaction in Rats with Acute Cerebral Hemorrhage
1,-2,-3,-4.
1.,430056,; 2.,,443002,; 3.,430060,; 4.’2009,,430060,
To investigate the effects of electroacupuncture at different time points on oxidative stress reaction in rats with acute cerebral hemorrhage.Wistar rats were randomly allocated to seven groups: normal, model (1, 2, 3 and 4), 3 h electroacupuncture and 72 h electroacupuncture. A rat model of caudate and putaminal hemorrhage was made using collagenase Ⅶ. The 3 h and 72 h electroacupuncture groups were acupunctured at 3 hrs and 72 hrs after model making, respectively. Acupuncture was given once daily, for 5 times. Heme oxygenase-1 (OH-1) and heme oxygenase-2 (OH-2) were measured.Cerebral hemorrhage, and neurofibrillary tangles and disruption appeared after model making. Cerebral foam cell infiltration and bleeding was still visible in the 3 h electroacupuncture group. The necrotic foci became small obviously and microglia infiltration and very small amounts of blooding existed in the brain tissue in the 72 h electroacupuncture group. Cerebral OH-1 and OH-2 were both expressed in the normal rats. The OH-1 expression increased significantly and was related to the time change in the cerebral hemorrhage rats. The OH-1 expression decreased in both 3 h and 72 h electroacupuncture groups, but there was no statistically significant difference between the two groups (>0.05). Rat cerebral OH-2 expression did not appear at 5 days after model making but did at 8 days. The OH-2 expression appeared in both 3 h and 72 h electroacupuncture groups and was higher in the 72 h electroacupuncture group than in the 3 h electroacupuncture group. The difference was statistically significant (<0.05).Electroacupuncture can reduce brain tissue bleeding and oxidative stress reaction and has a certain repairing effect on injured neurons after acute cerebral hemorrhage. The therapeutic effect of electroacupuncture at 72 hrs after cerebral hemorrhage is better than that at 3 hrs, suggesting that electroacupuncture treatment should be cautiously selected in the early stage of acute cerebral hemorrhage.
Cerebral hemorrhage; Electroacupuncture; Oxidative stress reaction; Rat
1005-0957(2011)06-0418-03
R2-03
10.3969/j.issn.1005-0957.2011.06.418
2010-12-20
张英(1968 - ),女,副教授,博士
A
