非培养技术解析生化系统微生物群落结构
2011-06-06王继华庞长泷
崔 迪,李 昂,王继华,张 斯,庞长泷,马 放,王 立,崔 潇
(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,150090 哈尔滨,jscz-dd@hotmail.com;2.哈尔滨工业大学市政环境工程学院,150090 哈尔滨;3.哈尔滨师范大学生命科学与技术学院,150025 哈尔滨)
非培养技术解析生化系统微生物群落结构
崔 迪1,2,李 昂1,2,王继华3,张 斯1,2,庞长泷1,2,马 放1,2,王 立1,2,崔 潇1,2
(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,150090 哈尔滨,jscz-dd@hotmail.com;2.哈尔滨工业大学市政环境工程学院,150090 哈尔滨;3.哈尔滨师范大学生命科学与技术学院,150025 哈尔滨)
为揭示城市污水厂生化系统稳定运行阶段微生物与污染物降解效率间的关系,采用变性梯度凝胶电泳(PCR-DGGE)和Biolog技术,对冬春季城市污水厂稳定运行阶段生化系统中的微生物群落结构及代谢活性进行动态监测.结果显示,冬春季生化系统出水水质指标COD、NH4+-N和TN的平均去除率分别达84.4%、84.7%和59.8%左右.同季生化系统中不同位点微生物群落结构稳定,以芽孢杆菌 (Bacillus)、假单胞菌(Pseudomonas)、气单胞菌(Aeromonas)为主的优势菌群生态位稳定;春季温度升高,生化系统中微生物种群数量、多样性及代谢活性均加强,利于污染物的有效去除.
生化系统;微生物群落;变性梯度凝胶电泳;Biolog;代谢活性
活性污泥法因其投资少、无二次污染等优点广泛应用于城市污水处理厂,但由于生化处理系统主体是微生物而存在一定的不可预测和不可控性[1-5],因此,城市污水处理厂稳定运行期生化系统内部微生物的生存状态是亟待解决的主要问题之一.传统的生物学研究方法已经无法满足对微生物进行实时跟踪监测的要求,而微生物非培养技术[6]的应用可以弥补传统方法的不足.其中变性梯度凝胶电泳 (Denaturing gradient gel electrophoresis,DGGE)与Biolog两种技术近年来已广泛应用于土壤、水体污染[7-9]等环境领域微生物空间变化的研究中.
本文主要采用PCR-DGGE技术,跟踪监测某城市污水处理厂生化系统中微生物季节性的演替规律,同时应用简便、快速的 Biolog技术[10-12]考察生化系统中微生物对不同碳源的代谢活性及多样性.对两种方法在揭示城市污水厂生化系统稳定运行阶段微生物与污染物降解效率间关系的可行性进行深入探讨,为研究低温生境生化系统中高效降解微生物间的关系提供理论依据和技术支撑.
1 试验
1.1 工艺概述
针对北方地区特有的低温生态条件,处理工艺为A/O活性污泥法[13],设计进出水水质见表1,出水执行《城镇污水处理厂污染物排放标准》(GB18918—2002)二级标准[14].
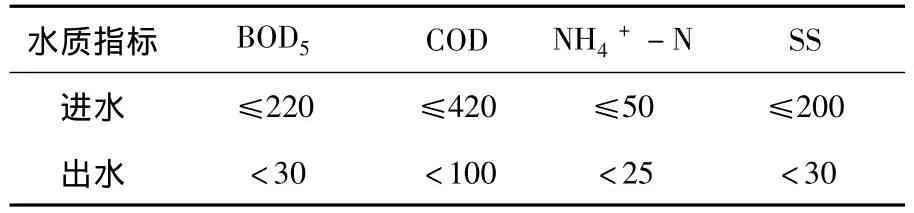
表1 污水厂设计进出水水质 mg·L-1
1.2 样品采集及DNA提取
分别于冬季11月和春季4月采集生化系统前段及末段活性污泥样品,各150~200 mL,离心收集,保存于-80℃.
微生物DNA的提取采用试剂盒(上海华舜生物技术有限公司)方法,吸光度OD260/OD280比值均在1.62~1.72,所得基因组DNA片断较为完整,纯度较好,满足后续PCR扩增模板要求.
1.3 PCR-DGGE及聚类分析
PCR 反应体系(50 μL):100 ng模板、20 pmol GC338F 和 518R 引物[15]各 0.5 μL、200 μmol/L dNTPs(每种 10 mmol/L)4 μL、10 × PCR buffer(MgCl2)5 μL、2.5 U 的 Pfu DNA 聚合酶1 μL,无菌纯水补齐到50 μL.
PCR反应条件:94℃预变性5 min,94℃变性30 s,55 ℃ 退火 40 s,72 ℃ 延伸 40 s,30 个循环,72℃最终延伸8 min.PCR产物用0.8%琼脂糖凝胶电泳检测.
采用Bio-Rad公司DcodeTM的基因突变检测系统对PCR反应产物进行分离.使用梯度混合装置,制备6% ~12%的聚丙烯酰胺凝胶,变性剂浓度从30%到60%(100%的变性剂为7 mol/L的尿素和40%的去离子甲酰胺的混合物).
电泳条件:温度设定为60℃,150 V的电压下,电泳时间6 h,获得凝胶银染后,经 Image ScannerⅢ扫描仪扫描.图谱聚类分析采用UPGAMA算法.
1.4 Biolog活性分析
1.4.1 Biolog Eco板接种液制备[16]
1)将采集的活性污泥样品沉淀30 min后,取1 mL污泥到1.5 mL离心管中;
2)10 000 r/min离心5 min,弃去上清液,加1 mL生理盐水,在振荡器上振动5 min混匀,于10 000 r/min离心1 min以去除大的颗粒物质;
3)取上清液倒入装有无菌生理盐水 (NaCl,0.85%)的试管中,OD590取定值;
4)将上述稀释液加入 Biolog生态微孔板(Biolog Eco- Plate,美国 Biolog公司)(150 μL/孔)中,避光保湿培养,每隔一定时间用细菌自动读数仪在590 nm下读取数据,连续测定至孔板内吸光度无明显变化为止[17].
1.4.2 微生物群落多样性分析
由于采用不同培养时间的数据计算会产生不同的结果,对各生物相的平均吸光度值与时间变化曲线相关联进行分析,采用培养60 h的数据计算微生物群落的多样性指数[18-20].
1)微生物代谢强度采用平均吸光度,计算公式为
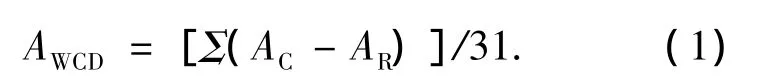
式中:AC为反应孔的吸光度值;AR为对照孔的吸光度值.
2)微生物群落多样性采用Shannon指数H表示,即
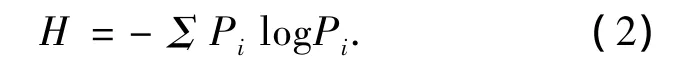
式中:Pi=ni/N,其中ni为峰面积,N为所有峰的总面积.
2 结果分析
2.1 冬春季生化系统稳定运行期水质指标
如图1(a)、(b)和(c)所示,城市污水处理厂生化处理系统冬春季运行水温维持在11~18℃,进水COD、NH4+-N及TN指标相对稳定.出水COD去除率平均达84.4%,NH4+-N去除率平均达84.7%,TN平均去除率达59.8%.冬季,生化系统对NH4+-N的去除效率随水温下降而降低;春季,生化系统对NH4+-N的去除效率随水温升高而上升.春季生化系统能够保持对NH+4-N转化效率是由于部分硝化及亚硝化细菌能够适应水体温度而发生硝化反应;冬季水温的降低使得生化系统中部分硝化及亚硝化细菌无法适应低温条件而减少了硝化反应的发生,致使NH+4-N去除效率降低[25].图1(b)显示水温维持在12~13℃阶段,生化系统保持较高的NH4+-N转化率,验证了部分可转化N元素的耐冷菌群发挥脱氮作用,维持了低温生化系统的稳定运行.
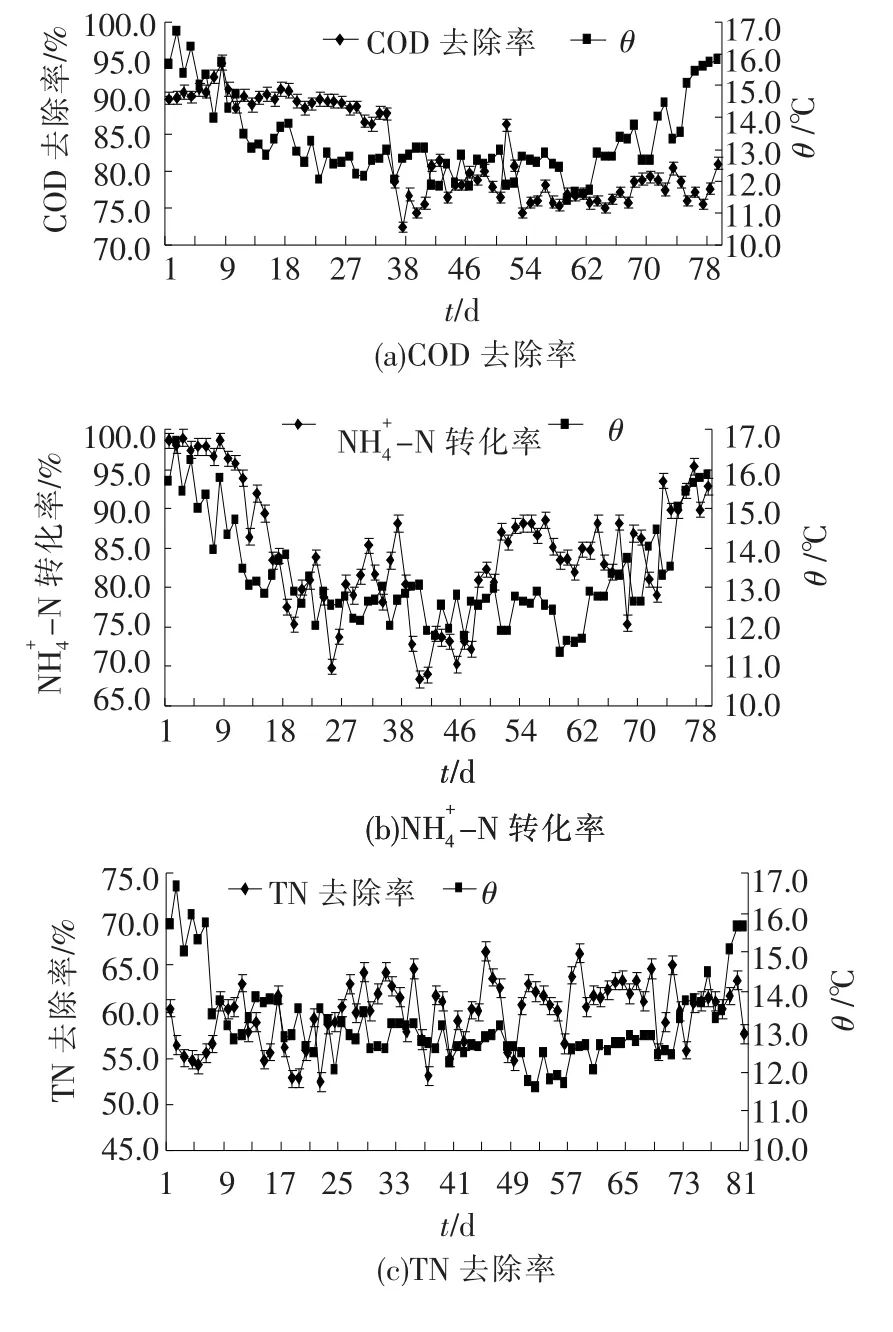
图1 冬春季生化系统出水水质特征(2007.11—2008.4)
2.2 冬春季生化系统微生物群落结构变化及聚类分析
2.2.1 冬春两季生化系统微生物群落结构演替
由图2可见,Lane1,Lane3分别有29和24条带;Lane2,Lane4分别有38和39条带.特征优势条带一直存在系统中,代表生化系统中常驻优势菌群的存在,经测序鉴定主要为芽孢杆菌属(Bacillus)、假单胞菌属 (Pseudomonas)、气单胞菌属(Aeromonas)等,其中芽孢杆菌作为主要絮凝菌群对提高生化系统活性污泥的沉降性能起到积极作用[21];部分菌群优势信号随外界温度的变化而逐渐加强或减弱,如生丝微菌属(Hyphomicrobiaceae),其转化 N元素的能力对生化系统提升脱氮效率具有积极作用[22],可能为图1(b)低温(12~13℃)时期生化系统保持较高NH4+-N转化率的适低温功能微生物群落之一.
Lane1,Lane2 和 Lane3,Lane4 分别代表不同季节生化系统相同位点微生物群落结构,春季温度升高利于生化系统中微生物的生长,部分适中温微生物开始富集生长,少量适冷微生物(如Band A,Band B所代表的微生物群落)逐渐消失.
Lane1,Lane3 和 Lane2,Lane4 分别代表相同季节生化系统不同位点微生物群落结构,温度不变,各位点的微生物群落结构维持稳定,种群数量改变较小,这是维持生化系统出水水质达标的原因之一[21,23].
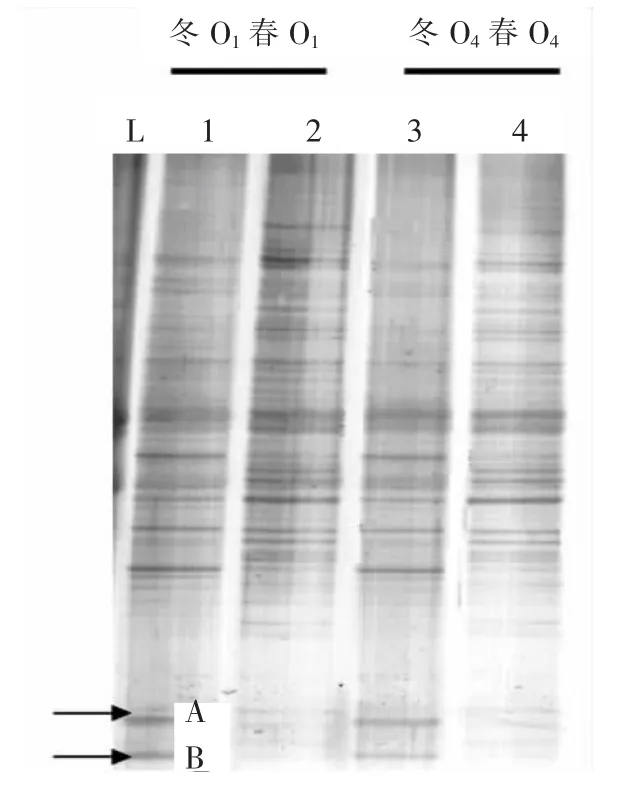
图2 冬春季总细菌DGGE图谱
2.2.2 冬春两季生化系统微生物群落聚类分析
图3显示相同季节各生化系统微生物群落结构的相似性高于不同季节的微生物群落结构相似性,微生物群落结构呈现出稳定演替的趋势.Lane1与Lane3相似性达72%以上;Lane1与Lane2相似性达65%,相似性发生变化而降解效率稳定,可能是由于部分适低温微生物在春季被中温微生物替代或缺失,如部分硝化细菌及亚硝化细菌在低温(<10℃)生境中无法存活[25],而生化系统中大部分具有高效降解能力的微生物其功能并没有随数量变化而改变.整体来讲,春季微生物种群数量好于冬季,同时稳定的群落结构保证了群落的功能稳定,从而保持生化系统污染物的有效去除.
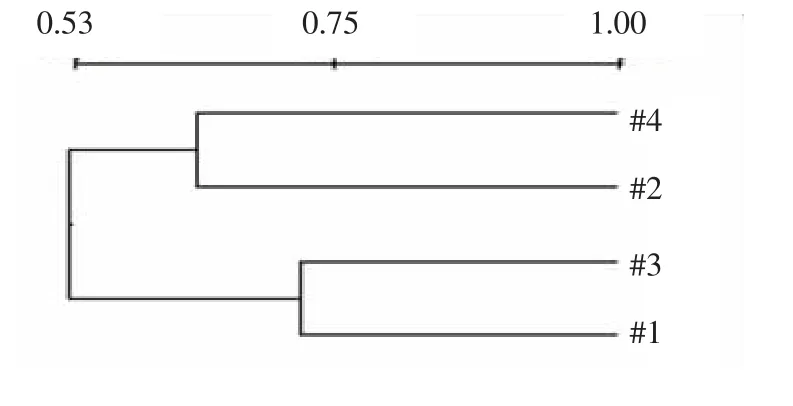
图3 DGGE图谱UPMGA聚类分析
2.3 微生物群落代谢强度及多样性分析
2.3.1 微生物群落代谢强度变化分析
Biolog公司生产的Eco-PlateTM是按照微生物对3大营养物质糖类、脂类、氨基酸类及其相应衍生物划分原则设计出的31种碳源,AWCD指数反映了微生物菌群对31种碳源总体的利用程度[24].根据AWCD结果生成的曲线图符合微生物生长曲线规律(如图4所示),含有潜伏期、指数期及稳定期,但衰亡期因监测时间较短而无法体现[20].
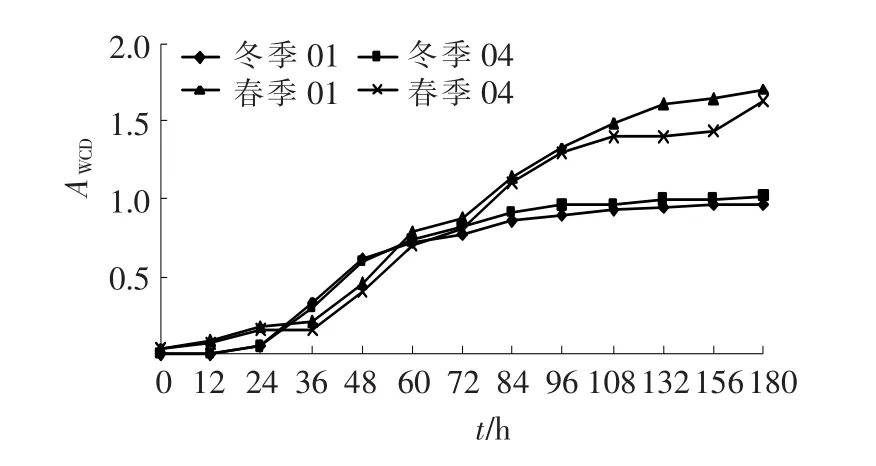
图4 平均吸光度随时间的变化
两组曲线拟合度较好,显示出生化系统不同位点的微生物群落在相同季节对所有碳源的利用程度相似;稳定期曲线持续时间较长,说明冬春季生化系统中微生物能够较好适应生境变化,维持稳定的代谢活性,这与图2生化系统微生物群落结构稳定相符合.同时,春季生化系统中部分中温微生物群落随着温度的回升而呈倍数增殖[25],强化了生化系统原有微生物代谢活性的强度,因此,春季生化系统对碳源的利用程度高于冬季.
2.3.2 微生物群落多样性分析
冬春季生化系统中Shannon多样性指数 (图5)变化幅度维持在0.118~0.203,微生物多样性好且物种丰富;而不同季节微生物群落多样性有差别,春季好于冬季,这是由于温度回升使得中温微生物恢复倍数增殖导致生化系统中的微生物在数量、活性及多样性上都发生了改变,这与图2所显示的微生物群落演替规律相一致.
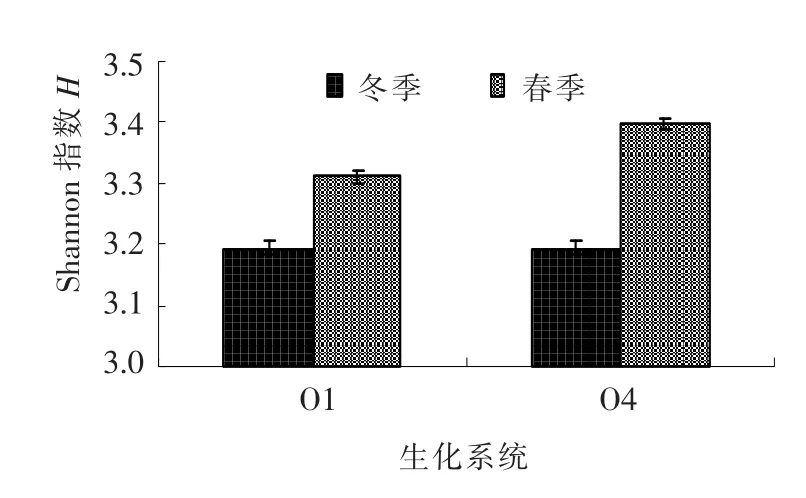
图5 不同季节微生物群落Shannon多样性指数
3 结论
1)冬春季大部分能够高效去除COD、转化NH4+-N及去除TN的微生物可稳定作用于生化系统,使得冬春季出水COD平均去除率维持在84.4%左右,NH4+-N平均转化率维持在84.7%左右,TN平均去除率维持在59.8%左右,出水水质符合《城镇污水处理厂污染物排放标准》(GB18918—2002)二级标准.
2)以芽孢杆菌、假单胞菌、气单胞菌为优势菌群的生化系统中微生物群落结构稳定,不同季节微生物群落结构演替规律明显,春季微生物多样性及代谢活性高于冬季.
3)通过PCR-DGGE及Biolog两种方法验证了冬春季生化系统出水COD、NH4+-N及TN的去除率与转化率主要受微生物多样性及代谢活性的影响,两种方法结合监测低温城市污水厂生化系统中微生物动态变化是可行的.
[1]LIMBERGEN van H.Verstraete bioaugmentation in activated sludge:current features and future perspectives[J].Appl Microbiol Biotechnol,1998,50:16 -23.
[2]QUAN Xiangchun,SHI Hanchang,LIU Hong,et al.Removal of 2,4-dichlorophenol in a conventional activated sludge system through bioaugementation[J].Process Biochemistry,2004,39:1701-1707.
[3]MOHAN S V,RAO N C,PRASAD K K,et al.Bioaugmentation of an anaerobic sequencing batch biofilm reactor(AnSBBR)with immobilized sulphate reducing bacteria(SRB)for the treatment of sulphate bearing chemical wastewater[J].Process Biochemistry,2005,40:2849-2857.
[4]JIANLONG W,XIANGHUN Q,LIBO W,et al.Bioaugmentation as a tool to enhance the removal refractory compound in coke plant wastewater[J].Proc Biochem,2002,38:777-781.
[5]VENKATA M V,CHANDRASEKHARA R N,PRASAD K K,et al.Bioaugmentation of anaerobic sequencing batch biofilm reactor(ASBBR)withimmobilized sulphate reducing bacteria(SRB)for treating sulphate bearingchemical wastewater[J].Process Biochem,2005,40:2849-2857.
[6]SALAH U M,ZHOU Jiti,QU Yuanyuan,et al.Biodecolorization of azo dye acid red B under high salinity condition[J].Bulletin of Environmental Contamination and Toxicology,2007,79(4):440-444.
[7]CE'BRON A,COCI M,GARNIER J.Denaturing gra-dient gel electrophoretic analysis of ammonia-oxidizing bacterial community structure in the lower seine river:impact of Paris wastewater effluents[J].Applied and Environmental Microbiology,2004,70(11):6726-6737.
[8]AGUSTINA L N A,MADAYANTI F W,ADITIAWATI P,et al.Culture-Independent and culture-dependent approaches on microbial community analysis at Gedongsongo(GS - 2)Hot Spring[J].International Journal of Integrative Biology,2008,2(3):145-152.
[9]王光华,刘俊杰,齐晓宁,等.Biolog和PCR-DGGE技术解析施肥对德惠黑土细菌群落结构和功能的影响[J].生态学报,2008,28(1):220-226.
[10]GOMEZ E,FERRERAS L,TORESANI S,et al.Soil bacterial functional diversity as influenced by organic amendment application[J].Bioresource Technology,2006,97:1484-1489.
[11]HEERDEN van J,EHLERS M M,CLOETE T E.Biolog for the determination of microbial diversity in activated sludge systems[J].Water Science and Technology,2001,43(1):83 -90.
[12]GUCKERTA J B,CARRB G J,JOHNSONB T D,et al.Community analysis by Biolog:curve integration for statistical analysis of activated sludge microbial habitats [J].Journal of Microbiological Methods,1996,27(22):183-197.
[13]赵庆建,赵立军,崔袁园,等.哈尔滨太平污水厂A/O工艺的低温快速启动[J].中国给水排水,2006,22(8):84-88.
[14]国家环保局.GB18918—2002城镇污水处理厂污染物排放标准[S].北京:中国环境科学出版社,2002:3-5.
[15]苏俊峰,马放,赵立军,等.石化废水处理系统微生物群落结构PCR-DGGE分析[J].南京理工大学学报,2008,32(1):127-130.
[16]SMALLA K,WACHTENDOR U,HEUER H,et al.Analysis of Biolog GN substrate utilization patterns by microbial communities[J].Applied and Environmental Microbiology,1998,64(4):1220-1225.
[17]CLASSEN A T,BOYLE S I,HASKINS K E,et al.Community-level physiological profiles of bacteria and fungi plate type and incubation temperature influences on contrasting soils[J].Microbiology Ecology,2003,44(3):319-328.
[18]GARLAND J L.Analytical approaches to the characterization of sample of microbial communities using patterns of potential C source utilization[J].Soil Biology and Biochemistry,1996,28(22):213-221.
[19]MAGURRAN A E.Ecological diversity and its measurement[M]. Princeton:Princeton University Press,1988.
[20]刘峰,张兰英,刘鹏,等.采用Biolog法分析制药废水处理工艺中微生物多样性[J].中国给水排水,2007,23(21):28-32.
[21]GUO Jingbo,WANG Jihua,CUI Di.Application of bioaugmentation in the rapid start-up and stable operation of biological processes for municipal wastewater treatment at low temperatures[J].Bioresource Technology,2010,101:6622-6629.
[22]王薇,蔡祖聪.好氧反硝化菌的研究进展[J].应用生态学报,2007,18(11):2618-2625.
[23]张斌,孙宝盛,季民,等.MBR中微生物群落结构的演变与分析[J].环境科学学报,2008,28(11):2192-2199.
[24]SALOMO S,MUNCH C,ROSKE I,et al.Evaluation of the metabolic diversity of microbial communities in four different filter layers of a constructed wetland with vertical flow by BiologTManalysis[J].Water Research,2009,43:4569-4578.
[25]张雷.低温生活污水脱氮除磷技术研究[D].哈尔滨:哈尔滨工业大学市政环境工程学院,2007.
Analysis of microbial community structure of biochemical system using uncultured technology
CUI Di1,2,LI Ang1,2,WANG Ji-hua3,ZHANG Si1,2,PANG Chang-long1,2,MA Fang1,2,WANG Li1,2,CUI Xiao1,2
(1.State Key Lab of Urban Water Resource and Environment,150090 Harbin,China,jscz-dd@hotmail.com;2.School of Municipal and Environmental Engineering,Harbin Institute of Technology,150090 Harbin,China;3.School of Life Science and Technology,Harbin Normal University,150025 Harbin,China)
To reveal the relationship between microorganism and pollutants’degradation in the stability system of the municipal wastewater treatment plant,the dynamic monitoring of microbial community structure and metabolic activity of the stable operation biological system in biological wastewater treatment plant was carried out using the denaturing gradient gel electrophoresis(PCR -DGGE)and Biolog Technology.The results showed that the average removal efficiency of effluent COD,NH4+-N and TN was more than 84.4%,84.7%and 59.8%,respectively.The microbial community structure was stable in the different sites of biological system in the same season,and the ecological niche of predominant functional species including Bacillus,Pseudomonas,Aeromonas was stable.As the temperature increased in spring,the quantity and diversity of population increased significantly.Meanwhile,metabolic activity strengthened in bioloical system,which could improve the removal rates of pollutants.It is feasible to use the two methods to monitor the changes of microbial community structure of biological system in a wastewater treatment plant at low temperature.
biological system;microbial community;PCR-DGGE;Biolog;metabolic activity
X703.1
A
0367-6234(2011)10-0045-05
2010-05-15.
国家自然科学基金资助项目(51108120,51178139,51108145,50809020);国家水体污染控制与治理科技重大专项基金资助项目(2008ZX07313-001);中国博士后科学基金资助项目(20090460901);哈尔滨市科技局青年科技创新人才研究专项基金资助项目(2011RFQXS093).
崔 迪(1984—),女,博士研究生;
马 放(1963—),男,教授,博士生导师.
(编辑 刘 彤)
