高效液相色谱法测定马兜铃酸A在细胞培养基中含量变化*
2011-06-02周慧芳张艳军边育红
王 丽,周慧芳,张艳军,边育红
马兜铃酸为硝基菲类有机酸,主要存在于马兜铃科马兜铃酸属、细辛属、木通科木通属等[1]。马兜铃酸药理作用广泛,有抗感染、抗癌及增强细胞免疫等功能[2-3]。长期以来,含有马兜铃酸的中药材被广泛应用于治疗各种疾病。近些年,随着临床报道和实验研究,马兜铃酸的毒性、致癌性和其他毒性作用相继被发现[4]。目前有关马兜铃酸毒性的机制尚不十分清楚[5],国内外学者通过大量体外实验证明其毒性作用可能的机制。因此,研究马兜铃酸的体外检测方法,了解其在细胞培养基中含量变化的特点,将有助于深入研究其毒理机制,从而为其毒副作用的防治提供理论依据。本实验采用高效液相色谱(HPLC)法,准确测定了药物在培养基中不同时间的含量变化情况,为准确考察药物对于细胞的毒性作用奠定了基础。
1 实验材料
1.1 试剂 马兜铃酸A对照品(天津一方科技有限公司,批号:200406);甲醇(色谱纯,天津市光复精细化工研究所);色谱分析用水(娃哈哈饮用纯净水,杭州娃哈哈集团有限公司);DMEM培养基(Gibco公司);胎牛血清(Hyclone公司),其余试剂均为分析纯。
1.2 仪器 LC-20AT高效液相色谱仪 (日本岛津);LC-solution色谱工作站 (日本岛津);SPD-20A紫外检测器(日本岛津);KQ-100A型超声波清洗器(昆山市超声仪器有限公司)。XW-80A微型旋涡混合仪(上海沪西分析仪器厂);XS204分析天平(METTLER TOLEDO)。
2 方法学考察
2.1 色谱条件 C18色谱柱(150 nm×4.6 nm,5 μm);流动相:甲醇-水(含 3%的冰醋酸)(70∶30,V/V);检测波长260 nm,柱温30℃,流速1 mL/min,进样量20 μL。
2.2 对照品储备溶液的配制 精密称取马兜铃酸A对照品10 mg,以甲醇溶解于100 mL容量瓶中,定容至刻度,即得浓度为0.1 g/L的马兜铃酸A对照品母液。
2.3 培养基样品预处理 将细胞培养基精密取出,加入3倍量甲醇,用涡旋仪涡旋30 s,再用10 000 r/min转速离心5 min,取上清液进样。
2.4 标准曲线的制备 取马兜铃酸A对照品储备溶液,配制成马兜铃酸 A 50,25,10,5,2.5,0.5 mg/L的系列溶液,分别进行测定。以峰面积(Y)对浓度(X)作线性回归,得线性范围和回归方程,见表1,图 1。

表1 培养基样品中的线性关系
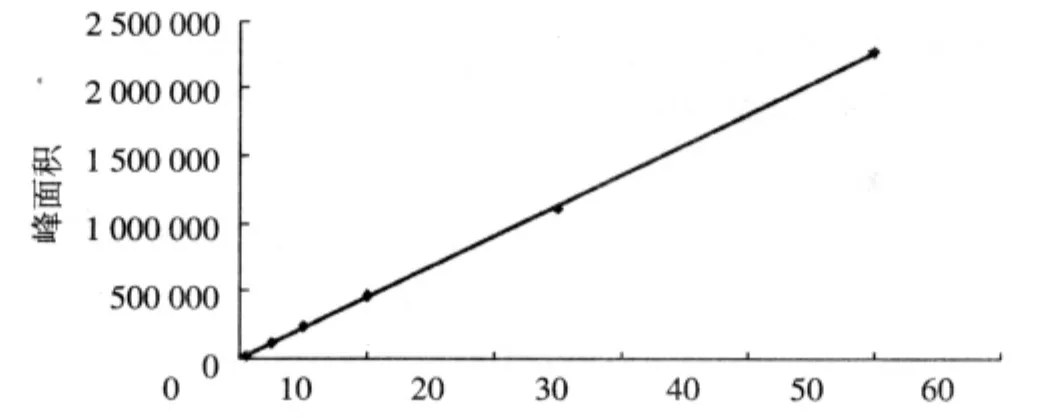
图1 马兜铃酸A标准曲线
2.5 精密度实验 配制马兜铃酸A同一浓度的对照品溶液,进行测定。每隔1 h测定1次,测6次,计算日内精密度;每隔1 d测定1次,测6 d,计算日间精密度。
实验结果表明,马兜铃酸A培养基中的日内、日间精密度相对标准偏差(RSD)分别为0.96%、1.92%,均符合要求。
2.6 回收率实验 配制马兜铃酸A低、中、高3个浓度的对照品溶液,加入200 μL空白培养基,按“培养基样品预处理方法”处理样品,分别进行测定。按照对照品测得量和加入量之比计算回收率。结果见表2。
表2 培养基样品中的回收率(s,n=3)
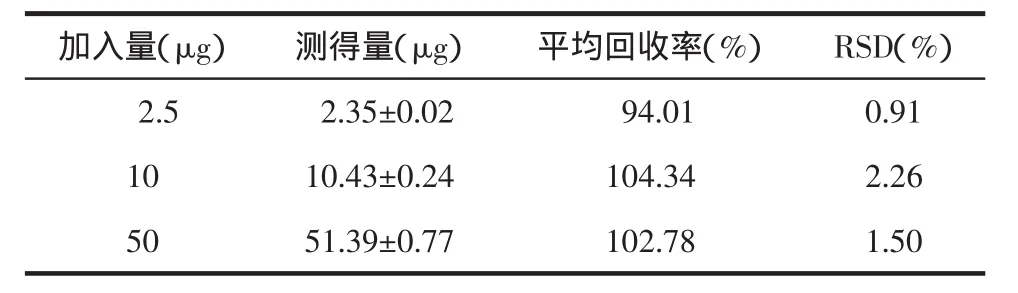
表2 培养基样品中的回收率(s,n=3)
加入量(μg)测得量(μg)平均回收率(%)RSD(%)2.5 2.35±0.02 94.01 0.91 10 10.43±0.24 104.34 2.26 50 51.39±0.77 102.78 1.50
实验结果表明,马兜铃酸A的低、中、高3种浓度在培养基中的回收率符合要求。
2.7 稳定性实验 取马兜铃酸A对照品储备溶液,配制成培养基样品中含马兜铃酸A 15 mg/L的溶液,按“培养基样品预处理方法”处理样品,将所配药液于冰箱中冷藏,分别在 0、1、2、4、8、12、24、36、48、72 h进行测定。以对照品测得量计算相对标准偏差。
实验结果表明,马兜铃酸A样品在72 h内RSD为1.96%,样品在72 h内基本稳定。
2.8 专属性实验 在2.1项下的色谱条件下,测定马兜铃酸A对照品、空白培养基及加药后培养基,色谱图,见图2-3。

图2 空白培养基色谱图

图3 加药后培养基色谱图
由图可知马兜铃酸A的保留时间约为4.7 min,空白培养基中的内源性物质不干扰马兜铃酸A在培养基中浓度的分析。
2.9 培养基中不同时间点样品含量变化测定 将马兜铃酸A加入含有培养基的6孔板,于37℃,5%二氧化碳(CO2)培养箱中培养,分别以不同时间点从含药6孔板中取出培养基[6],按“培养基样品预处理方法”处理样品,进行测定。以峰面积计算马兜铃酸A在培养基中不同时间的药物浓度。数据见表3,其药物浓度—时间曲线见图4。实验结果表明马兜铃酸A在本实验所用培养条件下72 h内含量基本稳定。
表3 马兜铃酸A在培养基中的浓度数据(s,n=3)
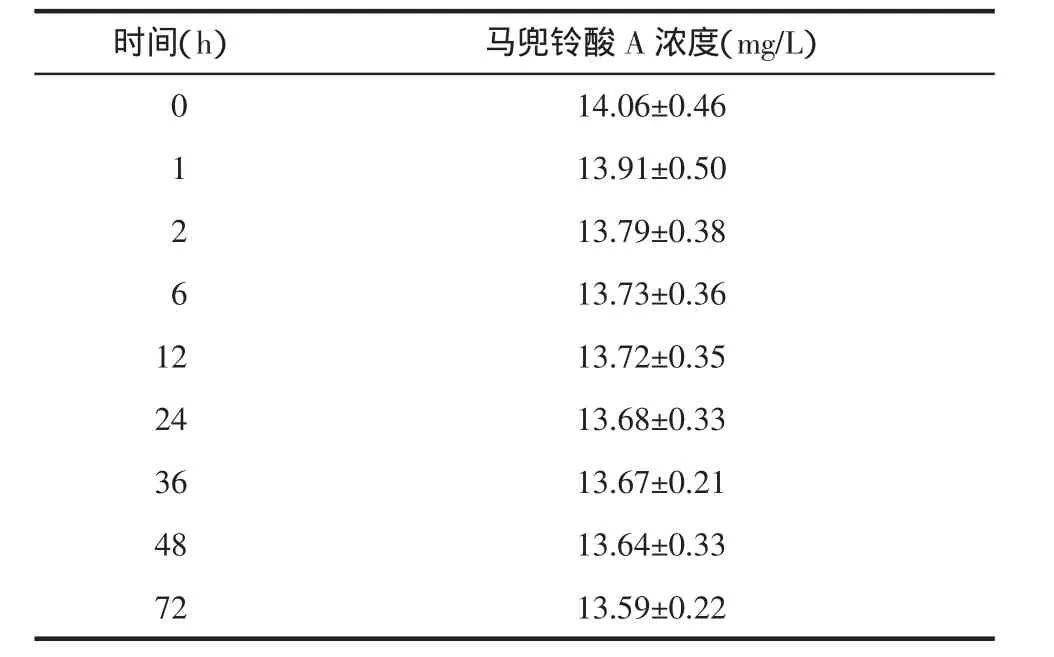
表3 马兜铃酸A在培养基中的浓度数据(s,n=3)
时间(h)马兜铃酸A浓度(mg/L)0 14.06±0.46 13.91±0.50 2 13.79±0.38 6 13.73±0.36 12 13.72±0.35 24 13.68±0.33 36 13.67±0.21 48 13.64±0.33 72 13.59±0.22 1
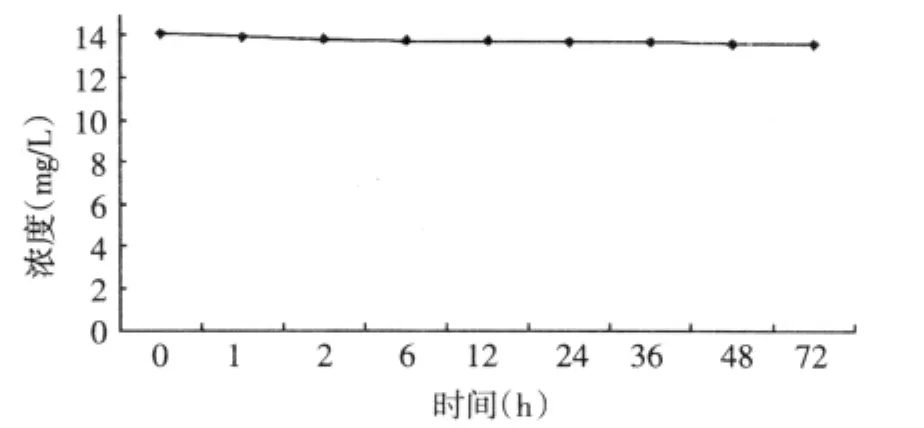
图4 马兜铃酸A在培养基中的药-时曲线
3 讨论
在考察培养基样品预处理方法时,比较了不同方法沉淀蛋白(甲醇、高氯酸)及乙醚提取法,实验结果表明高氯酸沉淀蛋白法及乙醚提取法回收率较低,甲醇直接沉淀蛋白法,回收率较高,可以满足检测要求,且操作简便快捷,故本实验采用甲醇作为沉淀试剂。
体外药理实验中,通常采用向含有细胞的培养基中多次加入一定浓度的药物以考察其对细胞的作用情况。因此,建立药物在培养基中的测定方法,搞清其在细胞培养基中的变化情况,将会对体外细胞培养实验具有重要的意义[7]。本实验采用DMEM培养基(含10%血清),pH约为7.4,本实验结果表明,在37℃,5%CO2的培养条件下72 h内马兜铃酸A在培养基中含量基本稳定,这对于以后实验中,药物作用时间及细胞换液时间的选择具有一定的参考意义。
本实验建立了高效液相色谱法测定细胞培养基中马兜铃酸A含量的方法,实验证明,本方法能够有效地测定药物在培养基中含量的变化情况,灵敏度高,重现性好,操作简便快捷,对准确考察马兜铃酸A对细胞的作用情况有指导意义。
[1]蒋贵仲,陈 灵.中药中马兜铃酸A的毒性研究进展[J].中国农学通报,2008,24(9):84-87.
[2]陈孟兰,朱正兰.马兜铃属植物的药理作用研究进展[J].武汉生物工程学院学报,2007,3(1):59-62.
[3]张万明,马淑兰.马兜铃酸A及含有马兜铃酸A中药的研究概述[J].河北北方学院学报,2007,23(6):35-38.
[4]张晓妍.马兜铃酸肾病实验研究近况[J].辽宁中医学院学报,2005,7(1):76-77.
[5]许勇芝,陈丽萍,刘华锋,等.马兜铃酸致肾小管上皮细胞损伤中p53和Caspase-3活性的变化[J].第四军医大学学报,2009,30(5):398-401.
[6]沈岳飞,罗杰峰,莫雪安,等.小鼠胚胎干细胞的分离培养与鉴定[J].广西医科大学学报,2006,23(1):43-45.
[7]李 越,杜 嵘,张艳军.高效液相色谱法测定人参皂苷Rg1与黄芩苷在细胞培养基中的含量变化[J].天津中医药,2006,23(2):160-162.
