脑内血管紧张素肽酶活性不对称性与大鼠行为偏侧的相关性☆
2011-06-02常崇旺吴鹤鸣孙继明葛顺楠耿宁王学廉
常崇旺 吴鹤鸣 孙继明 葛顺楠 耿宁 王学廉
血管紧张素肽酶(angiotensinase)的一种亚型AT4具有类似半胱氨酸氨基肽酶(cystinyl-AP,CysAP)的特性,与血管紧张素IV(ANG IV)结合具有高特异性和亲和力并参与记忆与认知加工[1-2]。海马是大脑内调节学习和记忆功能的重要区域。研究表明左侧海马的膜性丙氨酰氨基肽酶(membrane bound alanylaminopeptidase,MEM-AlaAP),可溶性半胱氨酸氨基肽酶(soluble bound cystinyl-aminopeptidase,SOL-CysAP)和膜性半胱氨酸氨基肽酶(membrane bound cystinyl- aminopeptidase,MEM-CysAP)占主导地位[3]。这些结果使氨基肽酶与记忆的关系得到进一步确认。另有研究表明,强烈的右手偏利比没有这种右手偏利被试的记忆力差[4]。这种偏侧行为与记忆的关系是否有着海马内氨基肽酶分布的内在联系?为探讨这一问题我们进行了如下实验。
1 材料与方法
1.1 研究对象 本实验方案通过第四军医大学伦理委员会批准。60只成年雄性Wistar大鼠(200~250g)购于第四军医大学实验动物中心。每5只安置于1个标准的聚丙烯笼子里。保持在12 h光线/12h(07:00~19:00)黑暗循环并给予充足的食物和水。
1.2 爪子偏好测试 爪子偏好测试根据Collins(1985)方法[5]进行了调整,大鼠入笼大概1周后实施爪子偏好实验。在两周内不同的日期测试4次,第一次为训练期,根据其他3次的平均评分分组,右利评分(RPE)≥29分,入右利爪(RH)组;若RPE≤21分,入左利爪(LH)组;若RPE在21至29之间则分入双利爪(L/R)组[4,6-7]。60 只大鼠经过测试后,RH 为36 只,LH 为8 只,L/R为16只。从以上3组大鼠中各随机抽取6只大鼠进行了RPE的行为学试验。
1.3 酶提取和测定 上述RPE行为学试验的3组大鼠进行了酶提取和测定测试。组织样本采集根据Banegal等人(2005)的研究设计[3]进行。RPE实验结束1周后,在equithensin麻醉下,通过左心室给大鼠脑内注入盐水(2 mL/kg),将左右海马的脑组织在干冰保护下解剖并快速取走(<60 s),并将左右海马组织分别匀浆化后再分别放入相同体积的10 mmol/L盐酸三羟甲基氨基甲烷(HCL-Tris)缓冲液中(PH=7.4),并分别超高速离心(10000 r/min,30 min,4℃)后将离心液上层的液体取出用于测定膜性丙氨酰氨基肽酶(soluble bound alanyl-aminopeptidase,SOL-AlaAP)/SOL-CysAP 和 MEM-AlaAP/CysAP 的活性和蛋白质含量。酶测定方法根据Banegal等人(2005)的研究设计[3]进行。以β酰胺基萘酰胺为底物用荧光分析法测定AlaAP和CysAP水平(一式三份)[8-9]。每份上清液在底物溶液中25℃恒温孵育30 min,加入醋酸盐缓冲液(1mL,0.1mol/L,PH=4.2)终止反应。在酶的作用下β萘酰胺被释放出来,用荧光分析测量412nm(发射波长)和345nm(激发波长)。利用BSA标准法测蛋白定量(一式三份)[10]。以每分钟每毫克蛋白来表达特定可溶的或膜性AT4的活性,荧光分析与水解时间和蛋白质含量线性相关[3]。
1.4 被动逃避行为测试 从3组不同用爪偏好的大鼠中各随机选出8只大鼠(左利爪为全组大鼠),共24只大鼠进行了被动逃避行为测试。试验的盒子包括一个亮室和一个暗室,由中间靠下的一个滑动门分开,第一天将大鼠放入亮室面对暗室,使其适应5 min后,将中间的挡板去掉,大鼠可以进入暗室,若大鼠的四只爪子都进入暗室,即通过暗室地板对其进行电刺激,电流0.3 mA,30 V,持续时间2 s,间隔2 s,循环5次。在此过程中大鼠均可进入亮室以逃避负性刺激。第二天的基础过程与第一天一样,并记录第一次从亮室进入暗室的潜伏期,定义为“记忆维持(memory retention)”。大鼠进入暗室所用时间记录为“进入时间(entrance)”。如果大鼠在10s电刺激内不离开暗室,则将大鼠取出,如果大鼠没有在5min内进入暗室,则认定潜伏期为300 s。
1.5 统计分析 采用SPSS13.0进行统计分析。通过以下公式计算右侧支配率(%R/T)=右半球/(右半球+左半球)×100%。采用单因素方差分析,双因素方差分析,邓肯检验(Duncan Test),配对t检验和Pearson’s相关性分析来进行组间及组内数据的差异分析及相关性分析。检测水准α=0.05。
2 结果
2.1 爪子偏好试验的行为结果LH,R/L,RH 3组大鼠,每组各6只,LH组的RPE均数为12.2±1.2,R/L组的RPE均数为25.2±0.8,RH组的RPE均数为35.8±1.5。经邓肯检验3组之间差异有统计学意义(P<0.01);左爪偏好与右爪偏好差异有统计学意义(P<0.05)。3组大鼠RPE单向方差分析显示了行为偏侧化的显著效应 (F=616.748,P<0.05)。
2.2 大鼠左右海马的AlaAP/CysAP活性 进行了右利爪行为测试的大鼠进行了酶提取和测定试验。这里显示的是不考虑行为偏侧化条件下的所有老鼠左侧和右侧海马的AlaAP/CysAP的活性。如表 1示,左侧海马的 SOL-AlaAP/CysAP和 MEMAlaAP/CysAP活性较右侧高(P<0.05)。
2.3 不同用爪偏好大鼠左右海马的AlaAP/CysAP的活性 见表2。3组大鼠左侧海马的SOL-CysAP和MEM-AlaAP/CysAP活性均较右侧高(P<0.05)。行为偏侧化与左右侧海马氨基肽酶活性的相互作用仅仅在 SOL-CysAP[F(2,30)=46.606,P <0.05]和 MEM-CysAP[F(2,30)=3.762,P <0.05]是有统计学意义的。个体组间比较揭示L/R大鼠左侧海马的SOL-AlaAP活性比RH或者LH的大鼠高(P<0.05),MEM-AlaAP的活性比RH大鼠高(P<0.05)。LH大鼠左侧海马SOL-CysAP和MEM-CysAP活性较L/R大鼠或RH大鼠高(P<0.05)。L/R大鼠右侧海马SOL-AlaAP/Cy-sAP和 MEM-AlaAP/CysAP活性较 LH 或 RH 大鼠高(P<0.05)。

表1 实验组大鼠左右侧海马的SOL-AlaAP/CysAP和MEM-AlaAP/CysAP活性及差异检验(n=18)nmol/(min.mg)
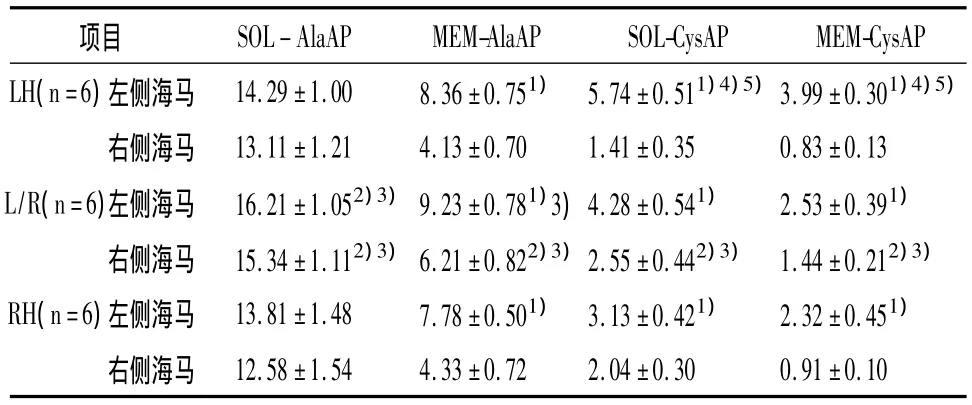
表2 不同爪偏好大鼠左右侧海马的SOL-AlaAP/CysAP和MEM-AlaAP/CysAP活性及差异检验nmol/(min.mg)
2.4 大鼠海马CysAP/AlaAP的%R/T活性 行为偏侧化对海马区 SOL-AlaAP[F(2,17)=0.105]的活性没有影响(P >0.05)(图1),而对 MEM-AlaAP[F(2,17)=18.151,P <0.05]的%R/T活性具有影响。两组间的个体比较显示L/R大鼠MEM-AlaAP和SOL-CysAP的活性高于RH和LH的大鼠(P<0.05)。L/R老鼠的 MEM-AlaAP[F(2,17)=18.151,P <0.05]的%R/T 活性也高于RH和LH的大鼠(P<0.05)。
2.5 大鼠个体之间CysAP/AlaAP活性的%R/T及RPE分数的相关性 SOL-AlaAP和MEM-AlaAP和RPE评分的相关没有统计学意义。而 RPE 评分与 SOL-CysAP[F(r= -0.904,n=18,P <0.05)和 MEM-CysAP[F(r= -0.500,n=18,P <0.05)成一种负相关关系。表明行为选择和半球不对称性与大鼠海马区内CysAP的活性密切相关。
2.6 大鼠被动逃避行为测试的结果被动逃避行为测试的结果显示(图2),分组对大鼠进入暗室的潜伏期的影响不显著。但是在各组之间对照显示LH的大鼠进入暗室的潜伏期显著高于RH的大鼠(P<0.05)。
3 讨论

图1 左爪偏好(LH)、双爪偏好(L/R)及右爪偏好(RH)大鼠优势半球的 R/T及 SOL-AlaAP/CysAP和 MEM-AlaAP/CysAP活性比较(n=18)。柱形图上的垂直线表示标准差异,*表示P<0.05(经邓肯检验)
本研究的目的是发现行为偏侧化与大脑内血管紧张素酶AlaAP和CysAp(特别是CysAp,即AT4)活性的关系。我们的数据提示AT4的活性与个体优势爪的评分成一种负相关关系。
AT4 以优先结合 ANGIV 为特点[1,11-12],这种 ANG IV/AT4 系统在与认知和记忆过程相联系的大脑结构中非常重要:首先,研究发现大鼠、豚鼠和猴子的海马内均具有AT4受体高密度分布的区域,而海马区与记忆密切相关[13-14]。其次,有报告指出脑室内注射ANGIV可以影响海马功能,因为这可以选择性激活海马区内锥体细胞和颗粒细胞的c-Fos免疫应答反应[15-16]。第三,对抗AT4受体可以破坏大鼠联合与空间记忆的维持而ANGIV可以易化这些过程[11]。这些结果强烈提示海马区血管紧张素酶(AlaAP和CysAp)在学习和记忆的调节过程中有重要作用。

图2 左爪偏好(LH)、双爪偏好(L/R)及右爪偏好(RH)大鼠的被动逃避行为测试结果(n=24)。时间(秒,s)表示大鼠进入暗室的时间及进入暗室的潜伏期的时间。柱形图上的垂直线表示标准差异,*表示P<0.05(经邓肯检验)。
然而AT4受体的本身和其配体调节其反应的机制迄今仍不明确[1]。我们发现左侧海马区有较高的AlaAP和CysAP活性水平,提示相对重要的功能分布于左侧。典型的大脑偏侧优势与左脑的语言优势相联系,在此研究拥有较高水平AT4活性的左侧海马在易化学习和记忆中可能比右侧海马更为重要。AT4成分与大脑偏侧化相联系。我们一般的认为LH大鼠有右脑优势,RH大鼠有左脑优势,此研究发现LH大鼠相比于RH大鼠在左侧的海马区内有较高的CysAP水平。但并没有在LH大鼠和RH大鼠右侧海马发现显著差异。
用优势爪实验研究偏侧化可使偏侧化研究量化和客观。此研究揭示海马活性半球优势同侧水平的优势爪之间的关系。第一次显示了AT4活性左右侧海马的差异性与个体RPE评分的线性负相关性。即AT4活性的左右侧差异越大则个体的RPE评分越低,LH大鼠的AT4活性的左右侧差异最大。
被动逃避行为是测试长期记忆的一个指标。在此研究中,LH大鼠表现出来的记忆维持时程长于RH大鼠,根据行为偏侧化条件下AlaAP和CysAP活性总的结果,我们认为LH大鼠的AT4活性更高而且表现的脑记忆功能更优秀。
左侧海马区较右侧海马区AlaAP和CysAP的活性水平高,同时CysAP活性的不对称与大鼠行为的方向和强度密切相关。我们仅仅初步了解了AT4活性到优势爪通路的现象,对其可能的作用、效应等需后续研究进一步证实。
[1]Albiston AL,McDowall SG,Matsacos D,et al.Evidence that the angiotensin IV(AT4)receptor is the enzyme insulin-regulated aminopeptidase[J].J Biol Chem,2001,276(52):48623 –48626.
[2]Albiston AL,Mustafa T,McDowall SG,et al.AT4 receptor is insulin-regulated membrane aminopeptidase:potential mechanisms of memory enhancement[J].Trends Endocrinol Metab,2003,14(2):72–77.
[3]Banegas I,Prieto I,Alba F,et al.Angiotensinase activity is asymmetrically distributed in the amygdala,hippocampus and prefrontal cortex of the rat[J].Behav Brain Res,2005,156(2):321 –326.
[4]Lyle KB,McCabe DP,Roediger HL.Handedness is related to memory via hemispheric interaction:evidence from paired associate recall and source memory tasks[J].Neuropsychology,2008,22(4):523–530.
[5]Collins RJ.On the inheritance of direction and degree of asymmetry cerebral lateralization in nonhuman species[J].New York:Academic Press,1985:41–71.
[6]Betancur C,Neveu PJ,Le Moal M.Strain and sex differences in the degree of paw preference in mice[J].Behav Brain Res,1991,45(1):97–101.
[7]Fu QL,Shen YQ,Gao MX,et al.Brain interleukin asymmetries and paw preference in mice[J].Neuroscience,2003,116(3):639–647.
[8]Alba F,Ramirez M,Iribar C,et al.Asymmetrical distribution of aminopeptidase activity in the cortex of rat brain[J].Brain Res,1986,368(1):158–160.
[9]Greenberg LJ.Fluorometric measurement of alkaline phosphatase and aminopeptidase activities in the order of 10 – 14 mole[J].Biochem Biophys Res,1962,9(1):430–435.
[10]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein–dye binding[J].Anal Biochem,1976,72:248 – 254.
[11]Wright JW,Harding JW.Brain angiotensin receptor subtypes AT1,AT2,and AT4 and their functions[J].Regul pept,1995,59(3):269–295.
[12]Lambert DW,Clarke NE,Turner AJ.Not just angiotensinases:new roles for the angiotensin-converting enzymes[J].Cell Mol Life Sci,2010,67(1):89-98.
[13]Wright JW,Miller-Wing AV,Shaffer,MJ,et al.Angiotensin II(3–8)(ANG IV)hippocampal binding:potential role in the facilitation of memory[J].Brain Res Bull,1993,32(5):497 -502.
[14]柳华,刘鸣,李光明等.血管紧张素转换酶基因插入缺失多肽性与血管性痴呆关系的Meta分析[J].中国神经精神疾病杂志,2008,34(11):679 -683.
[15]Roberts KA,Krebs LT,Kramar EA,et al.Autoradiographic identification of brain angiotensin IV binding sites and differential c-Fos expression following intracerebroventricular injection of angiotensin II and IV in rats[J].Brain Res,1995,682(1 -2):13 -21.
[16]Haulicǎ I,Bild W,Rǎdǎşanu O.Biosynthesis and physio-pharmacological actions of angiotensin peptides:1.Synthetic enzymes[J].Rev Med Chir Soc Med Nat Iasi,2006,110(1):167 -172.
