立体定向移植骨髓间充质干细胞对脑缺血再灌注模型大鼠的治疗作用☆
2011-06-02曹文锋王卫真高幼奇杨赟张洪连刘诗英何丹吴晓牧
曹文锋 王卫真 高幼奇 杨赟 张洪连 刘诗英 何丹 吴晓牧
研究骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)治疗脑梗死已有半个世纪之久,且取得了一定的成果即证实BMSCs对脑梗死所致神经功能缺失具有一定的改善作用[1-4]。虽然BMSCs治疗脑梗死的途径主要有静脉、动脉和立体定向途径,但立体定向途径因其操作过程较复杂且技术性高是目前研究最少的一种途径。同时,BMSCs治疗脑梗死的具体作用机制目前还不是很清楚,故本文研究立体定向途径移植BMSCs对脑梗死模型大鼠的疗效并进一步探究其作用机制。
1 材料与方法
1.1 BMSCs的体外培养、Brdu标记及鉴定 2~4周龄的SD大鼠(上海西普尔-必凯实验动物有限公司),游离双侧后肢股骨和胫骨,用含10%FBS(Hyclone)的DMEM/F12(1∶1)(Sigma)培养基冲洗骨髓腔,然后直接接种于培养瓶。第2代(p2)的BMSCs在移植前用10 μmol/L的Brdu(Sigma)孵育48 h以示踪标记,同时在体外用直接免疫荧光检测上述BMSCs的Brdu标记率。流式细胞术检测p2期BMSCs的表面抗原 CD29、CD106、CD45、CD 90、CD11b(Biolegend)、CD 34(Santa Cruz)阳性细胞数。
1.2 MCAO模型的建立与分组 10%水合氯醛麻醉大鼠,钝性分离右侧的颈总动脉、颈内动脉和颈外动脉,然后用直径0.26 mm的尼龙线从颈外动脉插入,再穿过颈内动脉直至大脑中动脉(MCA)的起始处,进线深度约17~18 mm,阻断MCA血供2 h后再拔出尼龙线恢复再通。按随机数字表将14只成年SD大鼠分成BMSCs组(n=8)和PBS组(n=6)。
1.3 BMSCs移植 建模后7 d,再次麻醉大鼠,固定于立体定向仪上(淮北正华生物仪器设备有限公司),用牙科钻在右侧颅顶钻A、B、C三孔[A孔:正中线偏右(R)3 mm,前囟前(AP)+2 mm,硬脑膜下(DV)3 mm;B孔:R 3 mm,AP+0.5 mm,DV 5 mm;C孔:R 3 mm,AP -1.0 mm,DV 3 mm],用微量泵(上海高鸽工贸有限公司)缓慢注射3×106BMSCs/15 μLPBS(A孔4 μL,B 孔7 μL,C 孔4 μL),注射完后针停留5 min 再缓慢拔出,骨蜡封闭钻孔缝合伤口。PBS组注射15 μLPBS。术后大鼠未给予免疫抑制药和抗生素。
1.4 行为功能学评分及体重比较 大鼠于建模前和建模后1、7、14、21、28、35 d 分别进行以下检查:①粘附实验[2],建模前训练3 d,如果能在10 s内撕下粘纸则开始建模;② mNSS评分[2],建模后1 d mNSS评分为7~12分的大鼠纳入本实验;③记录大鼠的体质量。
1.5 脑梗死体积的测量 建模后35 d处死大鼠,4%多聚甲醛灌注取脑,并固定48 h。用脑槽沿冠状位将脑连续切成厚度均为2 mm的7块,再脱水、透明、浸蜡、最后包埋成蜡块。每个蜡块每隔54 μm切一张6 μm厚的切片做HE染色,然后用ipwin32图像分析软件(武汉千屏影像技术有限责任公司)计算脑梗死体积(对侧脑半球体积减去梗死侧脑半球体积再除以对侧脑半球体积)。
1.6 组织学和免疫组织学染色 选择前囟位置的蜡块(即脑梗死中心部位),切数张4~6 μm厚的切片进行以下染色:①Bielshowsky's-Luxol Fast Blue staining双染:切片常规脱蜡至水,置于10%AgNO3避光15 min,氨水还原,甲醛显色,硫代硫酸钠分化和固定,然后再置于1%the luxol fast blue(Sigma)染液56℃过夜,95%酒精漂洗,0.005%Li2CO3和70%酒精分化,焦油紫(New Jersey)复染,最终神经轴突和髓鞘分别染成为黑色和蓝色;②免疫组织荧光:2N HCl 30 min裂解双链 DNA,5%BSA 封闭 1 h,Rabbit anti-Brdu(1∶150,北京博奥森生物技术有限公司)4℃过夜;③免疫组织化学:3%H2O2灭活,柠檬酸缓冲液(pH6)高压修复5 min,一抗4℃过夜,包括抗 Ki-67(1∶200)和 GFAP(1∶400)(北京中杉金桥),抗 Nogo-A(1∶1000)、NSE(1∶250)、VEGF(1∶1200)和 SYN(1∶400)(abcam 公司),滴加二抗和DAB显色(二步法兔免疫组化检测试剂盒,北京中杉金桥),按照说明书操作。
1.7 图片采集与计数 采用医学图像分析系统分别对Bielshowsky's-Luxol Fast Blue staining双染、免疫组化和免疫荧光的组织切片按如下条件采图与计数:①测量脑缺血半暗带区(IBZ区)(40×物镜)NSE、Nogo-A、VEGF、SYN、GFAP、Brdu 的阳性细胞数;②测量脑室管膜下区(SVZ区)6个区域(40×物镜)Ki-67的阳性细胞数;③测量IBZ区6个区域(10×物镜)胶质瘢痕的厚度。
1.8 统计学方法采用SPSS 16.0统计学软件,数据用±s表示,用t检验分析数据,检验水准α=0.05。
2 结果
2.1 BMSCs体外形态、Brdu标记及鉴定 BMSCs在体外成集落式贴壁生长,形态呈不规则梭形。第二代BMSCs用含有10 μmol/L的Brdu培养基孵育48 h后阳性细胞率达96.3%。流式细胞术鉴定结果:高表达CD90、CD29,中度表达 CD106,低表达 CD34、CD45、CD11b。
2.2 行为功能学评分及体质量比较 BMSCs组大鼠在脑梗死后35 d的体质量显著高于PBS组(图1A),28 d的mNSS评分和粘附实验的撕纸时间明显低于PBS组(图1B、C)。
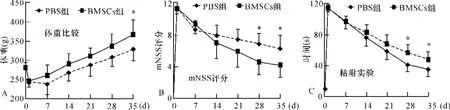
图1 行为功能学评分及体质量比较。A:体质量比较;B mNSS评分;C:粘附实验;PBS组与BMSCs组比较*P<0.05
2.3 Bielshowsky's-Luxol Fast Blue双染 髓鞘和轴突分别染成蓝色和黑色。建模后35 d,脑组织梗死侧可见液化腔形成,IBZ区神经纤维再生增强,且BMSCs组的神经纤维的再生能力优于PBS组(图2A、B)。
2.4 脑组织中Brdu标记的 BMSCs BMSCs组IBZ区可见大量 Brdu+-BMSCs,数量约为(239.12+35.59),同时可见少量胞浆呈阳性的大细胞,可能是巨噬细胞吞噬降解坏死的BMSCs后Brdu在胞浆内沉积的结果。BMSCs组梗死对侧和PBS组未见Brdu+-BMSCs(图3A、B)。
2.5 组织免疫化学检测和脑梗死体积 ①BMSCs组与PBS组比较,IBZ区 GFAP阳性细胞数(51.38±7.37)显著升高 PBS组(41.33±9.03,P<0.05)(图4A,B),IBZ外侧区的胶质瘢痕厚度(141.00±28.00 mm)与PBS组(156.00±41.00)比较无统计学差异(P>0.05,图4C,D);②BMSCs组的脑梗死体积百分比(30.30±3.53)与PBS组(33.00±2.18)比较无统计学差异(P>0.05);③BMSCs组IBZ区的Nogo-A阳性细胞数(43.12±7.06)显著低于PBS组(53.00±7.32,P <0.05)(图 5A,F);④BMSCs组 IBZ区的VEGF阳性细胞数(27.12±2.48)显著高于 PBS组(16.17±5.85,P<0.05)(图4B,G);⑤BMSCs组 IBZ区的SYN阳性细胞数(70.00±7.29)显著高于PBS组(53.00±5.44)(图4C,H);⑥BMSCs组 IBZ 区的 NSE阳性细胞数(30.88±4.36)与PBS组(26.50±4.55)比较无统计学差异(P>0.05,图4D,I);⑦BMSCs组脑室管膜下区(SVZ区)Ki-67阳性细胞数(28.00±5.47)显著高于 PBS组(20.00±4.94,P<0.05)(图4E,J)。

图2 Bielshowsky's-Luxol Fast Blue双染。A:PBS组;B:BMSCs组;标尺 =100 μm
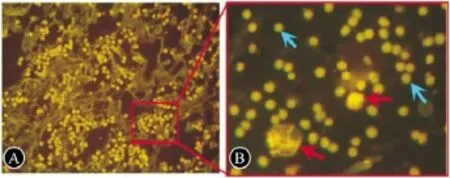
图3 IBZ区Brdu+-BMSCs(免疫荧光染色)。A:100X;B:红箭头为死亡的BMSCs,蓝箭头为存活的BMSCs(400×)
3 讨论
BMSCs是存在于骨髓中的一系列基质干细胞的混合群体。研究证实BMSCs具有向外胚层来源的神经系细胞定向分化和分泌多种神经营养因子的潜能[5-6],且具有取材方便、易培养、低免疫原性、不存在伦理问题等优点[7]。因此,选择BMSCs移植治疗脑梗死具有极大的可行性和优越性。
BMSCs移植入体内后在脑组织中具体存活量和时间与其疗效的长短密切相关。有学者发现静脉移植BMSCs治疗脑梗死大鼠14 d后脑组织中约有14%的细胞存活且神经功能明显好转[8],而动脉移植14 d后约有20%的细胞存活且对脑梗死的疗效较前者稍好[9],本文立体定向移植3×106BMSCs治疗脑梗死大鼠35 d后约有35%的移植细胞存活且神经功能改善明显,虽可见部分细胞坏死并被巨噬细胞吞噬降解。相关学者研究发现BMSCs对脑梗死的疗效至少可维持一年,且1年后大脑内仍有BMSCs存活[2]。
研究发现脑梗死后3 h、6 h、24 h等急性期内移植BMSCs能显著缩小脑梗死体积[1,10-11],但脑梗死后 4 d、7 d、14 d、30 d等急性期后移植 BMSCs,脑梗塞体积与对照组比较未见明显缩小[10,12-13]。因此,BMSCs 治疗脑梗死能否缩小梗死体积可能与移植时间窗密切相关。急性期因缺血半暗带区部分神经组织损伤为可逆性,BMSCs自分泌或促使内源性细胞分泌多种营养因子可挽救该部分神经组织,进而缩小梗死体积[4,10,14]。急性期后神经组织损伤已不可逆,故本文脑梗死后7 d移植BMSCs,虽然行为学功能获得显著好转,但脑梗死体积未见缩小。
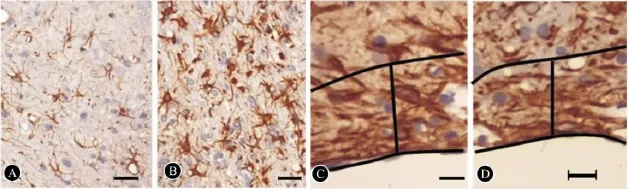
图4 IBZ 区GFAP 阳性细胞数和胶质瘢痕厚度。A、C:PBS组,B、D:BMSCs组;标尺:A、B 为100 μm,D、E 为50 μm

图5 Nogo-A、VEGF、SYN、NSE、Ki-67阳性细胞数(免疫组化)。A ~E:BMSCs组;F~J:PBS组;标尺 =100 μm
BMSCs在脑组织中相当于微型的“生物分子工厂”,自分泌以及促使实质细胞如星形胶质细胞分泌大量细胞因子,主要有抗炎症反应因子如IL-10、IL-6[14],神经营养因子如 BDNF、NGF、bFGF、VEGF,以及免疫调节因子[4,10]。这些细胞因子在脑梗死早期主要起神经保护作用,而在脑梗死晚期则主要是增强神经组织的内源性修复,包括增加IBZ区新生血管形成,激活内源性神经干细胞或前体细胞(NSPCs)的增殖分化,增强神经轴突和髓鞘的生长,缩小胶质瘢痕厚度等[2,9,11-13]。本文发现 BMSCs 治疗后,SVZ 区的增殖细胞核抗原Ki-67阳性细胞数明显增多,同时IBZ区GFAP表达率升高,同样证实了 BMSCs能够增强NSPCs和星形胶质细胞的增殖,以参与神经功能的恢复。
脑梗死急性期大鼠的行为功能受损明显,虽缺失的神经功能具有一定的自我恢复能力,但空间非常有限,主要原因是中枢神经系统(CNS)的少突胶质细胞分泌的Nogo-A和星形胶质细胞在病灶周边形成的胶质瘢痕对轴突和髓鞘的生长具有抑制作用[15-16]。本文发现BMSCs治疗后少突胶质细胞细胞分泌的Nogo-A明显减小,但病灶边缘的胶质瘢痕厚度并未缩小。其他学者发现移植BMSCs治疗脑梗死1年后IBZ区Nogo-A的表达显著降低,而且胶质疤痕厚度缩小[2]。这种差异的可能原因为本文观察时间较短(35 d),未达到BMSCs缩小胶质瘢痕厚度所需时间。本文采用Bielshowsky-Luxol Fast Blue staining双染证实BMSCs治疗后IBZ区的神经纤维(轴突与髓鞘)再生增强。因此BMSCs通过衰弱Nogo-A和胶质瘢痕对神经纤维生长的抑制作用,增强神经纤维再生和新的突触联系的建立,参与改善神经功能。
总之,本文证实立体定向途径移植BMSCs能改善脑梗塞大鼠受损的神经功能,并其治疗机制包括增强内源性细胞增殖、突触重建、神经纤维修复和星形胶质细胞保护作用等。
[1]Liu ZW,Li Y,Zhang XG,et al.Contralesional axonal remodeling of the corticospinal system in adult rats after stroke and bone marrow stromal cell treatment[J].Stroke,2008,39(9):2571 -2577.
[2]Shen LH,Li Y,Chen JL,et al.One-year follow-up after bone marrow stromal cell treatment in middle-aged female rats with stroke[J].Stroke,2007,38(7):2150 -2156.
[3]Sasaki M,Radtke C,Tan AM,et al.BDNF-hypersecreting human mesenchymal stem cells promote functional recovery,axonal sprouting,and protection of corticospinal neurons after spinal cord injury[J].J.Neurosci,2009,29(47):14932 -14941.
[4]Dong IJ,Jeongim H,Byeong TK,et al.A comparison of autologous and allogenic bone marrow-derived mesenchymal stem cell transplantation in canine spinal cord injury[J].J Neurol Sci,2009,285(1-2):67-77.
[5]Peng J,Wang Y,Zhang L,et al.Human umbilical cord Wharton’s jelly-derived mesenchymal stem cells differentiate into a Schwann-cell phenotype and promote neurite outgrowth in vitro[J].Brain Res Bull,2011,84(3):235 -243.
[6]Lim JY,Park SI,Kim SM,et al.Neural differentiation of brainderived neurotrophic factor-expressing human umbilical cord bloodderived mesenchymal stem cells in culture via TrkB-mediated ERK and β-catenin phosphorylation and following transplantation into the developing brain[J].Cell Transplant,2011,3(3):21 -39.
[7]Ringden O,Blanc KL.Mesenchymal stem cells for treatment of acute and chronic graft-versus-host disease,tissue toxicity and hemorrhages[J].Best Pracct Res Cl Ha,2011,24(1):1 - 8.
[8]Chen J,Li Y,Wang L,et al.Therapeutic benefit of intracerebral transplantation of bone marrow stromal cells after cerebral ischemia in rats[J].J.Neurol.Sci.2001,189(1 - 2):49 - 57.
[9]Li Y,Chen J,Wang L,et al.Treatment of stroke in rat with intracarotid administration of marrow stromal cells[J].Neurology,2001,56:1666-1672.
[10]Toyama K,Honmou O,Harada K,et al.Therapeutic benefits of angiogenetic gene-modified human mesenchymal stem cells after cerebral ischemia[J].Exp Neurol,2009,216(1):47 - 55.
[11]Zheng W,Honmou O,Miyata K,et al.Therapeutic benefits of human mesenchymal stem cells derived from bone marrow after global cerebral ischemia[J].Brain Res,2010,1310(1):8 -16.
[12]Li Y,Chen JL,Zhang CL,et al.Gliosis and brain remodeling after treatment of stroke in rats with marrow stromal cells[J].Glia,2005,49(3):407-417.
[13]Shen LH.,Li Y,Chen J,et al.Therapeutic benefit of bone marrow stromal cells administered 1 month after stroke[J].J Cereb Blood Flow Metab,2007,27:6-13.
[14]Kim J,Hematti P.Mesenchymal stem cell-educated macrophages:a novel type of alternatively activated macrophages[J].Exp Hematol,2009,37(12):1445-1453.
[15]Yiu G,He ZG.Glial inhibition of CNS axon regeneration[J].Nat Rev Neurosci,2006,7(8):617 -627.
[16]Huber AB,Weinmann O,Brosamle C,et al.Patterns of Nogo mRNA and protein expression in the developing and adult rat and after CNS lesions[J].J.Neurosci 2002,22(9):3553 -3567.
