模板法结合溶剂热法制备SnO2多孔球体
2011-06-01薛寒明邵光杰张柳丽许晓娟
薛寒明,邵光杰,2,张柳丽,许晓娟
(1.燕山大学环境与化学工程学院,河北秦皇岛 066004;2.亚稳材料制备技术与科学国家重点实验室,河北秦皇岛 066004)
体积变化引起电极的“粉化”或“团聚”,造成比容量衰减、循环稳定性下降[1],制约了SnO2负极材料的应用。在改善SnO2循环性能方面,人们将注意力放在超细纳米材料或有特殊空间形态材料的制备上,合成了一维结构的纳米线[2]、纳米棒[3]、纳米管[4],以及二维结构的纳米薄膜[5]等。
本文作者采用模板法结合溶剂热法,利用葡萄糖脱水碳化和SnCl4水解,合成零维(在三维空间上均处于纳米尺度)[6]球形SnO2纳米颗粒,并使纳米单元集合形成几何结构完整的三维多孔球体。制备具有纳米尺度的多孔结构材料,有望在整体上改善SnO2的电化学性能,提高容量保持率。
1 实验
1.1 材料的制备
将20 mmol葡萄糖(天津产,AR)和8 mmol SnCl4(成都产,AR)溶解到20 ml水和50 ml乙醇(天津产,AR)的混合液中,形成无色透明溶液,在高压反应釜(威海产)中、180℃下恒温反应24 h,冷却至室温。将黑褐色沉积物用水和乙醇洗涤数次,再在50℃下干燥12 h,得到SnO2/C前驱体;再将前驱体放入SG2-3-10型坩埚电阻炉(天津产)中,在空气中、550℃下焙烧5 h,得到淡黄色SnO2粉体。
1.2 物理性能分析
用D/Max-2500/pc型X射线衍射仪(日本产)分析物相,CuKα,λ=0.154 06 nm,管压 40 kV、管流 100 mA,扫描速度为 5(°)/min;用S-4800型场发射扫描电子显微镜(FESEM,日本产)观察粉末的形貌,加速电压为15 kV;用NOVA 4000e型比表面及孔径分析仪(美国产)对材料进行分析,氮气为吸附气体。
1.3 扣式电池的组装和电化学性能测试
将制备的活性物质SnO2、乙炔黑(上海产,电池级)和聚偏氟乙烯(上海产,电池级)按质量比 80∶10∶10,在N-甲基-2-吡咯烷酮(天津产,AR)中混合,涂覆于经120℃烘干的、0.010 mm厚的铜箔(天津产,电池级)上,在120℃下真空(真空度为-0.09 MPa)干燥12 h,冷却后辊压至 0.012 mm厚,裁剪成φ=14 mm的圆形电极片(含5~6 mg活性物质)。以上述极片为工作电极,金属锂片(秦皇岛产,电池级)为对电极和参比电极,1 mol/L LiPF6/EC+DMC(体积比1∶1,天津产,电池级)为电解液,Celgard 2500膜(日本产)为隔膜,在充满氩气的手套箱中组装CR2025型扣式电池。
用电池测试系统(武汉)进行充放电性能测试,电压为0.005~2.000 V。
2 结果与讨论
2.1 物理性能分析
图1为SnO2/C前驱体和SnO2的XRD图。
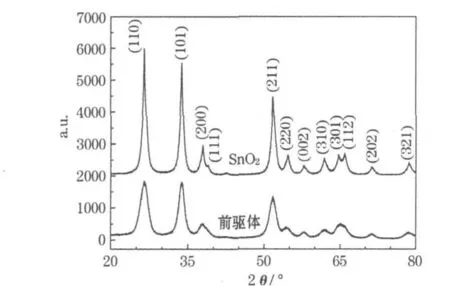
图1 SnO2/C前驱体和SnO2的XRD图Fig.1 XRD patterns of SnO2/C precursor and SnO2
将制备的SnO2/C前驱体的XRD图与标准卡(41-1445)对比,确定存在金红石型SnO2。峰形弥散,表明结晶度较差;半峰宽较宽,说明晶粒的粒径较小。由谢乐公式,计算出(110)晶面的粒径约为5.1 nm,没有碳的衍射峰,表明碳为无定形态。制备的SnO2衍射峰的位置、强度及晶胞参数(a=b=0.474 0 nm,c=0.318 7 nm)与标准卡的数据基本对应,且峰形较尖锐,无杂质峰,表明材料为纯净的四方晶系金红石型,空间点群为P42/mnm。由谢乐公式,计算出(110)晶面的粒径约为10 nm,焙烧后,晶粒增长,晶形趋于完整。
图2为SnO2/C前驱体和SnO2的FE-SEM图。

图2 SnO2/C前驱体和SnO2的FE-SEM图Fig.2 Field emission-scanning electron microscope(FE-SEM)photographs of SnO2/C precursor and SnO2
图2a中微小的白色点为SnO2纳米颗粒,SnO2吸附在无定形碳的连续相中,晶粒细小且发育不完整;从图2b、c可知,在空气中焙烧后,SnO2形成几何结构完整的三维多孔球体,球形度较好,粒度集中于 1~2 μ m,球体表面粗糙,球体之间有独立空间;从图2d可知,聚集形成球体的SnO2球形纳米颗粒,均匀光滑,粒径约为15 nm,颗粒之间有一定的间隙,且团聚不明显。在溶剂热反应中,SnCl4的水解和葡萄糖的脱水碳化同时发生,由于葡萄糖过量,水解在脱水碳化的小环境中发生。无定形碳表面存在—OH和CO 亲水基团,易将Sn4+吸附在表面,形成吸附着SnO2的无定形碳连续相。在空气中焙烧,无定形碳以CO2的形式释放,释放时的压力迫使SnO2颗粒聚集,同时SnO2颗粒结晶长大,失去碳的支撑,趋向于自由体积的减小,形成稳定的三维多孔球体结构。无定形碳作为模板,对控制产物球体结构的形成起关键作用。
对SnO2材料进行比表面及孔径分析,结果见图3。
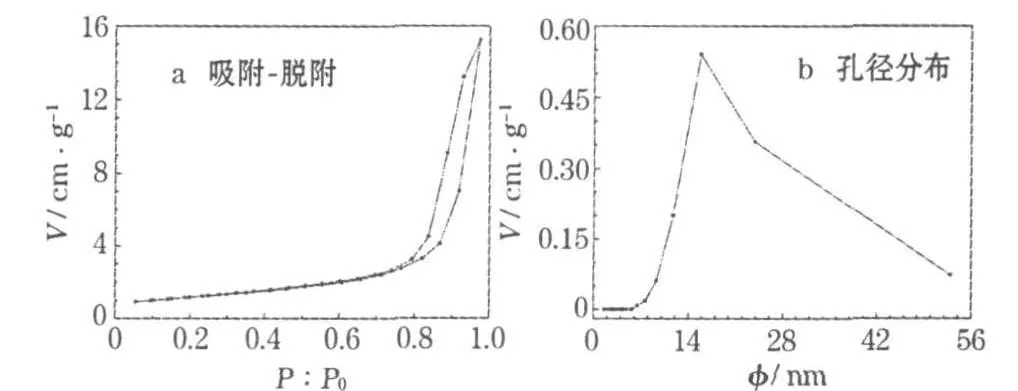
图3 SnO2的氮气吸附-脱附等温线和孔径分布曲线Fig.3 Nitrogen adsorption and desorption isotherms and poresize distribution curve of SnO2
从图3可进一步确定球体的多孔结构。球体的比表面积为36.41 m2/g,平均BJH孔径和孔容分别为15.8 nm和0.211 cm3/g。吸附等温线存在吸附滞后,呈现Ⅳ型等温线的特征,表明球体为中孔结构,孔径范围约为10~45 nm。
2.2 电化学性能分析
Li/SnO2电池和SnO2材料的0.1 C充放电性能见图 4。
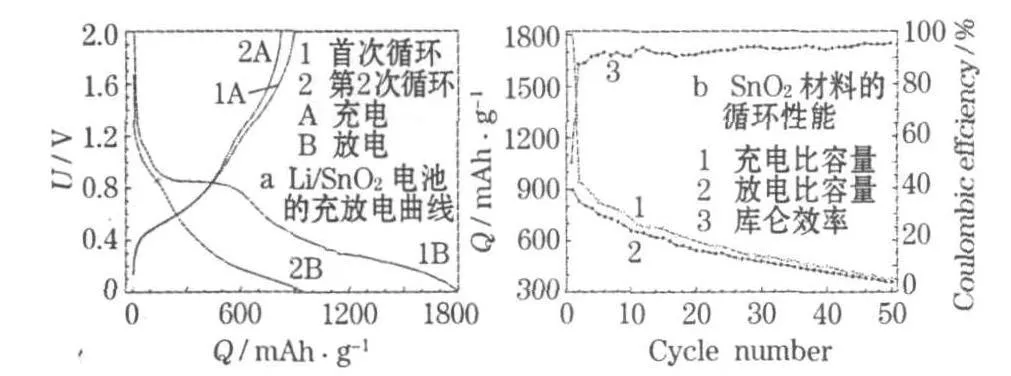
图4 0.1 C时Li/SnO2电池的充放电曲线和SnO2材料的循环性能Fig.4 Charge-discharge curves of Li/SnO2battery and cycle performance of SnO2material at 0.1 C
从图4a可知:Li/SnO2电池的首次放电电压迅速下降,在0.85 V左右相应出现一个放电特征平台。此平台在第2次循环时不再出现,对应Li与SnO2中的O形成Li2O和电解质分解在电极表面形成固体电解质相界面(SEI)膜消耗的Li;0.45 V处的平台是Sn实质嵌锂的特征平台,但不明显。I.A.Courtney等[7]认为:在放电过程中,锡与锂形成了多种合金,是可逆容量的主要来源,正是这一平台使SnO2成为高效的储锂材料。在首次充电曲线上,0.45 V左右有一个平台,对应去合金化,即Li+从电极材料中脱出的过程。生成的Sn分散在Li2O中,Li2O为Sn颗粒的均匀分散提供了良好的矩阵,可部分缓冲合金形成和分解时的体积变化。此平台的长短对应脱锂的多少。在1.3 V左右的一个小平台,由Li2O中少量 Li+脱出造成,说明Li2O有部分可逆[8]。
从图4b可知:材料的首次充电比容量达1 796.7 mAh/g,原因是SnO2的还原和SEI膜的形成消耗Li+,首次放电比容量为896.1 mAh/g,超过理论值 782 mAh/g。球体的中孔结构和一些晶格缺陷也能储存一些Li+,但不一定会脱出,造成首次库仑效率较低(49.87%)。从第4次循环开始,库仑效率保持在90%以上,说明材料的可逆性良好;第50次循环时,材料的放电比容量为 356.3 mAh/g,容量保持率为39.76%。SnO2纳米颗粒本身的比表面积较大,三维球体的多孔结构及球体之间的独立结构也可提供间隙空间,使Li+有效地嵌脱,并在一定程度上缓解嵌脱锂时的体积变化,优化SnO2颗粒与导电剂的接触,形成更有效的导电网络,增大SnO2与电解液的接触面积,缩短Li+的扩散路径。导体SnO2还原成金属Sn及形成Li-Sn合金,也增大了电子传导性。
SnO2材料在不同倍率下的循环性能见图5。
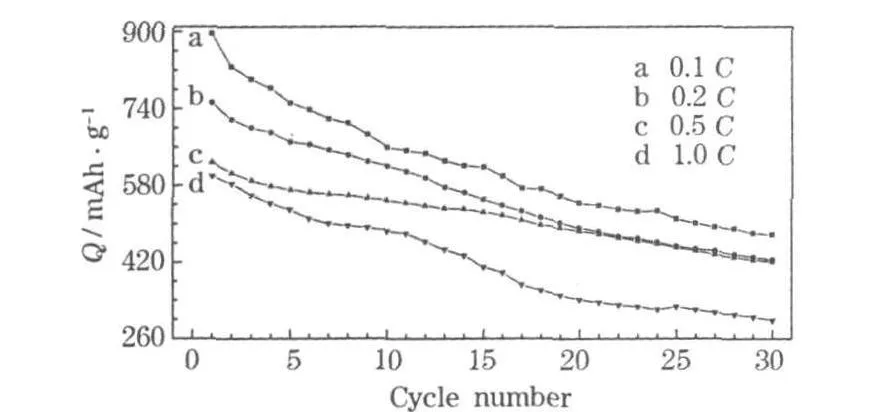
图5 SnO2材料在不同倍率下的循环性能Fig.5 Cycle performance of SnO2 material at differentrates
从图5可知:材料在较大的充放电电流时,仍有较高的比容量和较稳定的循环性能,原因是SnO2的多孔结构决定了材料具有较好的倍率性能。当电流为0.5 C时,经过30次循环,容量保持率为66.98%;当电流为1.0 C时,经过30次循环,容量保持率为49.72%。电流越小,电化学反应越接近于平衡条件,充放电比容量越大,但循环性能并未得到改善,原因是合金化-去合金化过程中,嵌入或脱出电极的Li+越多,产生的膨胀-压缩应力就越增大,造成极片的粉化,容量保持率相应降低。电流较大时,液相中Li+扩散速度很快,大量的 Li+快速到达极片表面,电极中Li+由外向内的扩散传输速度远小于表面Li+的供给速度,造成电极反应还未平衡时,两极之间的电势已经平衡,导致充放电比容量降低。
3 结论
采用模板法结合溶剂热法,利用葡萄糖脱水碳化和SnCl4水解,制备由零维球形SnO2纳米颗粒集合形成的几何结构完整的三维多孔球体。材料的比表面积为36.41 m2/g,平均BJH孔径和孔容分别为15.8 nm和0.211 cm3/g。制备方法工艺简单,产物形状可控、颗粒尺寸均匀。多孔球体结构使材料具有优良的可逆性和倍率性能,0.1 C首次充、放电比容量分别为1 796.7 mAh/g和896.1 mAh/g,超过理论比容量,从第4次循环开始,库仑效率均保持在90%以上;电流为0.5 C时,第30次循环的容量保持率为66.98%。
[1]QI Zhi(齐智),WU Feng(吴锋).SnO2超细粉的制备与嵌锂性能[J].Battery Bimonthly(电池),2005,35(4):268-269.
[2]Zhao N H,Yang L C,Zhang P,et al.Polycrystalline SnO2nanowires coated with amorphous carbon nanotube as anode material for lithium ion batteries[J].Mater Lett,2010,64(8):972-975.
[3]Liu J P,Li Y Y,Huang X T,et al.Direct growth of SnO2nanorod array electrodes for lithium-ion batteries[J].J Mater Chem,2009,19(13):1 859-1 864.
[4]Wang Y,Zeng H C,Lee J Y.Highly reversible lithium storage in porous SnO2nanotubes with coaxially grown carbon nanotube overlayers[J].Adv Mater,2006,18(5):645-649.
[5]Zhang Y L,Liu Y,Liu M L.Nanostructured columnar tin oxide thin film electrode for lithium ion batteries[J].Chem Mater,2006,18(19):4 643-4 646.
[6]WANG Bing(王冰).一维SnO2纳米材料的制备、结构及应用研究[D].Guangzhou(广州):Sun Yat-Sen University(中山大学),2007.
[7]Courtney I A,Dahn J R.Electrochemical and in situ X-ray diffraction studies of the reaction of lithium with tin oxide composites[J].J Electrochem Soc,1997,144(6):2 045-2 052.
[8]Xue M Z,Fu Z W.The reinvestigation on electrochemical reaction mechanism of stannic oxide thin film with lithium[J].Electrochem Solid-State Lett,2006,9(10):A468-A470.
