犊牛脑炎病原菌的分离鉴定及病理组织学观察
2011-05-31罗继分王静梅剡根强
罗继分,王静梅,剡根强
(石河子大学动物科技学院,新疆石河子 832003)
2009年初冬至2011年初春季节,新疆石河子某规模化奶牛场的部分初生犊牛陆续发生了以脑炎为主的病例。发病犊牛表现体温升高,咳嗽,共济失调,头低耳耷,拱背,精神沉郁,消瘦,抗生素治疗效果不佳,先后死亡9头。剖检濒死期犊牛发现,肺脏出血且有肉变,肾盂出血,小肠严重出血,肠黏膜脱落,肠系膜淋巴结肿大,脑膜广泛的小点出血。为查明导致该病发生的主要致病菌,本研究对患脑炎的犊牛进行了病原菌的分离和鉴定。
1 材料与方法
1.1 材料
1.1.1 病原材料 采集新疆石河子某发病牛场的犊牛肝脏、肠淋巴结、脾脏、心血和肺脏等共24份。1.1.2 培养基与生化试剂 LB血培养基,链球菌选择培养基,肉肝汤厌氧培养基,各种生化试验用培养基等参照文献[1]配制。
1.1.3 分离株16SrDNA测序 由上海生工生物工程技术服务有限公司测定;分子生物学试剂DNA Marker DL 2 000,Taq酶(5U/μL)、dNTP(10mmol/L)均为广州东盛生物科技有限公司产品;根据测序结果选择最合适的序列设计引物,引物由北京六合华大基因科技股份有限公司合成。
1.1.4 实验动物 健康小鼠和家兔,购自于石河子大学实验动物中心。
1.1.5 病理切片 采集发病犊牛和人工感染死亡的小鼠的脑组织,制作石蜡切片。
1.1.6 药敏试验 阿奇霉素、阿莫西林、四环素、罗红霉素、环丙沙星、氯霉素、万古霉素、利福平、泰乐菌素、土霉素、青霉素、头孢噻呋钠、庆大霉素、恩诺沙星、卡那霉素、氟苯尼考等药敏片为杭州天和微生物试剂有限公司产品。
1.2 方法
1.2.1染色镜检 将病料组织抹片进行瑞特染色,镜检观察细菌染色特性及形态特征。
1.2.2 分离培养 无菌采集濒死期及死亡的犊牛的肝脏、心血、肺脏,分别接种于LB血肉汤培养基和厌氧肉肝汤培养基,置37℃恒温箱中增菌培养24h后,革兰染色镜检,初步筛选出革兰阳性球菌,将培养物转接于LB鲜血平板,37℃恒温培养24 h。观察菌落形态并染色镜检,挑选革兰阳性球菌的单个菌落接于鲜血LB平板培养基分别置于37℃恒温培养箱和体积分数为5%CO2恒温培养箱中进行分离纯化。培养24h后,挑选单个菌落接于鲜血LB平板和链球菌选择培养基,置体积分数为5%CO2中培养,观察细菌菌落形态和溶血情况。
1.2.3生化鉴定 分离菌的生化鉴定参照文献[2-3]的方法进行。
1.2.4 分离株16SrDNA测序 将纯培养物送往上海生工生物工程技术有限公司进行测定。
1.2.5 PCR鉴定
(1)引物 上游引物:GCGGTGGAGCATGTGGTT;下游引物:GTGTGACGGGCGGTGTGT。扩增产物片段大小为472bp。
(2)PCR模板 肉汤纯培养物以12 000r/min离心10min,去上清,加200μL超纯水混匀后100℃水浴10min,再冰浴2min,12 000r/min离心2 min,取上清至另一离心管中置-20℃保存备用。
(3)PCR反应体系(25μL) 10×buffer 2.5 μL,2.5mmol/L dNTP 1.5μL,上、下游引物各1 μL,TaqDNA 聚合酶(5U/μL)0.5μL,模板2.5 μL,无菌双蒸水补至25μL。PCR反应条件95℃预变性5min;94 ℃ 1min,55.6 ℃ 30s,72 ℃ 50 s,共35个循环;72℃延伸10min,4℃结束反应。PCR结果观察:将PCR产物用10g/L琼脂糖凝胶电泳检测,凝胶成像系统下观察并拍照。
1.2.6 动物试验 健康小鼠20只,分为2组,10只腹腔注射分离菌肉汤培养物,每只小鼠注射量为9×109cfu,另10只腹腔注射无菌生理盐水作为对照组,每日观察小鼠发病情况。
取健康家兔6只,4只分别耳缘静脉注射分离株肉汤培养物,注射量均为18×109cfu;另2只分别耳缘静脉注射无菌生理盐水作对照,观察家兔发病及死亡情况。
1.2.7 病理组织学观察 参照文献[4-5]采集发病犊牛和死亡小鼠的脑组织制作石蜡切片,HE染色,光镜观察其病理变化。
1.2.8 药敏试验 用K-B纸片法进行药敏试验,参考王建永等[6]的试验方法,依照NCCLS(美国临床实验室标准化委员会)标准判定试验结果。
2 结果
2.1细菌形态观察
病死犊牛的肺脏,肝脏和心血抹片瑞氏染色镜检,可见长链,短链和成对排列的球菌。病死犊牛和小鼠分离培养物革兰染色呈链状排列的阳性球菌,有荚膜。
2.2 病原菌分离培养及培养特性
病料接入肉汤培养基中培养48h后,溶液变浑浊,肉肝汤培养基有气体产生。分离菌在普通琼脂上生长贫瘠且缓慢,在鲜血LB平板上培养24h后,出现圆形白色隆起,微溶血现象。在链球菌选择培养基上为白色隆起,边缘整齐的针尖大小菌落,在体积分数为5%CO2中生长良好。
2.3 生化鉴定结果
分离菌在400mL/L胆汁、甘露醇、山梨醇、马尿酸钠、甘油、海藻糖、蔗糖、果糖、七叶苷、精氨酸中生长;在温度为10℃和45℃时不生长,在pH 9.6、650g/L NaCl中不生长;不能利用阿拉伯糖、菊糖、棉子糖和鼠李糖。结果表明,分离株符合乳房链球菌的生化特性。
2.4 16SrDNA测序结果
将测序所得基因序列与GenBank上发表的序列进行比对,同源性为98.7%。
2.5 PCR鉴定
提取分离菌的DNA为模板,经PCR扩增出472bp的特异性条带见图1。
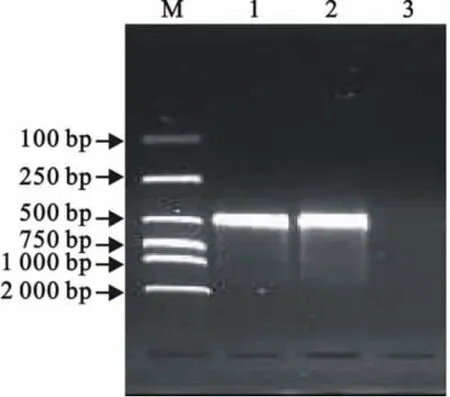
图1 乳房链球菌特异性基因的PCR扩增Fig.1 PCR amplification of specific gene in Streptococcus uberis
2.6 动物试验结果
注射分离菌后,小鼠陆续出现精神沉郁,消瘦,呼吸急促,静卧不动等症状。小鼠在1周内死亡5只,死亡率为50%(5/10),对照组正常,剖解死亡小鼠,腹腔有化脓性积液,积液瑞氏染色镜检可见大量链状球菌,有荚膜。感染家兔未见死亡,但明显消瘦。
2.7 病理组织学观察结果
病理组织学观察结果见图2。从图2箭头所指处可以看到脑组织血管扩张充血,血管和神经细胞外围有较大的空隙。
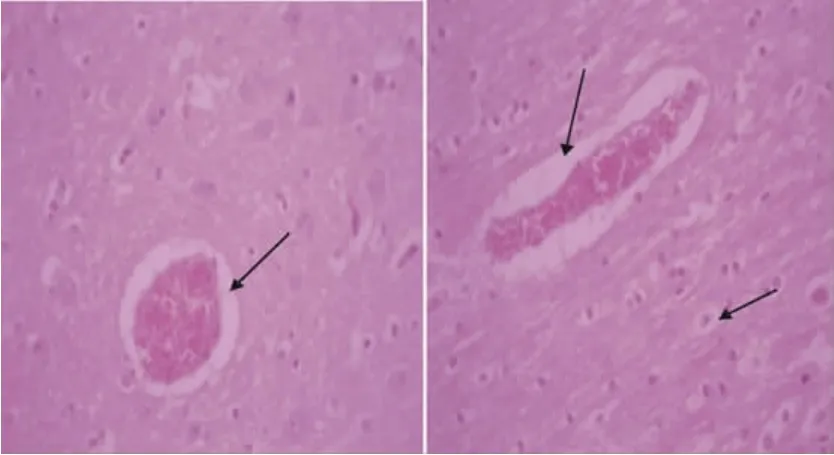
图2 犊牛脑组织石蜡切片Fig.2 Paraffin sections of calf brain tissue
2.8 药敏试验结果
药敏试验结果见表1。
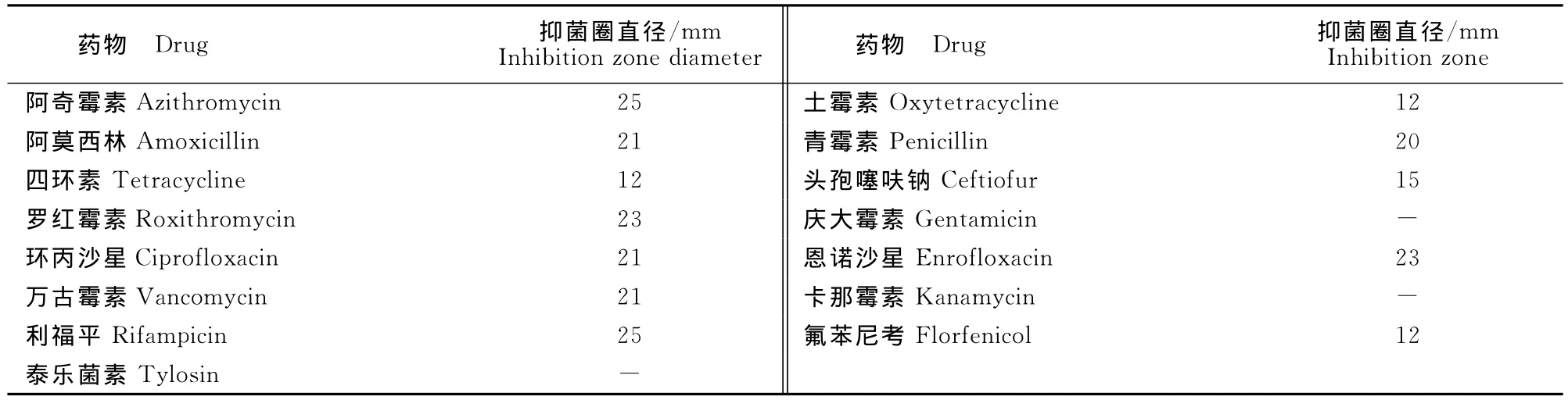
表1 分离株的药敏试验结果Table 1 The results of drug sensitivity test of isolate
3 讨论
目前能够引起动物脑炎的病原有细菌、病毒、真菌、立克次体、原虫等。细菌主要有肺炎链球菌、肠埃希菌、金黄色葡萄球菌、李斯特菌、B族链球菌和奈瑟球菌等[3-4]。病毒主要有单纯疱疹病毒、日本脑炎病毒、西尼罗脑炎病毒等约有一百多种病毒可致人和动物脑炎[5]。
乳房链球菌是导致规模化奶牛场乳房炎的一个重要原因,使泌乳期和非泌乳期奶牛感染临床和亚临床的比例增高。乳房链球菌被视为环境乳腺炎病原体,它已在牛场环境中无处不在,并广泛分布,可以从垫层,草料和乳房内及奶牛乳房外的其他部位分离到乳房链球菌,且其检出率还很高[6],说明乳房炎主要是由于环境中的乳房链球菌感染[7]。那么导致犊牛感染的乳房链球菌也很有可能来源于环境,或感染乳房链球菌的亚临床型乳房炎奶牛的乳汁,犊牛也可能由于食用了携带病原体的初乳和未经加热处理的混合常乳而感染,有关引起犊牛感染的报道甚少。
犊牛发病主要在初冬至初春季节,据报道[8],乳房链球菌能在低温环境中存活。尤其是在寒冷季节,由于管理不当便会促使乳房链球菌大量繁殖。环境中的乳房链球菌增加,使得犊牛感染乳房链球菌的机率增加。目前在全世界范围内,环境中的乳房链球菌已被报道是导致临床和亚临床乳房炎的一个主要因素[9-10]。
本试验中从病死犊牛的样品的分离培养物和小鼠的腹腔液抹片中都可见分离株有荚膜,但分离株培养传代几代后荚膜消失。是否与分离株乳房链球菌发生了变异有关还需要进一步研究。在血平板培养基上有微溶血,这符合乳房链球菌的生长特性。动物接种后小鼠死亡,说明分离株有致病性。乳房链球菌的毒力基因主要有hasA,hasB,hasC,oppE,pauA,pauB和skc等,这些基因都与乳房炎的发生有关[11]。其中pauA基因在乳房炎病原体的致病性方面伴有相当重要的角色[12]。上述毒力基因是否都能引起脑炎发生,或者只是其中一种基因,还需要进一步探索研究。这将是以后深入研究乳房链球菌致病性的一个重要方向。
从病理组织切片中可以观察到脑组织血管扩张充血,血管和神经细胞外围有较大的空隙。这些病理性变化表明犊牛的脑组织受损,从而表现出脑炎症状。虽然乳房链球菌能够到达人的眼球使人发生眼疾[13],但是目前还没有见到关于乳房链球菌具有致脑炎的特性的报道,而且它是如何通过血脑屏障的,其机理尚不清楚。
[1]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[2]王建永,张 磊,赵月兰,等.腹泻犊牛病原分离鉴定及药敏实验[J].动物医学进展,2010,31(5):118-121.
[3]Mette K B,Lisbeth N P,Jens K M.Eight-plex PCR and liquidarray detection of bacterial and viral pathogens in cerebrospinal fluid from patients with suspected memingitis[J].J Clin Microbiol,2009,47(4):908-913.
[4]王慧敏,高云英,田飞鹏.脑膜炎球菌外膜蛋白NhhA的表达及免疫效果评价[J].动物医学进展,2010,31(12):53-57.
[5]Ye C T,Abraham S,Wu H Q,et al.Silencing early viral replication in macrophages and denritic cells effectively suppresses flavivirus encephalitis[J].Plos One,2011,6(3):1-7.
[6]赵战峰,宋军科,于三科.奶牛乳房炎病原菌的分离鉴定[J].动物医学进展,2010,31(4):113-115.
[7]Florence B G,Fromageau A,Lamoureux J,et al.Evaluation of tandem repeats for MLVA typing ofStreptococcusuberisisolated from bovine mastitis[J].BMC Vet Res,2006,2(33):1-9.
[8]Lopez-Benavides M G,Williamson J H,Pullinger G D,et al.Field observations on the variation ofStreptococcusuberispopulations in a pasture-based dairy farm[J].J Dairy Sci,2007,12(90):5558-5566.
[9]Nam H,Lim S,Kang H,et al.Antimicrobial resistance of streptococci isolated from mastitic bovine milk samples in Korea[J].J Vet Diagn Invest,2009,21:698-701.
[10]Pryor S M,Cursons R T,Willianmson J H,et al.Experimentally induced intramammary infection with multiple strains ofStreptococcusuberis[J].J Dairy Sci,2009,92:5467-5475.
[11]Reinoso E,Lasagno M C,Dieser S A,et al.Distribution of virulence-associated genes inStreptococcusuberisisolated from bovine mastitis[J].Fems Microbiol Lett,2011,318:183-188.
[12]Ruth N Z,Ynte H S,Martin W.Multilocus sequence typing ofStreptococcusuberisprovides sensitive and epidemiologically relevant subtype information and reveals positive selection in the virulence gene pauA[J].J Clin Microbiol,2005,43(5):2407-2417.
[13]Raul V M,Dulce R V,William F M,et al.Intravitreal ampicillin sodium for antibiotic-resistant endphthalmitisStreptococcusuberisfirst human intraocular infection report[J].J Ophthalmol,2010,56:1-4.