食管癌癌变过程中端粒DNA长度与细胞DNA含量的变化及意义
2011-05-31王大虎张祥宏
王大虎 左 静 张祥宏
(河北医科大学基础医学研究所病理教研室,河北 石家庄 050017)
染色体末端存在一种维持染色体完整和稳定的特殊结构——端粒(telomere),能防止染色体DNA降解、末端融合缺失和非正常重组〔1〕。人端粒序列为(GGATTT)n,端粒长度(terminal repeat fragment,TRF)为5~15 kb,为染色体末端提供了一个保护性“帽”,对染色体的稳定十分重要〔2〕。每次细胞分裂,端粒会缩短55~200 bp,经历多次分裂短至一定界限,细胞最终凋亡或死亡。近年来研究发现,端粒长度的改变参与肿瘤的发生和发展。但在食管癌癌变过程中是否存在端粒长度的改变及其与DNA含量的关系目前报道甚少。因此,本研究收集河北省磁县食管癌高发区人群的食管脱落细胞,定量检测食管上皮癌变过程中细胞端粒DNA长度改变和细胞DNA含量的变化,分析其与食管上皮癌变的关系,为阐述食管上皮的癌变机制提供实验依据。
1 材料与方法
1.1 标本来源 所有标本均来自河北省磁县食管癌高发区现场,采用食管拉网法采集食管上皮脱落细胞,将拉网器网球上的脱落细胞部分作细胞涂片,部分收集后70%乙醇固定用于流式细胞术检测。随机抽取100例,其中食管上皮正常组18例,轻度增生组16例,重度增生组35例,癌组31例。细胞学涂片经常规巴氏染色,由2名富有经验的病理医师进行细胞学诊断〔3〕。
1.2 主要试剂 端粒肽核酸(PNA)探针试剂盒购自DAKO公司(lot 00004334和00009155),碘化丙啶(Sigma公司)。
1.3 DNA染色 制备单细胞悬液,参照左连富的方法〔4〕,采用碘化丙啶一步插入性DNA荧光染色法,以10%鸡红细胞作内参染色。每份样品中加入DNA染液(每1 000 ml中含碘化丙啶 50 mg/L,RNA 酶 10 mg/L,TritonX100 1.0%)1.0 ml,4℃冰箱中染色30 min,以500目筛网过滤,使样品成为合格的单细胞悬液,即可上机检测。
1.4 原位杂交 制备单细胞悬液,取2×106个细胞分为实验组和背景对照组;实验组加入300μl含FITC-(CCCTAA)3PNA探针杂交液,对照组加300μl空白杂交液,混匀后87℃避光孵育15 min变性;然后室温下避光杂交过夜;洗涤后碘化丙啶进行DNA染色(4℃避光孵育2 h),400目铜网过滤后进行流式细胞仪测定〔5〕。
1.5 流式细胞仪检测方法 采用美国BeckmanCoulter公司Epics2XLⅡ型流式细胞仪,激发光源为15 mW氩离子激光器,激发波长为 488 nm。检测前以 flow-checkTMFluorpheres(10 μm)荧光微球(REF 6605359.Beckman Coulter,Inc.Fullerton,CA 92835.)作为标准样品调整仪器CV值在2%以内。
1.6 数据分析 细胞增殖活性的分析:应用DNA细胞周期分析软件,计算出DNA组方图各时相分布的百分比,以增殖指数(PI)表示细胞的增殖活性,PI=(S+G2/M)/(G0/G1+S+G2/M)×100%。流式原位杂交分析:FL1通道检测FITC荧光强度,FL3通道检测碘化丙啶荧光强度,端粒荧光定量即Q-FISH值由减去背景后的G0/G1期二倍体细胞平均荧光强度决定。Q-FISH值=实验样品平均荧光强度-背景对照平均荧光强度。细胞DNA含量分析:依据二倍体参考细胞G0/1期细胞DNA含量定为2C值DNA指数(DNA index,DI)=1.0,基于标准CV值在5%,判定标准即:DNA二倍体=2C±2CV值,DNA异倍体≠2C±2CV。即:①DI=1.0±0.1(0.9~1.1)为二倍体②DI=1.0±0.15(0.85~1.15)为近二倍体③DI=2.0±2CV(1.9~2.1)为四倍体④DI>2.1为多倍体⑤其余DI值均为非整倍体。在计算DNA异倍体时,把近二倍体、四倍体、多倍体、非整倍体划为异倍体的范畴。
1.7 统计学分析 计量资料用x±s表示,应用 SPSS13.0统计软件包进行t检验、单因素方差分析和χ2检验,相关性分析采用Spearman相关分析。
2 结果
2.1 食管上皮癌变过程中细胞周期分布变化 正常组、轻度增生组、重度增生组及癌组 PI值分别为(11.51±4.08)、(14.08±5.00)、(19.04±5.39)和(29.46±5.50),随着细胞学分级的升高,PI升高,癌组显著高于重度增生组(P<0.01),重度增生组高于轻度增生组(P<0.05);轻度增生组与正常组相比虽有升高的趋势,但无显著差别(P>0.05)。相关性分析显示,PI值与细胞学分级呈显著正相关关系(r=0.79,P<0.01)。2.2 食管上皮癌变过程中细胞DNA含量的变化及其与细胞学分级的关系 癌组的DI值明显高于重度增生组、轻度增生组和正常组(P<0.01);而正常组、轻度增生组和重度增生组的DI值虽呈上升趋势,但无统计学意义(P>0.05);四组间异倍体率比较显示,癌组异倍体率高于重度增生组(P<0.01)和轻度增生组,且重度增生组高于轻度增生组(P<0.05),但轻度增生组与正常组相比无明显差别(P>0.05)。经Spearman等级相关分析显示,DI值与细胞学分级呈正相关关系(r=0.60,P<0.01),提示随着细胞学分级的升高,DI值增大,二倍体所占百分比明显降低,异倍体百分比明显升高。见表1,图1,图2。
2.3 食管上皮癌变过程中端粒DNA长度的变化及其与细胞学分级的关系 流式原位杂交显示,正常组、轻度增生、重度增生和癌组中Q-FISH值分别为(50.83±8.86)、(49.51±3.16)、(36.96±8.02)和(27.81±6.59),癌组端粒长度明显短于重度增生组和轻度增生组(P<0.01),重度增生组短于轻度增生组(P<0.01),但轻度增生组与正常组比较无显著性差别(P>0.05)。经Spearman等级相关分析显示,端粒长度与细胞学分级呈负相关(r=-0.79,P<0.01),随着细胞学分级增高,端粒长度Q-FISH值逐渐降低。见图1,图3。
按照端粒长度的划分标准〔6〕,即Q-FISH值<正常组端粒长度80%(<0.76)为缩短,>正常组织120%(>1.14)为延长。100例标本中轻度增生组9例,重度增生组22例和癌组26例端粒缩短,其端粒缩短的阳性率分别为56.25%(9/16)、62.86%(22/35)和83.87%(26/31),呈上升趋势(P>0.05),但差异无统计学意义。见表2,图1。

表1 流式细胞术检测不同组别的DNA含量和异倍体变化
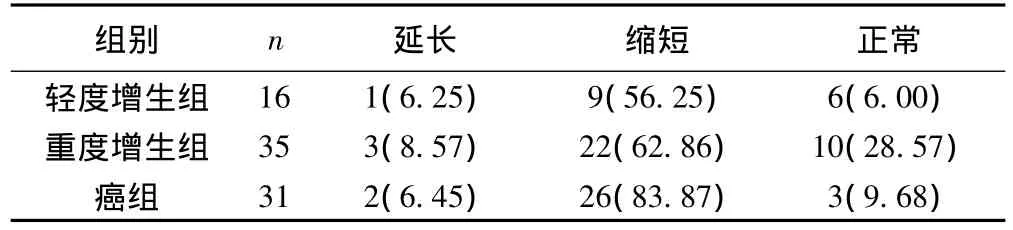
表2 食管上皮不同组别中端粒缩短情况〔n(%)〕

图1 流式细胞术检测端粒长度和DNA含量在各组中的变化

图2 在正常食管上皮和食管癌细胞DNA倍体的不同
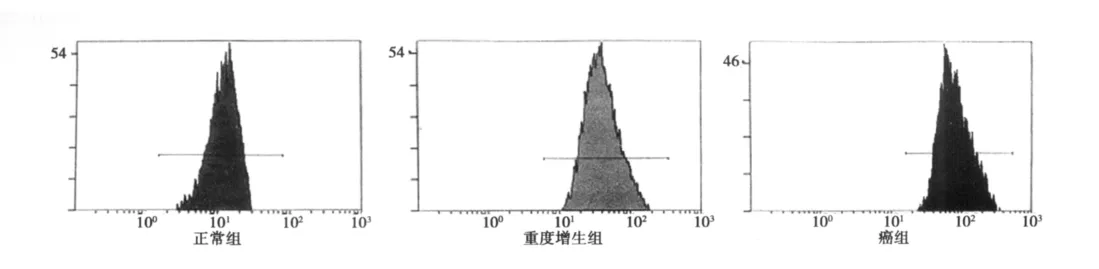
图3 流式细胞术定量检测端粒长度在各组中的变化
2.4 食管上皮癌变过程中细胞端粒DNA长度与细胞DNA含量的相关性分析 FCM检测的100例食管上皮脱落细胞标本中,随着细胞分级逐步升高,端粒长度Q-FISH值逐步下降的同时,DI值升高,DI值与端粒长度Q-FISH值呈显著负相关关系(r= -0.46,P <0.01)。
3 讨论
原癌基因的激活、抑癌基因的突变是肿瘤形成的重要分子基础。正常细胞在致癌因素作用下转变为恶性细胞并不意味着一定能形成肿瘤,哺乳动物体内有一套精细的调节机制控制着细胞的分裂次数,使细胞分裂达到一定程度后死亡,可见肿瘤细胞获得无限增殖的特殊能力——永生化,在肿瘤的发生中起着至关重要的作用。
目前研究发现,端粒长度的改变参与了肿瘤的发生和发展。Maruyama等〔7〕检测了不同病变期胃黏膜的端粒长度,发现从正常胃黏膜到肠化、再到腺瘤的发展过程中,端粒长度逐渐缩短。Meeker应用荧光原位杂交对114例浸润性乳腺癌、29例原位癌和10例良性增生乳腺组织检测证实,80.0%的浸润性乳腺癌和78%的导管原位癌与自身正常对照相比,平均端粒长度有明显缩短〔8〕。为了证实端粒与食管癌发生、发展的关系,本研究采用现场实验和实验室相结合的方法,应用荧光原位杂交流式定量法〔5〕(Q-Flow FISH)对食管癌高发区随机抽取的100例食管上皮脱落细胞进行端粒长度的检测。结果显示,食管癌及癌前病变细胞的平均端粒长度均显著短于正常食管上皮细胞,其平均端粒长度随细胞增生的程度和癌变发展阶段呈渐进性缩短,并且半数以上(56.25%轻度增生、62.86%重度增生)癌前病变端粒长度与正常组相比有显著缩短,提示端粒缩短参与了食管上皮癌变的发生。同时本研究还发现,无论是食管癌细胞还是癌前病变细胞,端粒变化呈非均一性,既有缩短又有延长,8.57%重度增生和6.45%癌端粒长于正常平均长度,但是端粒总体变化趋势与食管癌及癌前病变的轻重程度相一致。考虑可能源于几个不同原因:①除端粒酶之外还有其他机制(如ALT)参与端粒稳定的调节;②在端粒酶或ALT起作用维持端粒长度之前,细胞增殖程度影响着总体端粒缩短水平;③细胞分裂过程中端粒断裂-融合-桥联(breakage-fusion-bridge,BFB)造成其长短不一〔9〕;④证据显示未经修复的DNA氧化损伤也促进了端粒的丢失〔10〕。
在一些肿瘤中已观察到,染色体末端的端端融合在肿瘤形成相关基因的不稳定性中起着重要作用,而这种融合可能起因于染色体末端长片段的丢失,如端粒的丢失〔11,12〕。基于这种观点,端粒的缩短可能引起DNA的不稳定性,并在肿瘤的形成中起着重要作用。Ma〔13〕报道,在伴有DNA含量增高的肿瘤细胞中,存在染色体融合和(或)双微染色体。为了证实食管上皮癌变过程中端粒长度的变化与DNA含量的关系,本研究应用流式细胞术分析不同食管黏膜上皮细胞内DNA含量。结果显示,随着食管上皮从正常、轻度增生、重度增生到癌的进展,DI值明显增高,即DNA含量明显增加,同时伴有异倍体数目的不断增高,癌细胞组异倍体率达到80.65%;同时,随着癌前病变的进展,PI值逐步增高,处于增殖期的细胞明显增多。对31例癌的端粒长度和DNA指数的分析显示,总体上,在异倍体中的端粒长度明显短于二倍体,端粒长度和DNA指数呈负相关,也就是端粒越短,DNA指数越高。
本研究采用Q-Folw FISH对不同病变的食管上皮细胞进行端粒长度检测,此方法简单、快速,适合体外研究和进行大规模高发区现场患者的临床研究,与传统的Southern印迹测量的TRF值有良好的相关性。试验标本采用的是食管拉网采集的脱落上皮细胞,相对减少了非上皮细胞成分的混杂,实验数据更加精确。
综上所述,本研究采用流式细胞术的方法对河北省磁县食管癌高发区现场食管拉网获得的食管上皮细胞进行了端粒长度和DNA含量等的检测和分析,结果提示在食管上皮癌变过程中存在着端粒长度及DNA含量的改变,且在癌变早期就出现端粒长度的缩短。考虑获得恶性表型的食管上皮细胞端粒、DNA长度不断缩短,同时伴有染色体DNA活跃扩增,最终端粒维持在短而相对稳定的状态下,导致了恶性细胞永生化,引起食管癌的发生。对食管上皮细胞进行端粒长度检测将有助于监测食管癌的发生,同时也为抗肿瘤治疗开辟了新方向。
1 Bellon M,Nica C.Regulation of telomerase and telomeres human tumor viruses take contro〔lJ〕.JNCI,2008;100(2):98-108.
2 Svenson U,Roos G.Telomere length as a biological marker in malignancy〔J〕.Biochim Biophys Acta,2009;1792:317-23.
3 沈 琼.食管细胞学诊断〔M〕.北京:人民卫生出版社,1983:134-9.
4 左连富,林培中,齐凤英,等.食管癌前细胞DNA、端粒酶含量及多基因表达产物的定量检测〔J〕.生物化学与生物物理进展,2002;29(2):273-7.
5 黄 馨,石桂英,陈显达,等.利用流式荧光原位杂交法测定细胞端粒长度〔J〕.中国比较医学杂志,2010;20(7):67-71.
6 Hiyama E,Yokoyama T,Tatsumoto N,et al.Telomerase activity in gastric cancer〔J〕.Cancer Res,1995;55:3258-326.
7 MaruyamaY,Hanai H,Kaneko E.Telomere length and telomerase activity in intestinal metaplasia adenoma and well-differentiated adenocarcinoma of the stomach〔J〕.Nippon Rinsho,1998;56(5):1186-9.
8 Salhab M,Jiang WG,Newbold RF,et al.The expression of gene transcripts of telomere associated genes in human breast cancer:correlation with clinicopathological parameters and clinical outcome〔J〕.Breast Cancer Res Treat,2008;109(1):35-46.
9 Cesare AJ,Reddel RR.Telomere uncapping and alternative lengthening of telomeres〔J〕.Mech Ageing Dev,2008;129(1):99-108.
10 Tatsumoto N,Hiyama E,Murakami Y,et al.High telomerase activity is an independent prognostic indicator of poor outcome in colorectal cancer〔J〕.Clin Cancer Res,2000;6:2696-701.
11 de Lange T,Shelterin C.The protein complex that shapes and safeguards human telomeres〔J〕.Genes Dev,2005;19:2100-10.
12 Palm W,de Lange T.How shelterin protects mammalian telomeres〔J〕.Annu Rev Genet,2008;42:301-34.
13 Ma C,Martins S,Trask B,et al.Sister chromatid fusion initiates a amplification of the dihydrofolate reductase gene in Chinese hamster cells〔J〕.Genes Dev,1993;7:605-20.
