结直肠癌ZIC1和KLOTHO基因启动子甲基化检测的临床价值初探
2011-05-31甘丽虹陈淑洁王良静
甘丽虹,潘 洁,陈淑洁,钟 菁,王良静
(1.浙江大学医学院附属第二医院消化科,浙江 杭州 310009;2.浙江大学邵逸夫临床医学研究所消化研究室,浙江 杭州 310016)
结直肠癌是目前世界上发病率排名第三的恶性肿瘤[1]。结直肠癌的发生是一个涉及多基因遗传学和表观遗传学改变的累积过程,包括癌基因的激活和抑癌基因的失活[2]。DNA甲基化是表观遗传学改变的一种主要形式,在抑癌基因的失活机制中扮演着重要角色[3]。研究表明,DNA异常甲基化在结直肠癌的发生发展中起重要作用,多种基因DNA甲基化有可能成为结直肠癌诊断和预后判断的重要标志物[4-5]。
我们曾通过cDNA微阵列分析(cDNA microarray)进行基因组扫描和甲基化研究,发现ZIC1和KLOTHO基因的表达可能受到DNA甲基化的调控[6]。但有关ZIC1和KLOTHO在结直肠癌中的表达及相关调控机制尚不清楚。
ZIC是1994年Aruga在成年鼠小脑中发现的一类编码锌指结构蛋白的基因,包括ZIC 1~5共5个成员,其中ZIC1位于3q24,含3个外显子,编码一种C2H2型锌指蛋白[7]。多个研究报道,ZIC1在神经脑发育中发挥重要作用[8-9];而且,其与多种肿瘤如髓母细胞瘤、子宫内膜癌、间质肿瘤和胃癌的发生、发展关系密切[6,10-12]。KLOTHO 是 1997 年 Kuro 等人首先从衰老表现的小鼠模型中克隆成功[13-14];研究发现,KLOTHO基因功能缺陷是导致衰老的重要原因,但KLOTHO可能还具有抑癌基因的功能[15]。本研究主要探讨ZIC1和KLOTHO基因启动子甲基化对结直肠癌临床诊断的潜在价值。
1 材料和方法
1.1 材料 25对结直肠癌组织及癌旁组织均取自浙江大学邵逸夫医院外科手术标本。Trizol购自 Invitrogen公司,逆转录试剂盒(High-Capacity cDNA Reverse Transcription Kit)和TaqGold DNA聚合酶购自Applied Biosystems公司,实时荧光定量 PCR试剂盒(SYBR PremixEx Taq PCR)购自Takara公司,EZ DNA Methylation-Gold Kit购自Zymo Research公司。
1.2 方法
1.2.1 病例 入选结直肠癌患者25例,其中男性16人,平均年龄64岁;女性9人,平均年龄61.33岁。术中取癌和癌旁相对正常的两处组织标本,手术标本均经有丰富经验的病理科医师明确诊断。其中,高分化腺癌17例,中分化腺癌7例,低分化腺癌1例。癌旁组织经病理证实为无癌细胞的相对正常组织。TNM分期,Ⅰ期5例,Ⅱ期(ⅡA、ⅡB)10例,Ⅲ(ⅢA、ⅢB、ⅢC)9例,Ⅳ期1例。
1.2.2 实时荧光定量PCR 按照试剂说明书用Trizol试剂提取结直肠癌组织及相应癌旁组织 RNA,并逆转录为 cDNA,按照 SYBR PremixEx Taq PCR试剂盒说明书操作PCR,并以GAPDH作为内参照。反应体系20 μl,反应条件:95℃变性2 min,然后变性95℃ 30 s,退火55℃ 30 s,延伸72℃ 30 s,共35个循环;最后72℃延伸10 min,并进行溶解曲线分析及1.5%琼脂糖凝聚电泳验证扩增的特异性。每个样本均检测3次,取其平均值计算 ZIC1、KLOTHO mRNA的表达水平。用-△△CT法计算ZIC1和KLOTHO mRNA在结直肠癌组织及癌旁组织中的表达变化。PCR反应引物设计:ZIC1正义:5'-AAACTGGTTAACCACATC CGC,反 义:5'-CTCAAACTCGCACTTGAAGG;KLOTHO正义:5'-ACCTGGTGGCGCACAACC,反义:5'-TTGGCAAACCAACCTAGTACA;GAPDH正义:5'-GAAGGTGAAGGTCGGAGT,反义:5'-GAAGATGGTGATGGGATTTC。
1.2.3 DNA的亚硫酸盐处理及甲基化特异性PCR 提取结直肠癌组织及癌旁组织的DNA,取500 ng DNA进行亚硫酸盐处理,按照EZ DNA Methylation-Gold Kit说明书进行操作,取处理后的 DNA 1 μl作为模板使用 TaqGold DNA聚合酶进行甲基化特异性PCR扩增,反应体系 12.5 μl,反应条件:95℃变性 10 min,然后变性95℃ 30 s,退火58℃ 30 s,延伸72℃ 30 s,共40个循环,最后72℃延伸5 min。PCR产物经1.2%琼脂糖凝胶电泳,溴化乙锭(EB)染色,在紫外检测仪上观察产物条带。相关引物:ZIC1(M)正义:5'-GGATTTTTTGTTTCGTAATC,反义:5'-CCCGTTAACCACGTTAAACG;ZIC1(U)正义:5'-GGGATTTTTTGTTTTGTAATT,反义:5'-CCCATTAACCACATTAAACA;KLOTHO(M)正义:5'-GTCGTCGTTGTAGTTCGTTATC,反 义: 5'-CAACAAACGCCGATAATAACG;KLOTHO(U)正义:5'-TTGTTGTTGTTGTAG TTTGTTATT,反义:5'-CCAACAAACACCAATA ATAAC。(M):甲基化引物;(U):非甲基化引物。
1.2.4 统计方法 使用 GraphPad Prism 5.0数据分析软件进行数据统计,结直肠癌和癌旁组织ZIC1和KLOTHO mRNA相对表达情况用-△△CT值的中位数(25% ~75%四分位间距)描述,采用配对Wilcoxon等级秩和检验分析;ZIC1和KLOTHO mRNA表达与临床病理资料关系采用非参数Mann Whitney和Kruskal-Wallis检验,组间两两比较采用Dunn's多重检验;ZIC1和KLOTHO启动子甲基化与临床病例资料相关性采用Fisher精确检验。P<0.05认为差异有统计学意义。
2 结果
2.1 ZIC1和KLOTHO mRNA在结直肠癌组织中的表达明显下调 以GAPDH作为内参照,实时荧光定量PCR结果显示:与癌旁正常组织相比,ZIC1和KLOTHO mRNA在结直肠癌组织中的表达均明显下调(P均<0.0001),见表1。进一步分析ZIC1和KLOTHO mRNA表达与临床病理资料的关系,发现结直肠癌组织ZIC1 mRNA相对定量表达与患者年龄、性别、肿瘤分化程度及肿瘤TNM分期无明显相关(P>0.05);KLOTHO mRNA表达与患者年龄分布有显著相关性(P<0.05),而与患者性别、肿瘤分化程度及肿瘤TNM分期无明显相关(P>0.05),见表 2、表 3。
2.2 结直肠癌组织中ZIC1和KLOTHO基因启动子高甲基化 甲基化特异性PCR(MSP)结果显示,在25例结直肠癌组织中ZIC1甲基化阳性率为80%(20/25),KLOTHO甲基化阳性率为76%(19/25),ZIC1和KLOTHO联合甲基化的阳性率为64%(16/25)。在检测标本中,部分癌旁正常组织出现较癌组织弱的甲基化(M)表达条带,说明组织学上相对正常的结肠癌旁组织可以发生部分甲基化(图1)。
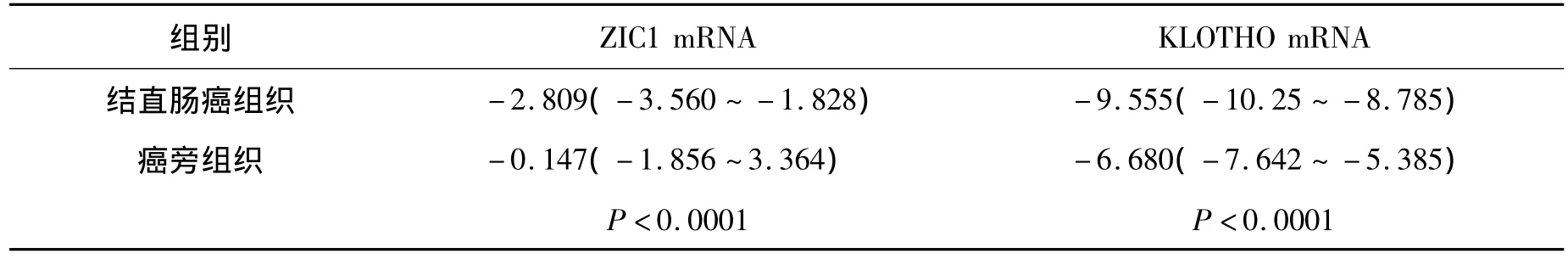
表1 实时荧光定量RT-PCR检测结直肠癌和癌旁组织中ZIC1和KLOTHO mRNA表达Table 1 The result of real-time quantitative RT-PCR analysis of ZIC1 and KLOTHO mRNA expression in colorectal cancer and adjacent non-tumor tissues (n=25,中位数,25% ~75%)

表2 结直肠癌ZIC1 mRNA表达与临床病理资料的关系Table 2 The relationship between the expression of ZIC1 mRNA and clinicopathological features in colorectal cancers(n=25,中位数,25% ~75%)

图1 MSP检测结直肠癌组织中ZIC1和KLOTHO基因启动子甲基化表达Fig.1 The promoter methylation status of ZIC1 and KLOTHO were detected by methylation specific PCR(MSP)in colorectal cancer and adjacent nontumor tissues

表3 结直肠癌KLOHTO mRNA表达与临床病理资料的关系Table 3 The relationship between the expression of KLOTHO mRNA and clinicopathological features in colorectal cancers(n=25,中位数,25% ~75%)
进一步对ZIC1和KLOTHO甲基化状态和临床病理资料进行统计,发现ZIC1和KLOTHO同时甲基化与年龄分布相关(P<0.05),但与患者性别、肿瘤分化程度、肿瘤TNM分期无明显相关性(P >0.05),见表4。
3 讨论
结直肠癌的发生是遗传学和表观遗传学改变共同作用的结果[16]。表观遗传学改变主要包括DNA甲基化、组蛋白修饰、染色质重塑等[17]。基因异常甲基化在肿瘤发生发展中是一种频发的早期事件,其不但在组织中可被检测到,在外周血、尿液、胆汁等体液中也能检测到[18],具有重要的临床诊断和应用价值。

表4 结直肠癌中ZIC1和KLOHTO甲基化与临床病理特点Table 4 The correlation between ZIC1 and KLOTHO DNA methylation and clinicopathological features in colorectal cancers
本研究发现,ZIC1和KLOTHO基因在结直肠癌中的表达较癌旁组织明显下调;在结直肠癌组织中ZIC1和KLOTHO基因启动子普遍存在高甲基化现象,ZIC1甲基化阳性率为80%(20/25),KLOTHO甲基化阳性率为76%(19/25),联合阳性率达64%(16/25)。因此,我们推测ZIC1和KLOTHO的表达下调可能受到启动子高甲基化等表观遗传学调控。在部分结肠癌旁组织发生ZIC1和KLOTHO甲基化现象,其主要原因可能为:①这些组织在病理形态学上是正常的,但部分细胞在分子水平上已经发生了甲基化,故癌旁组织实际上是相对正常组织;②甲基化特异性PCR(MSP)方法极度敏感,经过PCR扩增后能发现0.1%比例甲基化DNA,癌旁组织出现较弱的甲基化(M)条带。再者,甲基化可能是结肠癌发生的早期分子事件。本研究还观察到KLOTHO mRNA表达与患者年龄间有相关性,尤以50岁以后年龄段,随着年龄的递增,KLOTHO mRNA表达呈递减趋势,这可能与既往研究报道KLOTHO基因参与人类衰老过程相关[14]。
前期体外细胞学实验表明,ZIC1使胃癌细胞周期停滞,并抑制细胞增殖而发挥抑癌作用[6]。近年研究发现,KLOTHO基因在乳腺癌细胞中具有抑癌功能[15],研究显示 KLOTHO表达乳腺癌组织较正常组织明显降低,过表达KLOTHO使乳腺癌细胞株MCF7和MDA-MB-231增殖抑制。有关ZIC1和KLOTHO在结直肠癌中是否具有肿瘤抑制作用值得进一步的实验研究。
综上,在结直肠癌组织中ZIC1和KLOTHO基因表达显著下调,ZIC1和KLOTHO基因发生高频率启动子甲基化,联合检测 ZIC1和KLOTHO基因启动子甲基化状态对结直肠癌诊断具有潜在的应用价值。
[1]JEMAL A,SIEGEL R,WARD E,et al.Cancer statistics,2009 [J].CA Cancer J Clin,2009,59(4):225-249.
[2]GRADY W M,CARETHERS J M.Genomic and epigenetic instability in colorectal cancer pathogenesis [J].Gastroenterology,2008,135(4):1079-1099.
[3]MANEL E.Epigenetics in Cancer[J].N Engl J Med,2008,358(11):1148-1159.
[4]SIDRANSKY D.Emerging molecular markers of cancer[J].Nat Rev Cancer,2002,2(3):210-219.
[5]KIMM S, LEEJ, SIDRANSKYD. DNA methylation markers in colorectal cancer [J].Cancer Metastasis Rev,2010,29(1):181-206.
[6]WANG L J,JIN H C,WANG X,et al.ZIC1 is downregulated through promoter hypermethylation in gastriccancer[J]. Biochem BiophysRes Commun,2009,379(4):959-963.
[7]GRINBERG I,MILLEN K J.The ZIC gene family in development and disease [J].Clin Genet,2005,67(4):290-296.
[8]MAURUSD, HARRISW A. Zic-associated holoprosencephaly:zebrafish ZIC1 controls midline formation and forebrain patterning by regulating Nodal,Hedgehog,and retinoic acid signaling [J].Genes Dev,2009,23(12):1461-1473.
[9]ARUGA J.TheroleofZicgenesin neural development[J].Mol Cell Neurosci,2004,26(2):205-221.
[10]MICHIELS E M,OUSSOREN E,VAN G M,et al. Genes differentially expressed in medulloblastoma and fetal brain [J].Physiol Genomics,1999,1(2):83-91.
[11]WONG Y F,ChEUNG T H,LO K W,et al.Identification of molecular markers and signaling pathway in endometrial cancer in Hong Kong Chinese women by genome-wide gene expression profiling[J].Oncogene,2007,26(13):1971-1982.
[12]POUREBRAHIM R,VAN D K,BAUTERS M,et al.ZIC1 gene expression is controlled by DNA and histone methylation in mesenchymal proliferations[J].FEBS Letters,2007,581(26):5122-5126.
[13]KURO-O M,MATSUMURA Y,AIZAWA H,et al.Mutation of the mouse Klotho gene leads to a syndrome resembling ageing[J].Nature,1997,390(6655):45-51.
[14]WANG Y,SUN Z. Current understanding of Klotho[J].Ageing Res Rev,2009,8(1):43-51.
[15]WOLF I,LEVANON -COHEN S,BOSE S,et al.Klotho:a tumor suppressor and a modulator of the IGF-1 and FGF pathways in human breast cancer[J].Oncogene,2008,27(56):7094-7105.
[16]VENKATACHALAMR, LIGTENBERGMJ,HOOGERBRUGGE N,et al.The epigenetics of(hereditary)colorectal cancer[J].Cancer Genet Cytogenet,2010,203(1):1-6.
[17]FEINBERG A P.Phenotypic plasticity and the epigenetics of human disease [J].Nature,2007,447(7143):443-440.
[18]QURESHI S A,BASHIR M U,YAQINUDDIN A.Utility of DNA methylation markers for diagnosing cancer[J].Int J Surg,2010,8(3):194-198.
