磺胺类药物在环境中的生态行为研究综述
2011-05-30金彩霞高若松吴春艳
金彩霞,高若松,吴春艳
(1.河南师范大学 化学与环境科学学院河南省环境污染控制重点实验室黄淮水环境与污染防治省部共建教育部重点实验室,河南 新乡 453007;2.浙江省农业科学院 环境资源与土壤肥料研究所,浙江 杭州 310021)
磺胺类药物是现代医学中常用的一类人工合成的抗菌消炎药。自1932年发现磺胺的基本结构后,已合成数千种磺胺类药物[1]。经过几十年的发展,现在已经不仅作为人用药物,而且广泛使用于畜牧业和水产养殖业,用来治疗细菌及特定微生物引起的多种传染疾病。它进入生物体后能抑制细菌的叶酸代谢,干扰细菌核酸和蛋白质的合成。它的优点是具有较广的抗菌谱,而且疗效确切、性质稳定、使用简便、价格便宜,又便于长期保存,特别是加入抗菌增效剂后效果更好。磺胺类药物的基本化学结构是对氨基苯磺酰胺 (图1),因取代基的不同,可产生许多不同的磺胺类药物。目前常用的磺胺类药物有磺胺甲恶唑 (SMZ)、磺胺间甲氧嘧啶(SMM)、磺胺嘧啶 (SD)、磺胺二甲基嘧啶(SM2)等。

图1 磺胺类药物的分子结构
如今,磺胺类药物更多的用于动物疾病的治疗和预防,并作为动物生长促进剂以亚治疗剂量添加到动物饲料中。我国是世界上磺胺类药物的主要生产国和出口国之一。在欧洲,磺胺类药物是使用量第2大的兽药抗生素,2000年时在英国的销量占21%,在其他几个欧洲国家亦达到11% ~23%[2]。但是这些药物进入到生物体大约有50% ~90%都以母体或代谢物的形式排出体外,扩散到环境中。排出体外的磺胺代谢物仍然具有生物活性,而且能够在环境中进一步形成母体化合物[3-4]。已频繁报道在污水处理厂,粪便浇灌的农田,河流、湖泊,甚至地下水中检测到磺胺类药物[5-7]。磺胺类药物的大量使用,会使细菌产生抗药性,还可能和其他兽药、农药等污染物质在生物体内发生交互作用,造成无法预知的后果[8]。研究表明,此类药物在环境中降解非常缓慢,残留时间长,经过长期的积累和生物链的传递,会在动植物和人体内达到较高的浓度,影响动植物的生长,危害人体健康,导致严重的环境污染。目前,各国环境学者都对磺胺类药物在环境中的吸附、迁移和转化,特别是它的代谢和降解产物及过程开展了多方面的研究,并取得了重要的成果。
1 吸附和迁移
磺胺类药物进入环境后,便会在土壤、水和沉积物中重新分配,通过吸附、迁移等一系列生物和非生物的转化过程,在多相环境介质中达到一个相对平衡的浓度。
1.1 吸附
磺胺类药物进入环境后主要被吸附在土壤和沉积物中。一般有物理性吸附和化学性吸附2种。其通过范德华力、色散力、诱导力和氢键等分子间作用力与土壤中的有机质或颗粒物表面吸附位点相吸附,或药物的分子功能团如羧酸、醛、胺类与环境中化学物质或有机质发生化学反应形成络合物或螯合物,被吸持在农田土壤中[9]。Boxall等[10]研究发现磺胺氯哒嗪 (SPD)在土壤中的分配系数很低(Kd=0.9 ~18.1mL·g-1)。陈昦等[11]对太湖地区水稻土的吸附研究发现,磺胺二甲嘧啶等4种磺胺类药物在水稻土的吸附自由能值均<-40 kJ·mol-1,表明其在水稻土中的吸附是以物理吸附为主,供试土壤的等温吸附线均能较好地拟合Freundlich和Langmuir方程,并且由平均偏摩尔自由能的变化判断,4种磺胺类药物在水稻土上吸附的强弱顺序为:SMM>SPD>SM2>磺胺甲嘧啶(SM1)。孔晶晶等[12]采用批平衡实验方法研究 SD和磺胺噻唑 (STZ)在5种典型土壤及1种泥炭土的吸附行为,结果表明,SD和STZ在土壤中的平衡吸附量Cs随溶液pH值的增加逐渐减小,pH=9时的吸附量接近于零。土壤理化性质对SD和STZ吸附的影响主要表现为,最大吸附量 (Qm)与土壤有机质和土壤粉粒呈显著正相关,它们更容易吸附在有机质含量比较高的黑土和泥炭土中。Gao等[13]曾报道,磺胺类药物的吸附与其杂环取代基有关系,3种形态的磺胺类药物在粘土矿物中吸附能力的顺序为:阳离子形态>中性分子形态>阴离子形态,并指出环境中的氨和磷酸根离子会促进磺胺类药物的解吸。
1.2 迁移
土壤中的磺胺类药物能够通过淋溶等方式向下迁移,在不同土壤中迁移能力差异较大。文春波等[14]通过室内模拟动态土柱淋溶试验,研究了SD在土壤中迁移行为,结果表明,SD在砂土中具有较强的迁移能力,经淋溶后渗出40 cm土柱的SD为所加药量的70.16%,而其在壤土和粘土柱中的渗出率分别为39.66%和51.12%。SD在3种供试土壤的淋溶迁移能力为:砂土>粘土>壤土。SD在土壤中的淋溶迁移能力与土壤性质密切相关,其中,土壤质地和有机质含量是决定SD在土壤中淋溶向下迁移能力的重要因素。
磺胺类药物呈弱酸性,溶于水,不能被吸附的磺胺类药物可通过雨水的冲刷及其他作用进入到水体中,对地下水构成威胁。如果淋洗到附近的河流中,最终将影响河流及海洋生态系统中的各种生物。Lindsey等[7]对遍及美国的144个采样点采到的地下水和地表水样品进行检测,结果显示,有9个采集点的样品检测到了磺胺类药物,浓度范围在0.07~15 μg·L-1,其中在华盛顿的地下水样品中检测到了SMZ。目前,我国在这方面的监测数据还比较少。
使用磺胺类药物的医院排放的污水作为生活污水进入到城市污水处理厂,但是各种报道表明,污水处理厂并不能完全去除磺胺类药物,常红等[5]对北京市6个主要的污水处理厂的磺胺类药物的调查研究显示,SMZ,SD等5种药物都不能得到完全清除。未完全清除的磺胺药物扩散到环境中,在污水处理厂四周的土地中也检测到了磺胺类药物残留。
畜禽粪便是农业种植很好的肥料,我国自古就有使用粪肥做有机肥的传统,但是现代畜牧业抗生素的大量使用,使土壤中抗生素含量大增。李彦文等[6]分析了广州、深圳等菜地土壤中6种磺胺类药物的污染特征,结果表明,使用养猪场废水灌溉的菜地中磺胺类药物的含量最高,达到321.4 μg·kg-1。这会对土壤微生态系统造成严重破坏,影响土壤肥力,并且会被植物体吸收,从而影响植物生长[15-16]。
2 降解
2.1 磺胺类药物在土壤中的降解
药物在土壤中可以通过物理的、化学的或生物学的作用改变形态或者转变成另一物质,降解是其转化的一条重要途径,可分为光解、水解、氧化还原降解和微生物降解等几种方式。土壤中的兽药一般都是几种降解方式同时进行。1976年 Coats等[17]就对磺胺类药物在环境中的降解进行了研究,结果表明,SM2在鸡粪中的降解很慢。Halling-Serensen等[18]通过土壤间隙水中兽药的非生物降解研究发现,磺胺类兽药在液体中可发生光解,也可在土壤表层几厘米和液体粪肥表面发生光降解作用。土壤中对药物降解起作用的微生物主要有细菌,真菌,放线菌等。近年来的研究表明,相对于其他抗生素,磺胺类药物在土壤中的降解速率很慢,这可能与其较强的抑菌性有关。有研究表明在灭菌和避光的条件下,SMM在土壤中的半衰期达到109.8 d,未灭菌和避光的条件下为70.6 d,未灭菌和自然光条件下为17.7 d。这说明在有光照的地方,由于磺胺类药物较强的抑菌性,它的光降解速率要比微生物降解速率大。保持较高的含水量,会增加土壤中药物的溶解和被吸附药物的解吸从而加快光照和微生物对药物的降解速率。通过对SMM的微生物降解进一步的研究发现,SMM不同起始浓度的降解效率不同,起始浓度越低,降解速率越快,降解半衰期越短。这是由于SMM是抗菌药物,对微生物有一定的抑制作用,浓度低时微生物受到的胁迫小,降解速度较快,浓度高时降解较慢。这与王冉等[9]研究磺胺二甲嘧啶对土壤中细菌和真菌数量的影响时,得到的磺胺二甲嘧啶浓度为1 mg·kg-1时,土壤中细菌和真菌数量明显减少 (P<0.05),但随时间延长,该抑制作用变缓的结果相一致。张从良等[19]通过室内模拟降解试验,研究了6种磺胺类药物SD、SM2、磺胺对甲氧嘧啶 (SMD)、SMM、磺胺二甲氧嘧啶 (SDM)和SMZ在砂土中的微生物降解过程,并考察了土壤类型、浓度和温度对SD降解的影响。在实验条件下,SD在砂土、壤土和粘土中降解均较慢,其降解的快慢顺序为:砂土>壤土>粘土,这可能是因为粘土中粘土矿物含量较高、吸附性强而导致SD难降解的缘故;并且随着浓度的增加,SD在未灭菌砂土中的降解速率常数逐渐减小,这可能是因为SD浓度较大,强烈抑制微生物的活性而导致降解作用减弱;温度对其也有影响,随着温度的升高,SD在未灭菌砂土中的降解速率常数明显增大,但升至一定温度后降解速率常数反而下降,其原因可能是308.15 K更接近于微生物的最适温度而使微生物异常活跃,易降解SD。通过实验得到6种磺胺药物的微生物降解速率常数大小顺序为SMD=SMX>SDM>SMM>SD>SMT,这可能与磺胺类药物在砂土中稳定性的大小及其抑菌性强弱有关。
土壤中的药物主要来自于动物的粪便,Wang等[20]的研究证明,粪便在作为肥料施入到土壤之前储存一段时间,有利于部分消除其中的磺胺二甲嘧啶,因为粪便中的降解微生物比土壤中的多,它们加快了磺胺二甲嘧啶的降解。但是储存的时间不能过长,否则会增加磺胺二甲嘧啶的吸附,降低其降解率。由于磺胺类药物降解缓慢,重复施用含有磺胺类药物及其代谢物的粪肥,会对土壤造成多次污染,并使其在土壤中蓄积,这会增加其在土壤中降解的难度,降解周期也会比实验条件下得到的数据更长,对土壤和作物的危害也越大。
磺胺类药物的代谢产物在排出体外后会重新转化为母体药物。段丽丽等[4]对磺胺二甲嘧啶及其主要代谢产物N4乙酰磺胺二甲嘧啶在砂质壤土中转化的研究表明,N4乙酰磺胺二甲嘧啶在受试土壤中可部分的转化成母体化合物磺胺二甲嘧啶。Berger等[3]也报道,液体粪肥中代谢产物 N4乙酰磺胺可转化为母体药物磺胺二甲嘧啶。代谢物在废水和天然水中也可能会转变为母体化合物。不过,目前还没有羟基或其他代谢产物转化为母体药物的报道。
2.2 磺胺类药物在水中的降解
河流和湖泊中磺胺类药物主要通过微生物作用和光作用进行降解。张从良等[21]通过室内模拟降解实验,分别研究了SD在湖水和猪场废水中的好氧和厌氧微生物降解。结果显示:在好氧条件下,SD在湖水和猪场废水中的降解主要是由水解和化学降解等非生物降解作用引起的,而由微生物引起的降解作用则较小;在厌氧条件下,SD在湖水中的降解主要是由水解和化学降解等非生物降解作用引起的,而在猪场废水中的降解主要是由微生物降解作用引起的。这说明由于外界环境中有机物含量的不足和磺胺类药物的抑菌性,非生物降解是其在湖水中主要的降解方式。并且实验中磺胺类药物降解得很慢,湖水中的降解半衰期最长可达400 d,最少也要115 d。Perez等[22]的研究也反应了磺胺二甲嘧啶,SMZ,STZ在地表水环境中降解缓慢。
吴南村等[23]采用 Fenton氧化技术对 SD污染的水体进行研究,经过1 h的反应SD的降解率达到了99.8%,取得了很好的效果。但是Fenton技术由于费用高,对微量的抗生素比较有效,因而作用范围有限。
2.3 磺胺类药物的光降解
已有的研究表明,磺胺类药物在土壤中的降解符合一级反应方程式[19,24],但是关于生物降解的过程和中间产物的研究鲜有报道,光降解在实际环境条件下的产物也没有被证实。Andreozzi等[25]研究表明在加盐的去有机物水中,SMZ的日照降解速率很快,半衰期为2.4 d,加入硝酸根离子会加快其降解半衰期,同时研究表明,腐植酸可作为SMZ的光敏剂。Boreen等[26]对5种有不同杂环取代基的磺胺类药 (SMZ,磺胺异噁唑,磺胺甲二唑,STZ,磺胺噁唑)的光降解机理进行研究,发现杂环取代基的特性和溶液的pH会直接影响它们的光解效率,从而,导致结构相似的化合物光降解效率差别很大,在相同条件下,STZ降解最快,磺胺异噁唑和磺胺甲二唑稍慢,SMZ降解最慢。它们可能的光降解断裂点[27]见图 2。到目前为止,辨别的磺胺类药一部分光降解产物有SD,磺胺酸,苯胺,对苯二酚,奎宁,羧酸和二羧酸[28],其中多篇报道证明了磺胺酸的存在[29-32]。Jung 等[32]在研究磺胺类药物的光损害时发现,光照类型比光照强度和时间重要,自然光降解磺胺类药物主要是由于其中的紫外光。
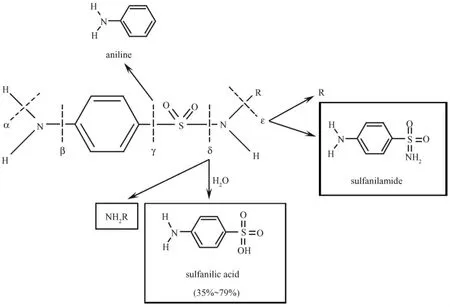
图2 磺胺类药物直接光解可能的断裂位置
Baran等[33]研究了磺胺乙酰、STZ、SMZ和 SD及其光催化降解产物在水中的毒性和生物降解性,结果表明,磺胺类药物的生物降解较慢,其毒性与供试藻类的种属有关,EC50随磺胺乙酰、STZ、SMZ和SD顺序依次增大。磺胺类药物光催化降解中间产物的毒性显著低于本体药物,其大小取决于光照时间和降解速率,并且中间有机产物可能通过生物作用完成矿化。
3 小结
随着集约化养殖的发展,越来越多的磺胺类药物被用于治疗和促进畜禽的生长,但同时也造成严重环境污染和动物源性药物残留问题,这已引起全世界人们关注。发达国家已有非常完善的残留监控体系。我们国家这方面的研究开始得较晚,对于磺胺类药物在环境中的吸附和迁移的研究还只是停留在实验室的水平,没有在真实客观的环境下研究其存留和迁移动向,建立区域生态系统中磺胺药物的吸附和迁移动态模型。对于磺胺药物及其代谢物在环境中降解的研究只是在表观的水平,没有深入的从微观方面研究它们的降解机理和产物。在研究土壤和水体环境中磺胺类药物降解产物和机理时,要综合考虑植物、气候等多方面的环境因素,综合考虑微生物降解和非生物降解 (如光降解)等各种降解作用之间的相互影响,以及磺胺代谢物转变为母体药物可能导致去除率的误判。微生物降解产物和机理是研究的重点,其对进行受污染土壤和水体的修复起到关键的作用,也有利于污水处理厂处理含磺胺类药物废水的工艺改进。由于有关磺胺类药物代谢和降解产物的报道较少,各种数据很缺乏,使研究面临诸多的困难,这就要求拓宽研究思路,创新分析方法。
[1]张志洁.磺胺类药物残留分析方法 [J].山东食品发酵,2004(2):43-45.
[2]Sarmah A K,Meyer M T,Boxall A B A.A global perspective on the use,sales,exposure pathways,occurrence,fate and effects of veterinary antibiotics(VAs)in the environment[J].Chemosphere,2006,65:25-759.
[3]Berger K,Perterson B,Buening-Pfaune H.Persistence of drugs occurring in liquid manure in the food chain [J].Arch Lebensmittelsh,1986,37:99-102.
[4]段丽丽.磺胺二甲嘧啶及其主要代谢产物在砂质壤土中转归的研究 [D].北京:中国农业大学,2005.
[5]常红,胡建英,王乐征,等.城市污水处理厂中磺胺类抗生素的调查研究 [J].科学通报,2008,53(2):159-164.
[6]李彦文,莫测辉,赵娜,等.菜地土壤中磺胺类和四环素类抗生素污染特征研究 [J].环境科学,2009,30(6):1762-1766.
[7]Lindsey M E,Meyer M E M,Thurman E M,et al.Analysis of trace levels of sulfonamide and tetracycline antimicrobials in ground-water and surface water using solid-phase extraction and liquid chromatography [J].Mass Spectrometry,2001,73:4640-4646.
[8]Boxall ABA,Kolpin D W,Halling-Sorensen B,et al.Are veterinary medicines causing environmental risks?[J]Environ.Sci Technol,2003,37:286-294.
[9]王冉,刘铁铮,耿志明,等.兽药磺胺二甲嘧啶在土壤中的生态行为 [J].土壤学报,2007,44(2),307-311.
[10]Boxall A B A, Blackwell P, Cavallo R, et al. The sorptionand transport of a sulphonamide antibiotic in soil systems[J].Toxicology Let ters,2002,131:19-28.
[11]陈昦,张劲强,钟明,等.磺胺类药物在太湖地区典型水稻土上的吸附特征 [J].中国环境科学,2008,28(4):309-312.
[12]孔晶晶,裴志国,温蓓,等.磺胺嘧啶和磺胺噻唑在土壤中的吸附行为 [J].环境化学,2008,27(6),732-741.
[13]Gao J,Pedersen J A.Adsorption of sulfonamide antimicrobial agents to clay minerals [J].Environ Sci Technol,2005,39:9509-9516.
[14]文春波,张从良,王岩.磺胺嘧啶在土壤中的降解与迁移研究 [J].农业环境科学学报,2007,26(5):1677-1680.
[15]Luciana M,SalvatoreC,MaurizioF. Phytotoxicitytoand uptake of enrofloxacin in crop plants[J].Chemosphere ,2003,52:1233-1244.
[16]金彩霞,陈秋颖,刘军军,等.两种常用兽药对作物发芽的生态毒性效应 [J].环境科学学报,2009,29(3):619-625.
[17]Coats J R,Metcalf R L,Lu P Y,et al.Model ecosystem evaluation of the environmental impacts of the veterinary drugs phenothiazine, sulfametazine, clopidoland diethylstilbestrol[J].Envir Health Perspect,1976,18:167-179.
[18]Halling-Serensen B,Lykkeberg A ,Ingerslev F ,et al.Characterization ofthe a biotic degradation pathways of oxytetraeyclines in soil interstitial water using LC-MS-MS [J].Chemosphere,2003,50(10):1331-1342.
[19]张从良,王岩,王福安,等.磺胺类药物在土壤中的微生物降解 [J].农业环境科学学报,2007,26(5):1658-1662.
[20]Wang Qiquan,GuoMingxin, ScottR Yates. Degradation kinetics of manure-derived sulfadimethoxine in amended soil[J].Journal of agricultural and food chemistry,2006 ,54(1):157-163.
[21]张从良,王岩,王福安,等.磺胺嘧啶在水中的微生物降解研究 [J].生态环境,2007,16(6):1679-1682.
[22]Perez S,Eichhorn P,Aga D S.Evaluating the biodegradability of sulfamethazine, sulfamethoxazole, sulfathiazole, and trimethoprim at different stages of sewage treatment[J].Environ Toxicol Chem,2005,24(6):1361-1367.
[23]吴南村,尹平河,赵玲,等.水体中微污染磺胺嘧啶药物的氧化降解 [J].生态环境,2008,17(6):2183-2186.
[24]金彩霞,陈秋颖,吴春艳,等.环境条件对土壤中磺胺间甲氧嘧啶降解的影响.环境污染与防治,2009,31(9):10-14.
[25]Andreozzi R,Raffaele M,Nicklas P.Pharmaceuticals in STP effluents and their solar photodegradation in aquatic environment[J].Chemosphere,2003,50:1319-1330.
[26]Boreen A L,Arnold X A,McNeill K.Photochemical fate of sulfa drugs in the aquatic environment:Sulfa drugs containing five-membered heterocyclic groups [J].Environ Sci Technol,2004,38(14):3933-3940.
[27]Zhou W, Moore D E. Photochemical decomposition of sulfamethoxazole[J].Int J Pharm,1994,110:5-63.
[28]Vree T B,vander Ven,Verwey-van Wissen,et al.Isolation,identification and determination of sulfamethoxazole and its known metabolitesin human plasma and urine by highperformance liquid chromatography [ J]. Journal of Chromatography B:Biochemical Sciences and Applications,1994,658:327-340.
[29]Weiss B,Duerr H,Haas H J.Photochemistry of sulfonamides and sulfonylureas:A contribution to the problem of lightinduced dermatoses[J].Chem,1980,92:648-650
[30]ChignellC F, Kalyanaraman B, Mason R P, etal.Spectroscopic studies of cutaneous photosensitizing agents-I.Spin trapping of photolysis products from sulfanilamide,4-aminobenzoic acid and related compounds [J].Photochem Photobiol,1980,32:563-571.
[31]Chignell C F, Kalyanaraman B, Sik R H, et al.Spectroscopic studies of cutaneous photosensitizing agents-II.spin trapping of photolysis products from sulfanilamide and 4-aminobenzoic acid using 5,5-dimethyl-1-pyrroline-1-oxide[J].Photochem Photobiol,1981,34:147-56.
[32]Motten A G,Chignell C F.Spectroscopic studies of cutaneous photosensitizing agents-Ⅲ.spin trapping of photolysis products from sulfanilamide analogs [J].Photochem Photobio,1983,37:17-26.
[32]Jung J Y,Younghee K,Jungkon K,et al.Environmental level sofult raviolet light potentiate the toxicity of sulfonamide antibiotics in Daphnia magna [J].Ecotoxicology,2008,10(1):37-45.
[33]Baran W, Sochacka J, Wardas W. Toxicity and biodegradability of sulfonamides and products of their photocatalytic degradation in aqueous solutions [J].Chemosphere,2006,65(8):1295-1299.
