地西他滨抗套细胞淋巴瘤细胞株Jeko-1作用机制的研究
2011-05-30耿梅费爱梅刘静静聂瑞敏王瑾糜坚青
耿梅 费爱梅 刘静静 聂瑞敏 王瑾* 糜坚青*
1.上海交通大学医学院附属瑞金医院上海血液学研究所,医学基因组学国家重点实验室,△肿瘤放化疗科,*血液科,上海200025;
2.中国科学院上海生命科学研究院生物化学与细胞生物研究所,上海 200031
套细胞淋巴瘤(mantle cell lymphoma,MCL)约占非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)的6%[1],WHO描述其最显著的遗传学特征是t(11;14)(q13;q32)易位,导致Cyclin D1的过表达[2]。MCL多发于老年男性,常累及骨髓和胃肠道,临床上被认为是兼有惰性和侵袭性的恶性淋巴瘤。目前, R-hyperCVAD、R-CHOP、R-EPOCH已成为MCL的一线治疗方案[3-5],随着新药的不断开发,苯达莫司汀、硼替佐米、克拉曲滨及氟达拉滨等也在临床上起到了一定的效果[6-10],使 MCL的中位生存期由原来的3年延长至5年[11]。虽然这些药物为MCL患者带来了更多的选择,但是MCL仍被认为是一种难治的恶性淋巴瘤。
地西他滨抗白血病作用的研究至今有40年,治疗急性髓细胞白血病(acute myelocytic leukemia,AML)、骨髓增生异常综合征( myelodysplastic syndrome,MDS)及慢性粒细胞白血病(chronic myelogenous leukemia,CML)有较好的疗效,而治疗其他血液系统恶性肿瘤的潜力正在研究中。在一些基础实验中发现,其对一些肿瘤细胞包括结肠癌细胞株、白血病细胞株有明显增殖抑制作用[12]。目前,鲜见有关地西他滨对MCL细胞株作用的报道。本文探讨地西他滨抗MCL细胞的作用机制。
1 材料和方法
1.1 主要试剂
RPMI细胞培养液和胎牛血清购自Gibco公司;地西他滨购自SuperGen公司,以磷酸盐缓冲液(PBS)溶解;MTT购自Sigma 公司;Annexin V/PI细胞凋亡检测试剂盒购自BD公司;DiOC6(3)染料购自Molecular Probes公司。Cyclin D1抗体购自Santa Cruz公司;caspase3、caspase9抗体、辣根过氧化酶标记的抗兔、抗鼠二抗购自Cell Signaling公司;β-actin抗体购自Sigma 公司。
1.2 细胞株与细胞培养
细胞株Jeko-1购自美国细胞、菌种库(American Type Culture Collection,ATCC),以每毫升3×105~5×105个的密度接种于含20%胎牛血清和100 U/mL青霉素、100 U/mL链霉素的RPMI-1640培养液中,置于37 ℃、CO2体积分数为5%、饱和湿度的温箱培养。
1.3 MTT法检测地西他滨对细胞增殖的影响
取对数生长期的Jeko-1细胞接种到96孔板,每孔200 μL,每孔细胞数调整为2×104个,加入地西他滨,使其终浓度分别为0.01、0.1、1、10和100 μmol/L,空白组加含20%小牛血清的RPMI-1640培养基,另设置阴性对照组,每种浓度4个复孔。置于培养箱中培养24、48和72 h后,加入MTT (5 mg/mL)20 μL,继续温育4 h后,平板1 500 ×g离心15 min,吸掉180 μL上清液,每孔加入180 μL DMSO,然后置于摇床振荡20 min,使结晶物充分溶解,用酶标仪检测570 nm各孔的吸光度(A)值,其平均值减去空白对照值为纵坐标,时间为横坐标。肿瘤抑制率(%)=(A对照组-A药物组)/A对照组×100%,实验重复3次。
1.4 流式细胞术检测细胞凋亡
用含不同终浓度地西他滨(0.01、0.1、1和10 μmol/L)的培养基培养Jeko-1细胞,设置24、48和72 h组和对照组,收集待检测细胞2×105个,PBS洗2次后,用1 mL结合缓冲液(binding buffer)重悬。取细胞悬液100 μL(1×105个细胞)加入5 μL Annexin V-FITC和5 μL PI,轻轻混匀,于室温暗处温育15 min,加入结合缓冲液后,流式细胞仪检测细胞凋亡率。实验重复3次。
1.5 线粒体跨膜电位检测
用含不同终浓度地西他滨(0.01、0.1、1和10 μmol/L)的培养基培养Jeko-1细胞,设置48和72 h组和对照组,收集待检测细胞3×105个,加入20 nmol/L DiOC6(3),置于37 ℃温育15 min,然后用PBS洗2次,再用PBS重悬细胞,流式细胞术检测 DiOC6(3) 荧光强度(F1通道)。DiOC6(3)阴性的细胞被认为是线粒体跨膜电位丢失的细胞。实验重复3次。
1.6 Western blot 检测凋亡途径的相关蛋白
收集终浓度为0.1、1和10 μmo/L的地西他滨作用72 h后的Jeko-1细胞,用含1 mmol/L PMSF的RIPA裂解液(购自碧云天公司)裂解细胞,抽提细胞总蛋白,测定蛋白浓度,上等量的蛋白通过SDS-聚丙烯凝胶电泳2 h,湿转印至膜,5%脱脂奶粉封闭1 h后,温育相应的一抗,4 ℃过夜,用辣根过氧化物酶(HRP)的二抗室温温育1 h,显色、图像采集以及分析处理。实验重复3次。
1.7 亚硫酸氢盐测序PCR(bisulfite sequencing PCR,BSP)检测PCDH8甲基化
提取对照和用药72 h的细胞基因组DNA,定量后,取2 μg DNA溶于50 μL双蒸水(double distilled water,DDW),加入氢氧化钠,42 ℃水浴30 min。加氢醌及亚硫酸氢钠,50 ℃避光水浴16 h,吸取混合液至EP管中。加盐酸胍过柱纯化后,加入氢氧化钠,室温放置15 min,经乙酸钠、糖原和冰无水乙醇处理后,置于-20 ℃条件下过夜沉淀。离心后加乙醇,重复多次,最后将无水酒精沉淀溶解于20~30 μL DDW,以此为模板。按照引物进行扩增(M-PCDH8-F:5’-GTTTTAATAGGGTTATTTTGGGAAG-3’;M-PCDH8-R:5’-CATAACCTACTCAATAAA ACCCTTC-3’),割胶回收各BSP产物,选用pUC18-T质粒为载体连接,转化感受态细胞SK2301,进行筛选、扩菌、提取质粒DNA,用3730测序列分析仪进行测序,由上海生工生物公司完成。
1.8 统计学处理
采用SPSS 11.0统计学软件,数据结果以表示,用析因方差分析进行统计学处理。P<0.05为差异有统计学意义。100 μmol/L地西他滨作用72 h后细胞增殖抑制率分别为(17.89±6.40)%、(42.16±6.58)%、(5 7.9 7±2.9 1)%、(7 3.0 2±0.7 2)%和(71.73±1.80)%。地西他滨作用不同时间(24、48和72 h)后,Jeko-1细胞增殖抑制率间差异有统计学意义(P<0.001);使用不同药物浓度(0.01、0.1、1、10和100 μmol/L)的地西他滨作用后,Jeko-1细胞增殖抑制率除地西他滨浓度为10、100 μmol/L之间差异无统计学意义之外(P>0.05),其他各浓度药物两者之间差异均有统计学意义(P<0.001)。
2 结 果
2.1 地西他滨抑制Jeko-1细胞的增殖
加入地西他滨后,在显微镜下观察发现,Jeko-1细胞明显皱缩,细胞密度减少。MTT法检测发现,地西他滨对Jeko-1细胞增殖的抑制作用呈剂量和时间依赖性,随着剂量的增高和作用时间的延长,对MCL细胞增殖抑制作用越明显(图1)。经0.01、0.1、1、10和

2.2 地西他滨诱导Jeko-1细胞凋亡
不同浓度的地西他滨可以使Jeko-1细胞发生凋亡,且作用呈剂量和时间依赖性,差异有统计学意义(P<0.001)。1、10 μmol/L的地西他滨作用于Jeko-1细胞24、48和72 h后的细胞凋亡率分别为(15.77±1.44)%、(21.00±3.33)%、(3 6.7 7±3.4 9)%和(1 7.6 0±1.9 5)%、(24.37±2.42)%、(45.3±3.67)%(图2)。

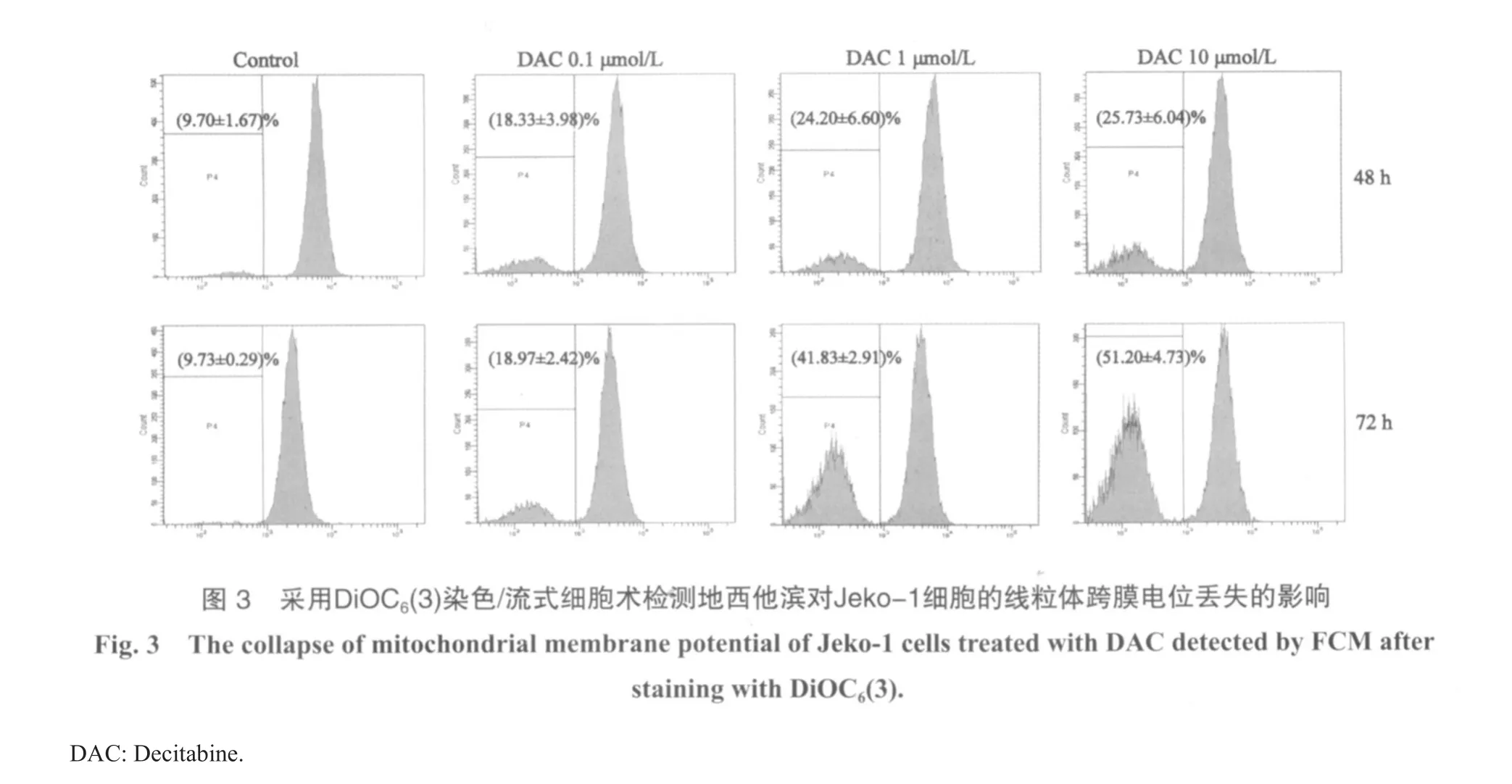
2.3 地西他滨引起线粒体跨膜电位丢失
用不同终浓度(0.1、1和10 μmol/L)的地西他滨作用Jeko-1细胞48 h后,线粒体跨膜电位丢失的细胞分别占(9.70±1.67)%、(1 8.3 3±3.9 8)%、(2 4.2 0±6.6 0)%和(25.73±6.04)%;温育72 h后线粒体跨膜电位丢失细胞占(9.73±0.29)%、(18.97±2.42)%、(41.83±2.91)%和(51.20±4.73)%。作用24、48和72 h后,线粒体跨膜电位的丢失差异有统计学意义(P<0.001)。在不同浓度的西他滨作用Jeko-1细胞后,引起线粒体跨膜电位的丢失除1和10 μmol/L之间差异无统计学意义之外(P>0.05),其他各浓度药物两两之间差异均有统计学意义(P<0.001)。结果显示随着药物浓度升高或处理时间的延长,线粒体跨膜电位丢失的细胞百分比相应增多(图3)。
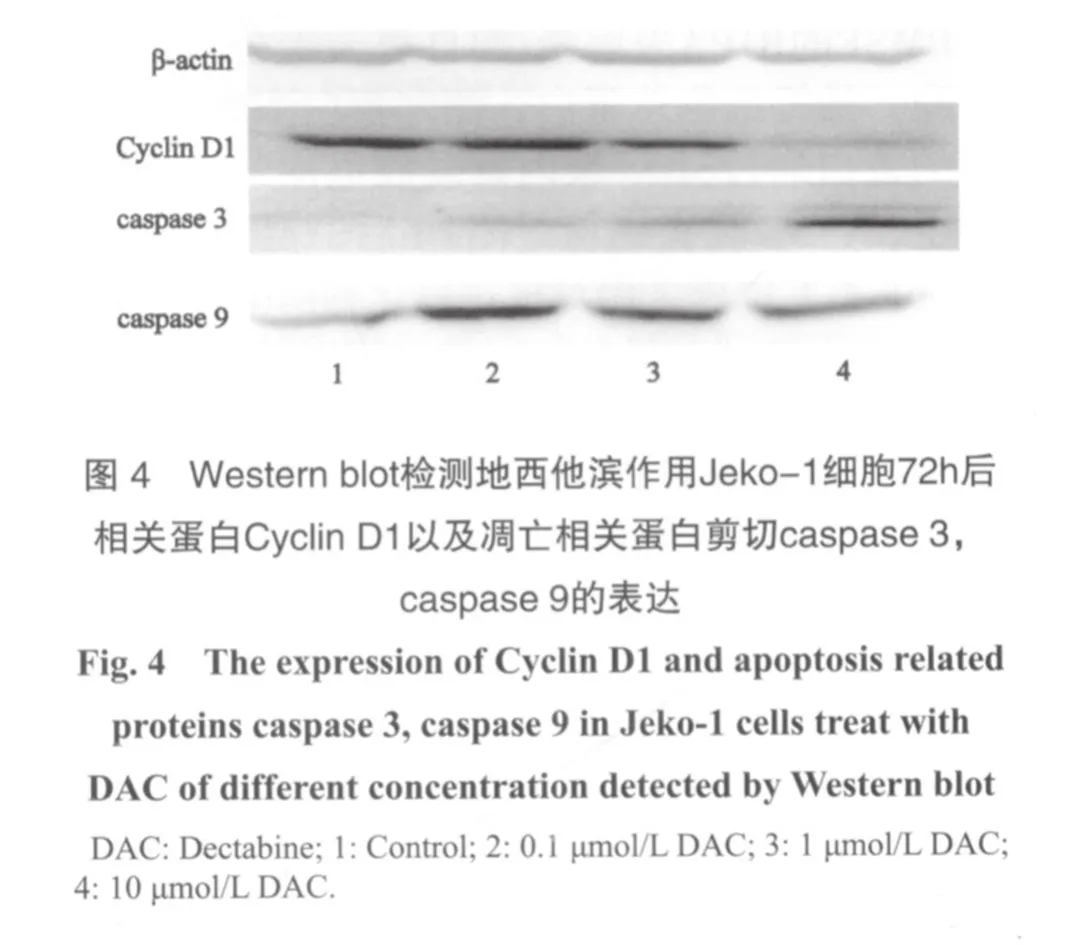
2.4 地西他滨引起Jeko-1细胞凋亡相关蛋白表达
1和10 μmol/L的地西他滨作用Jeko-1细胞72 h后,采用Western blot法检测caspase家族蛋白的活化情况,发现剪切caspase3、caspase9蛋白水平明显增高,而MCL细胞中Cyclin D1的表达量明显下降,其中以10 μmol/L的地西他滨作用更明显(图4)。
2.5 Jeko-1细胞中PCDH8基因启动子CpG岛的甲基化检测
亚硫酸氢盐测序PCR实验结果发现:Jeko-1细胞中PCDH8启动子CpG岛的甲基化率为76.67%,经过地西他滨0.5、2和5 μmol/L处理72 h后,Jeko-1细胞的PCDH8启动子CpG岛的甲基化率分别下降至48.33%、70%和65%,其中低浓度(0.5 μmol/L)地西他滨所起的去甲基化作用较高浓度(2和5 μmol/L)更加明显(图5)。
3 讨 论

体外实验发现,地西他滨具有时间和剂量依赖性的细胞增殖抑制作用,高浓度的地西他滨具有细胞毒性作用,低浓度时则起轻度诱导分化髓性白血病细胞的作用。近期又有文献进一步报道,低浓度的地西他滨可作为特异的 DNA甲基化转移酶抑制剂,可逆转DNA的甲基化过程,诱导肿瘤细胞向正常细胞分化或诱导肿瘤细胞凋亡。本研究采用地西他滨作用MCL细胞株Jeko-1的体外实验发现,随着药物浓度的增加,培养时间的延长,Jeko-1细胞的增殖和凋亡也逐渐增加。Gomyo等[13]等研究发现,地西他滨通过诱导caspase9活化,激发线粒体凋亡途径,增加诱导p53引起人肺癌细胞株的凋亡。Schhmelz等[14]在研究使用地西他滨诱导AML细胞凋亡机制中同样发现,在大多数AML细胞株中,活化线粒体凋亡途径,释放细胞色素C和AIF,以及线粒体跨膜电位的丢失与细胞凋亡有关,同时检测到了caspase3的活化,其相应蛋白表达明显增加。本研究发现Jeko-1细胞经过地西他滨处理后,引起线粒体跨膜电位丢失,并与培养和药物时间的延长和浓度呈正相关。地西他滨作用72 h后,caspase3和caspase9被激活,Western blot显示这些相应蛋白表达增强,且与浓度呈正相关。由此可见,高浓度的地西他滨主要通过激活线粒体凋亡途径而诱导MCL细胞凋亡。通常MCL具有Cyclin D1的过表达,Cyclin D1能促使细胞从G1期向S期转化。本研究发现,经高浓度的地西他滨处理72 h后,淋巴瘤细胞的Cyclin D1表达下降明显,细胞不能向S期转化,从而造成增殖抑制。
目前,人们发现肿瘤的发生、发展与一些抑癌基因启动子的高甲基化有关。Hutter等[15]发现MCL患者标本中,细胞周期调控基因P14、P15和P16启动子CpG岛的甲基化率分别为70%、62%和9%。Leshchenko等[16]采用基因芯片检测MCL患者标本与细胞株,发现抑癌基因PCDH8启动子CpG岛的甲基化与正常人相比,处于高甲基化状态。PCDH8是一种原钙黏附蛋白,属于钙黏附蛋白家族中具有特殊功能的新一类分支家族。研究发现,多数原钙黏附蛋白家族均显示为抑癌基因的特性[17-19]。本研究用BSP方法检测了Jeko-1细胞中PCDH8启动子CpG岛的甲基化率为76.67%,处于高甲基化状态,经过地西他滨0.5、2和5 μmol/L处理72 h后,Jeko-1细胞的PCDH8启动子CpG岛的甲基化率分别下降至48.33%、70%和65%。其中经低浓度的地西他滨处理后,细胞内PCDH8启动子CpG岛的去甲基化作用尤为明显。由此可见,小剂量的地西他滨还可以通过使抑癌基因去甲基化而起到抗肿瘤作用。
综合上述,本研究证实了地西他滨可以诱导MCL Jeko-1细胞的增殖抑制和凋亡,其中线粒体凋亡途径在凋亡途径中起到了重要的作用;高浓度的地西他滨可以降低MCL过表达靶蛋白Cyclin D1的表达水平,低浓度的地西他滨可通过去甲基化而起到抗肿瘤作用,为临床治疗MCL提供了一定的实验依据。
[1]Armitage JO, Weisenburger DD.New approach to classifying non-Hodgkin’s lymphoma: clinical features of the major histologic subtypes.Non-Hodgkin’s Lymphoma Classifcation Project[J].J Clin Oncol, 1998, 16(8): 2780-2795.
[2]Bertoni F, Rinaldi A, Zucca E, et al.Update on the molecular biology of mantle cell lymphoma[J].Hematol Oncol, 2006,24(1): 22-27.
[3]Romaguera JE, Fayad L, Rodriguez MA, et al.High rate of durable remissions after treatment of newly diagnosed aggressive mantle-cell lymphoma with rituximab plus hyper-CVAD alternating with rituximab plus high-dose methotrexate and cytarabine[J].J Clin Oncol, 2005, 23(28): 7013-7023.
[4]Lenz G, Dreyling M, Hoster E, et al.Immunochemotherap with rituximab and cyclophosphamide, doxorubicin, vincristine and prednisone significantly improves response and time to treatment failure, but not long-term outcome in patients with previously untreated mantle cell lymphoma: results of a prospective randomized trial of the German Low Grade Lymphoma Study Group (GLSG)[J].J Clin Oncol, 2005,23(9): 1984-1992.
[5]Jermann M, Jost LM, Taverna C, et al.Rituximab-EPOCH,an effective salvage therapy for relapswd, refractory or transformed B-cell lymphomas: results of a phase Ⅱ study[J].Ann Oncol, 2004, 15(3): 511-516.
[6]Robinson KS, Wiliams ME, van der Jagt RH, et al.Phase Ⅱmulticenter study of bendamustine plus rituximab in patients with relapsed indolent B-cell and mantle cell non-Hodgkin’s lymphoma[J].J Clin Oncol, 2008, 26(27): 4473-4479.
[7]Fisher RI, Bernstein SH, Kali BS, et al.Multicenter phaseⅡ study of bortezomib in patients with relapsed or refractory mantle cell lymphoma[J].J Clin Oncol, 2006, 24: 4867-4874.
[8]Rummel MJ, Chow KU, Jager E, et al.Treatment of mantlecell lymphoma with intermittent two-hour infusion of cladribine as first-line therapy or in first relapse[J].Ann Oncol, 1999, 10(1): 115-117.
[9]Mohrbacher A, Khan AU, Tulpule A, et al.Result of a pilot trial of a fludarabine,mitoxantrone and rituximab in mantle cell lymphoma[J].J Clin Oncol, 2004, 22(14suppl): 6697.
[10]Forstpointner R, Dreyling M, Repp R, et al.The addition of rituximab to a combination of fludarabine, cyclophosphamide,mitoxantrone (FCM) significantly increases the response rate and prolongs survival as compared to FCM alone in patients with relapsed and refractory follicular and mantle cell lymphoma results of a prospective randomized study of the German low grade lymphoma study group (GLSG) [J].Blood, 2004, 104(10): 3064-3071.
[11]Herrmann A, Hoster E, Zwingers T, et al.Improvement of overall survival in advanced stage mantle cell lymphoma[J].J Clin Oncol, 2009, 27(4): 511-518.
[12]Stresemann C, Brueckner B, Musch T, et al.Functional diversity of DNA methyltransferase inhibitors in human cancer cell lines [J].Cancer Res, 2006, 66(5): 2794-2800.
[13]Gomyo Y, Sasaki J, Branch C, et al.5-aza-2'-deoxycytidine upregulates caspase-9 expression cooperating with p53-induced apoptosis in human lung cancer cells[J].Oncogene, 2004, 23(40): 6779-6787.
[14]Schmelz K, Wagner M, Dörken B, et al.5-Aza-2-deoxycytidine induces p21WAF expression by demethylation of p73 leading to p53-independent apoptosis in myeloid leukemia[J].Int J Cancer, 2005, 114(5): 683-695.
[15]Hutter G, Scheubner M, Zimmermann Y, et al.Differential effect of epigenetic alterations and genomic deletions of CDK inhibitors [p16(INK4a), p15(INK4b), p14(ARF)]in mantle cell lymphoma[J].Genes Chromosomes Cancer, 2006,45(2): 203-210.
[16]Leshchenko VV, Kuo PY, Shaknovich R, et al.Genomewide DNA methylation analysis reveals novel targets for drug development in mantle cell lymphoma[J].Blood, 2010,116(7): 1025-1034.
[17]Yu J, Cheng YY, Tao Q, et al.Methylation of protocadherin 10, a novel tumor suppressor, is associated with poor prognosis in patients with gastric cancer[J].Gastroenterology, 2009,136(2): 640-651.
[18]Yu JS, Koujak S, Nagase S, et al.PCDH8, the human homolog of PAPC, is a candidate tumor suppressor of breast cancer[J].Oncogene, 2008, 27(34): 4657-4665.
[19]Kawaguchi M, Toyama T, Kaneko R, et al.Relationship between DNA methylation states and transcription of individual isoforms encoded by the protocadherin-alpha gene cluster[J].J Biol Chem, 2008, 283(18): 12064-12075.
