PDCA在药品不良反应监测管理中的应用
2011-05-30黄之训
黄之训
(上海市同济医院,同济大学附属同济医院药剂科,上海200065)
药品不良反应(adverse drug reaction,ADR)监测质量依靠诸多方面的因素保证,加强对ADR监测网络的管理、完善监测体系是保证ADR监测工作可持续发展,并得到持续质量改进[1]的重要环节。运用PDCA(Plan(计划),Do(执行),Check(检查),Action(处理))循环原理,对实践、提高ADR监测管理质量,具有实际效应和现实意义。
PDCA是在50年代由美国质量管理专家戴明(W.E.Deming)博士提出,又称“戴明环”,其作用能使任何一项活动有效进行,并在提高管理质量和效益所进行的计划、实施、检查和处理等工作中不断循环,持续改进。近年来我院在ADR监测管理中引用PDCA方法取得较好效果。
1 一般资料
我院是上海西北部地区一所“三甲”综合性医院,核定床位1 080张,门急诊165万人次/年。2003年3月院内设置了药品不良反应监测委员会,机构内有行政、医务职能、临床医疗、护理、临床药学委员若干成员,2003年至2006年底的四年中委员会成员名单未作变更过。2003年至2006年呈报ADR监测报告分别为70例、96例、134例、398例。
2 PDCA循环管理方法
PDCA循环管理分8个步骤,见图1(小环带动大环)。
2.1 计划阶段(Plan)
通过计划确定质量管理的方针、目标以及实现该方针和目标[2]的行动计划和措施,包括以下四个步骤:①分析现状,找出存在的问题。②找出主要的影响原因。③针对找出的问题,分析产生的原因和影响因素。④制定改善质量的措施,提出行动计划,并预计效果。
2.1.1现状与问题①2007年前,每年收集上报的ADR报告中无效报告占总报告量48%左右。②医师、护士对ADR/药品不良事件(adverse drug event,ADE)的认知度低,不完全知道发生ADR要报告。③制度不健全也不完善。④缺少监测信息通报平台。
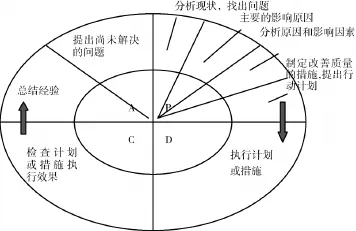
图1 PDCA循环管理步骤
2.1.2主要影响原因①ADR监测体系不完善,制度不完备。②相关人员不能定期接受ADR知识培训,以致发生ADR时不能科学应对,成为ADR漏报较高的主要原因。
2.1.3分析问题产生的原因和影响因素①ADR监测委员会成员只在纸上(红头文件);2003-2006年四年间监测委员会成员未作调整,人员流动造成机构成员不全,监测网络不完整;机构领导未行使管理职能,没人主动关心监测工作重点及开拓、创新。②没有专职管理人员,缺少常态化的主动管理,不能及时或定期总结监测工作中的问题,一些明显的监测工作缺陷处于放任状态,机构不作为。③ADR监测、报告表填写缺少规范化、标准化,填表缺项率高导致无效报告百分率高。④医师、护士对ADR/ADE的认知度低,兼职ADR信息员未发挥作用,缺少常态的接受ADR知识和技能宣传、培训教育,造成ADR监测不力。⑤缺少院间、社会、媒体交流及信息化平台,无法提升技能素质。⑥缺少处罚、奖励机制,难以监管自发呈报系统和自愿呈报体系。⑦制度不完善(包括退药制度、ADR监测制度、错误用药报告制度、监测报告流程),造成漏报、不报现象较重。
2.1.4制定改进目标及措施,提出行动计划(系统改进建议) ①完善院内监测网络体系:定期调整、补充ADR监测委员会及网络成员,弥补因人员流动出现的空缺和工作空白点;设立监测委员会常务秘书负责日常管理事务;设立ADR专职药师处理ADR临床会诊、报告分析、评估。②强化制度规范建设:建立ADR监测工作的制度化、规范化、标准化机制,ADR从发现、报告、分析、确认,到信息通报、控制与处理等一整套制度与流程需完善,特别亟待建立突发事件的快速反应处理机制和有关规定,提高药品突发安全事件的应急管理能力。③建立机构与职能部门协调机制:设立ADR联络员挂靠医务处,负责医技、职能部门沟通,联络及维护信息平台;增加医疗体系考核中ADR监测工作的权重和话语权,从机制上调动临床、医技部门的监测工作积极性,推动监测工作健康可持续发展。④建立传报渠道及技术支撑:增设ADR报告接受点及ADR报告投递箱,为临床监测、报告人员提供较方便的就近传送点;公开ADR专职药师办公座机和手机号,提供及时、专业的技术咨询和急会诊。⑤建立专家咨询服务机制:发挥专家库作用,科学评价报告,提取有益信息,为监测工作提供技术支撑。⑥建立监测信息定期通报机制及信息共享平台:除监测信息数据分析反馈外还应及时通报国家重点监测品种及药物警戒信息。⑦建立人员素质提高机制:组织ADR专业知识和技能的宣传、培训、交流、沟通、总结,鼓励参与科研和撰写药物警戒相关论文。⑧建立奖优罚劣评优机制:对ADR监测、报告积极、主动、认真的医务人员给予年度评优和绩效奖励,对季度ADR监测考核不合格的临床科室科主任给予经济处罚。
2.2 执行计划或措施阶段(Do)
2.2.1完善制度、规范监测①修订院内ADR监测委员会工作细则,明确监测分工,责任到位。②组织编写了ADR/ADE事件监测和报告工作规范,规范ADR呈报流程及报告填报要求。③增补ADR监测工作制度、药物治疗错误监测报告制度、药害事件监测报告制度、药事应急管理制度、ADR报告标准操作规程、药害事件处理程序,明确了发生突发性药害事件快速反应及标准处置方法。④修订退药管理制度,限定因ADR退药必须填写ADR报告。
2.2.2常态化管理院内监测网络体系①2007-2010年以发文形式三次调整ADR监测委员会成员,使其成员更适应常态工作需要。②ADR监测委员会每年两次会议,会议形成的决议及时通过院内办公自动化(OA)系统传达到临床。③监测委员会常务秘书对院长及院ADR监测委员会负责,处理日常管理事务、召集ADR会议、传达国家药监或卫生行政主管部门药物安全性风险相关政策。④ADR联络员维系ADR监测机构与医务职能、临床医疗沟通和信息反馈。
2.2.3专家、咨询服务常态化①在院ADR监测委员会内设专家组,遇重大药害事件或重大严重ADR及时召开专家组会议进行分析、评价并提出处置建议;对ADR发生率高的药品进行分析、再评价后向院临床药事与药物治疗委员会建议在药品遴选中淘汰出基本用药目录。②在门诊开设药物咨询室,由资深药师坐班,每周5个工作日免费为患者进行合理用药教育和药物安全风险、ADR咨询。③公开ADR专职药师和临床药师办公座机和手机号,提供及时专业技术咨询和急会诊。
2.2.4人性化就近接受传报多处设立ADR报告接受点,使报告人在院内任何方向都可及时就近投送监测报告。目前总共在院内(门诊药房自费药窗、门诊药物咨询室、住院药房、急诊药房、肠道隔离药房、外科大楼及内科大楼底层电梯旁、ADR监测办公室)设立了8个ADR报告投递箱或接受点。
2.2.5多渠道开通ADR信息共享平台①制定了ADR监测信息通报编制要求,并每季度出版纸质和电子版院内监测信息通报。②开通局域网医务处院务公开平台和因特网医院药学平台,每季度发布ADR重要信息及监测工作小结和临床各部门监测数据汇总,以供院内外受众共享。③在《同济药学服务》杂志上开设ADR专栏,刊登原创ADR文章和监测动态。
2.2.6强化宣传培训,提高监测人员素质①以医师、护士、药师为培训对象每年组织三次以提高ADR认知度、监测分析方法、报告填写要求的专业知识宣教、培训。②编写《药品不良反应知识百问百答》手册供医、护、药人员参考。③组织编写并出版《简明医院药品使用手册》,使之成为口袋书。书内编入了各药品项下的药物相互作用、用药注意事项、ADR,为临床医师提供了最便捷和个体化的合理用药、药物安全风险宣教培训。④落实ADR监测专、兼职人员定期参加国家或市ADR中心的专业知识培训、交流,并鼓励监测人员参与科研和撰写药物警戒相关的学术论文。⑤定期召开年度监测工作总结暨先进表彰大会。
2.3 检查阶段(Check)
检查计划或措施执行结果:①2007年来连续列上海市医疗机构ADR监测呈报量前位,且每年以18%递增。近年将新的、严重的ADR病例作为重点监测项目,目前新的、严重的ADR监测量已占全部ADR相对发生率32.74%,基本达到了世界卫生组织(WHO)提出的要求。②核心期刊发表ADR相关学术论文6篇。2006年《同济药学服务》杂志复刊至今共刊登院内外ADR相关文章83篇。
2.4 处理阶段(Action)
2.4.1持续改进结论①健全监测网络、实行专人管理后,ADR上报情况较前改善。②制度强化后监测呈报流程始终通畅,漏报、不报情况明显改变。③对每季度监测到的严重的和新的ADR进行分析、评价并及时通报致严重、新的ADR名称和药物品种,起到警示用药安全风险的作用。④通过每季度ADR监测信息数据汇总、分析、评价,针对报告中不合格填表、不规范ADR名称及医学术语、批号与批准文号倒置、商品名与通用名用错、报告类型判错、用药原因与原发疾病误写、关联性评价不准确、ADR/ADE描述过于简单等都在信息通报中加以点评,并在信息共享平台上公布,且反馈到医师本人。一些较共性的问题进入下一个PDCA循环中得到有效控制,使报告质量显著提高。
2.4.2尚待持续改进的问题①手填原始报告尚有空白缺项;不良反应名称使用WHO术语较少或存在名称错误;ADR/ADE过程使用“3个时间、3个项目、2个尽可能”进行描述的不普及。②巩固原有措施(系统改进、宣教培训,特别是做好岗前培训);提高全员ADR认知度,将监测工作普及到所有用药医疗科室。
3 结果
通过系统分析2007年前ADR监测工作及报告质量现状,找出了4个方面可能存在的问题:由2种主要影响监测报告质量的原因、7种影响因素、18个工作缺陷与不足造成。经酝酿质量改善措施后拟定4方面改进行动计划:8种系统改进建议;5类宣教培训;4类制度和规范完善;3个信息平台创建。完成了20项计划或措施的执行。得到了4个方面执行力检验良好绩效(数量、质量、先进、文章)。质量改进的全过程有9个方面创新,14个创新点。ADR监测报告量连续三年列上海市第一名;新的、严重的ADR监测报告量已达到了WHO提出30%以上的要求。
4 结语
综上所述,PDCA理论在药品不良反应监测管理中的运用将极大地提高监测质量管理的系统性、完整性、严密性、协调性和创新性。在循环改进中计划是写你要做的,执行是做你写的,检查是看你所做的,处理是指导你下一步该做的[3]。使用PDCA循环的方法进行ADR监测质量控制与管理,能使我们工作思路清晰、有条不紊、简明有效、疏而不漏,同时也值得在医院药事各项工作中推广应用。
[1]高恪.持续质量改进是医院质量管理的核心[J].中国医院管理,2001,21(243):19.
[2]许玲.论持续改进与目标管理[J].现代情报,2002,8(8):2-3.
[3]郑松年,汪洪,何秀丽,等.PDCA循环在医院医疗质量管理中的应用[J].医学理论与实践,2007,20(10):1238.
