早期帕金森病大鼠血清抗氧化能力降低*
2011-05-24殷盛明于德钦董方圆孙艺平张万琴
彭 岩,殷盛明,于德钦,徐 红,董方圆,唐 锦,孙艺平,张万琴
(1.大连医科大学生理学教研室,2.大连医科大学机能实验室,3.大连医科大学2006/7级学生,辽宁 大连 116044)
帕金森病(Parkinson's Disease,PD)是一种与年龄相关的中老年慢性神经系统变性疾病。PD主要病理改变是中脑多巴胺(dopamine,DA)能神经元及黑质—纹状体通路进行性变性。PD起病缓慢,其早期发病可能长达10年之久[1]。只有当中脑DA能神经元变性死亡达50%时,病人才开始出现临床症状[2]。因此有关PD的早期发病机制及早期诊断方面的研究尤为重要。
目前,PD早期发病机制尚不清楚,而相关研究很少,主要由于临床上很难收集到未出现临床症状而又处于PD无病期和临床前期的病例,因此只能借助于早期PD动物模型。6-OHDA注射入大鼠纹状体将引起为期数周的黑质纹状体系统缓慢的逆行性退行性变,小剂量单侧纹状体内注射法可建立具有PD早期特征的动物模型[3]。
本研究采用6-OHDA大鼠早期PD模型,观察PD发病早期大鼠中脑内DA能神经元的损伤情况,进一步观察血清总抗氧化能力及血清抑制羟自由基能力。这将为PD早期发病机制及早期诊断提供线索。
1 材料与方法
1.1 PD动物模型制备和分组
选用健康雄性SD大鼠(大连医科大学动物实验中心提供),体重180~220g,实验动物随机分为两组(n=11):对照组和早期PD组。所有实验动物用4%水合氯醛(400mg/kg)腹腔注射麻醉后,固定于脑立体定位仪上,门齿杆3.4 mm。根据George Paxinos&Charles Watson大鼠脑定位图谱选取靶点,注射靶点为纹状体,坐标定位为AP=+1.0,R=3.0mm(向右旁开),H=-4.5 mm(硬膜下)。早期PD组动物脑内注射溶解于Vehicle(0.1%抗坏血酸,0.9%NaCl)的 6-OHDA,20μg/3μl。注射时间约3 min,留针3 min后慢慢退出。对照组动物在相同条件下,靶点内分别给以同等容积的Vehicle。
1.2 动物行为学检测
上述处理后两周,实验动物全部于颈背部皮下注射溶于0.4 ml生理盐水中的阿朴吗啡(apomorphine,Apo 0.5mg/kg),诱发旋转运动,记录30min的旋转次数,视7 r/min以下的左旋鼠为成功的早期PD大鼠模型。旋转运动测试后进行下述迈步实验的测试。
迈步实验:选择一个1.1 m长,倾斜放置的木板,木板的一端连通鼠笼。实验开始前3 d,先让鼠对实验环境有所适应,并设法训练大鼠慢慢爬回到笼中。实验开始后,实验者一只手固定大鼠双后肢并轻轻上提,使其离开桌面,另一只手固定一侧前肢,让未固定的一侧前肢接触桌面。待该前肢自动移动时,开始计时。记录从开始迈步到回到鼠笼所需要的总时间。同时记录走过整个斜面的步数。检测顺序为先左侧后右侧,并重复2次,共测试3 d。
1.3 血清羟自由基测定
行为实验测试结束后,实验动物进行眼球取血,血浆在测试前3500r/min离心10min,取上清待测。血清样本用生理盐水20倍稀释后取0.2 ml作检测。按照南京建成生物公司试剂盒说明,用Fenton反应和griess试剂显色法测定抑制血清羟自由基能力。
1.4 总抗氧化能力测定
取样品方法同上,按照南京建成生物公司试剂盒说明,用菲啉类物质显色法测定血清总抗氧化能力。
1.5 免疫组织化学染色
取血后的实验动物用4%甲醛固定,取脑组织经4%甲醛固定,蔗糖脱水后进行冰冻切片,再行ABC法免疫组织化学染色。选取中脑黑质脑片,经PBS振荡漂洗10min×3,用含1%过氧化氢的PBS处理10min以消除内源性过氧化物酶。PBS振荡漂洗10min×3后用含1%牛血清蛋白的PBS封阻20min。加入抗TH抗体。4℃孵育过夜;PBS漂洗10min×3;生物素化的二抗室温孵育1.5 h;漂洗后与卵白素-生物素复合物A∶B∶PBS(1∶1∶200)室温振荡孵育1 h,充分漂洗后用新鲜配制的0.05%的二氨基联苯胺(DAB)-PBS缓冲液加0.02%过氧化氢显色,适时终止反应。脑片进行贴片、晾干、二甲苯透明和中性树脂封片。
1.6 免疫染色阳性细胞的计数
用病理图文分析系统对TH-IR阳性细胞进行定量计数。选取各组大鼠 6只。脑片的选取部位根据George Paxinos&Charles Watson大鼠脑图谱,先在10倍的物镜下观察脑片,选取黑质致密部(SNR),在荧光屏上设定测量框的面积为20000μm2(100μm×200μm),选取四个部位计数,取其平均值。计算测量框内TH-IR阳性细胞的个数。并随机选6个TH-IR阳性细胞,测其胞浆平均灰度。
2 结果
2.1 行为学结果
在迈步实验中,与对照组相比,早期PD动物在左前肢从开始迈步至返回鼠笼所需要的总时间和所迈的步数没有明显差异(表1,表2)。
Tab.1 Total time since the rat walked back to the cage by using the left forelimb(,n=11)
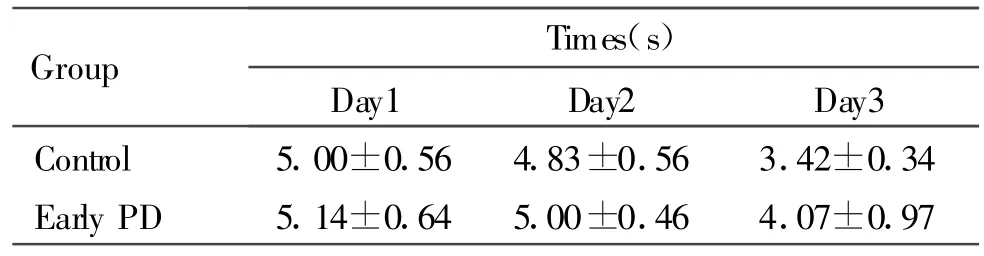
Tab.1 Total time since the rat walked back to the cage by using the left forelimb(,n=11)
Group Times(s)Day1 Day2 Day3 Control 5.00±0.56 4.83±0.56 3.42±0.34 Early PD 5.14±0.64 5.00±0.46 4.07±0.97
Tab.2 Total number of steps since the rat walked back to the cage by using the left forelimb(,n=11)

Tab.2 Total number of steps since the rat walked back to the cage by using the left forelimb(,n=11)
Group Number of steps Day1 Day2 Day3 Control 9.17±0.90 9.75±0.75 8.92±0.67 Early PD 9.14±0.52 9.29±0.36 8.07±0.73
2.2 TH免疫组化结果
与对照组给药侧相比,早期PD大鼠黑质给药侧TH-IR阳性DA能神经元的数量明显减少,光密度明显降低,免疫反应活性明显减弱(图1D,表3,4)。

Fig.1 The results of the TH-IR positive dopaminergic neurons(DAB staining,bar=100μm)
Tab.3 Number of the TH-IR positive dopaminergic neurons in the substantial nigra counting area is 20000μm2(100μm ×200μm)(,n=11)

Tab.3 Number of the TH-IR positive dopaminergic neurons in the substantial nigra counting area is 20000μm2(100μm ×200μm)(,n=11)
**P<0.01 vs control in the treated side
Group Number of neurons Untreated side Treated side Control 8.50±1.38 8.33±1.21 Early PD 5.17±1.33 4.00±1.55**
Tab.4 Optical density of the TH-IR positive dopaminergic neurons in the substantial nigra(,n=11)

Tab.4 Optical density of the TH-IR positive dopaminergic neurons in the substantial nigra(,n=11)
**P<0.01 vs control in the treated side
Group Optical density Untreated side Treated side Control 0.81±0.01 0.81±0.02 Early PD 0.83±0.01 0.69±0.02**
2.3 血清抗氧化能力
与对照组相比,早期PD大鼠血清的抑制羟自由基能力及总抗氧化能力明显降低(表5,6)。
Tab.5 Inhibition ability of hydroxyl free radical in the serum(,n=11)

Tab.5 Inhibition ability of hydroxyl free radical in the serum(,n=11)
**P<0.01 vs control
Group Inhibition ability(U/ml)Control 672.85±9.61 Early PD 616.65±32.91**
Tab.6 Total antioxidation ability in the serum(,n=11)

Tab.6 Total antioxidation ability in the serum(,n=11)
**P<0.01 vs control
Group Total antioxidation ability(U/ml)Control 9.15±0.61 Early PD 6.18±0.55**
3 讨论
PD是中老年人常见的慢性神经系统退行性疾病,随着人口的老龄化,以及环境及食品等可能的相关因素的影响,近20年中国PD发病率至少增长了20多倍。PD起病缓慢,临床前期时间长。[3]。PD早期由于缺乏特征性的临床症状,难以诊断;而临床期PD虽诊断明确,从治疗的角度出发,已为时过晚。因此,对PD早期发病机制及早期诊断的研究具有十分重要的社会意义。
PD的病因和发病至今不清,很可能是多种因素长期作用的结果,包括基因突变、接触环境毒物(如鱼藤酮、MPTP、6-OHDA等)、脑内炎症反应和免疫功能失调等,它们都可能使DA能神经元对氧化应激和能量缺乏更加敏感。虽然PD是以脑内DA能神经元变性为主要病理特征,但近年来研究发现PD的外周组织细胞也检测出异常改变。Parker等1989年首例报道PD病血小板中存在线粒体复合物1活性明显降低,还有研究发现PD患者骨骼肌、淋巴细胞、成纤维细胞中酶复合物Ⅰ活性下降,提示PD患者的线粒体功能异常可能是全身性的[4]。这为早期诊断PD提供了思路,线粒体功能与机体的抗氧化能力密切相关[5],但有关血清总抗氧化能力及血清抑制羟自由基的能力在PD早期是否有异常改变,尚未见报道。
本研究采用小剂量单侧纹状体内注射法建立早期PD动物模型,经动物行为学迈步实验及旋转行为检测与对照组无明显改变,证实为可靠的早期PD动物模型。本研究发现在6-OHDA给药侧,与对照组相比,PD早期动物中脑黑质DA能神经元免疫反应活性降低,进一步发现PD早期动物的血清总抗氧化能力及血清抑制羟自由基的能力降低。因此推测血清抗氧化能力的降低可能是PD早期病变的标志,这些异常改变可能与早期PD大鼠中脑DA能神经元损伤机制有关。这对PD发病机制及早期诊断的研究提供重要的理论依据和线索。
[1]陈生弟.老年帕金森病的病因及发病机制[J].实用老年医学,2001,15(6):284-287.
[2]Felicio A C,Shih M C,Godeiro-Junior C,et al.Molecular imaging studies in Parkinson disease:reducing diagnostic uncertainty[J].Neurologist,2009,15(1):6-16.
[3]Brooks D J.The early diagnosis of Parkinson's disease[J].Ann Neurol,1998,44(3):S10-18.
[4]Cardellach F ,Martin M J,Fernández-Solá J,et al.Mitochondrial respiratory chain activity in skeletal muscle from patientswith Parkinson's disease[J].Neurol,1993,43(11):2258-2262.
[5]王琳琳,凌文华.线粒体DNA氧化损伤机制的探讨[J].疾病控制杂志,2000,4(1):79-83.
