豚鼠冠状动脉微动脉细胞静息膜电位的分布特性及机制*
2011-05-24李新芝张治平司军强张忠双石文艳马克涛
李新芝,张治平,司军强,张忠双,李 静,石文艳,马克涛△
(1.石河子大学医学院新疆地方与民族高发病省部共建重点实验室-电生理研究室,2.第一附属医院耳鼻喉科,石河子 832002)
血管微动脉病变主要导致血管的舒缩功能障碍,而微动脉细胞静息膜电位(resting membrane potential,RP)在血管舒缩调节中发挥重要的作用。研究发现,管腔压力为零的离体微动脉细胞RP在-60~-75 mV之间[1]。管腔压力为60mmHg或在体[2]情况下微动脉细胞RP为-40mV。不同部位微动脉间的差异较大,有报道称远端大脑微动脉的静息膜电位要远高于近端大脑微动脉[3]。此外我们前期在离体豚鼠耳蜗螺旋动脉上发现细胞RP呈独特的双峰分布,52%细胞RP平均在-74 mV,48%细胞RP平均在-41 mV,高K+和神经递质ACh在高、低RP细胞上的反应形式和离子机制都截然不同[4,5]。本研究是以急性分离的豚鼠冠状动脉微动脉(coronary arteriole,CA)为研究对象,应用细胞内微电极技术记录微动脉细胞RP,分析维持RP的离子机制,为我们更好的了解CA细胞的电生理特性提供实验和理论依据。
1 材料与方法
1.1 实验动物及标本制备
实验所用豚鼠雌雄不拘(新疆自治区疾病控制中心动物饲养科提供,动物质量符合一级标准),重约250~500g。肌注的混合麻醉药物是氯胺酮500mg、甲苯噻嗪20mg和乙酰丙嗪10mg溶于8.5 ml蒸馏水中,配制成混合麻醉药物,按1 ml/kg臀部肌肉注射,动物在麻醉状态下放血处死,迅速取出心脏,并置于含有95%O2和5%CO2的 37℃饱和生理盐溶液(Krebs)中。Krebs液成分是(mmol/L):NaCl 125 ,KCl 5 ,CaCl21.6 ,MgCl21.2 ,NaH2PO41.2 ,NaHCO320,葡萄糖 8.3,将pH 调至 7.4。在Krebs液中,迅速取出冠状动脉相连的辐射状微小动脉,置于Krebs液中孵育30min后进行实验。
1.2 细胞内微电极记录
孵育后的标本转移到记录用实验灌流槽中,血管段长约2~5 mm,直径约为40~80μm。在显微镜下清除与CA相连的结缔组织,再用很细小的钢针将CA固定在灌流槽底部的硅胶上。连续用37℃的生理盐溶液灌流30min之后可持续进行电生理实验6~8 h。微电极内充灌2 mol/L KCl,阻抗为 60~150MΩ。细胞内穿刺是通过微操纵推进器推动玻璃微电极刺向血管外表面进行盲插,同时通过NPI前置放大器监测跨膜电位和注射电流,生物电信号通过PC计算机记录。采样间隔为0.1、0.5或10ms。成功刺入细胞稳定5 min后并参照退出电极后的电位水平为细胞RP大小。
1.3 实验所用药物
所用药物用Krebs液配制,通过开关控制药物灌流标本,保持灌流速度、温度和其它成分不变。所用药物ACh由Sigma Research Biochemicals Inc.提供。
1.4 统计方法
采用SPSS 16.0统计软件进行分析,实验结果以均数±标准差()表示,显著性采用 t检验。
2 结果
2.1 CA细胞RP独特的双峰分布
实验中共成功记录了112个细胞,RP范围为-88~-26 mV,细胞平均RP为(-65±4.2)mV。应用高斯函数拟合后细胞RP呈双峰分布,两个峰值分别为-43 mV和-74 mV,分别称为高和低RP(图1)。实验中我们观察了10mmol/L K+和3μmol/L ACh对高、低RP细胞的作用。在低RP细胞,高K+和ACh引起去极化反应(图 2A),10mmol/L K+和 3μmol/L ACh引起的去极化幅度分别为(9.6±1.2)mV(n=23)和(8.7±0.69)mV(n=15)。在高 RP细胞,高K+和ACh引起超极化反应(图2B),10mmol/L K+和3μmol/L ACh引起的超极化幅度分别为(-7.4±0.87)mV(n=13)和(-15±1.2)mV(n=16)。

Fig.1 Two-peak distribution of CA cell RP
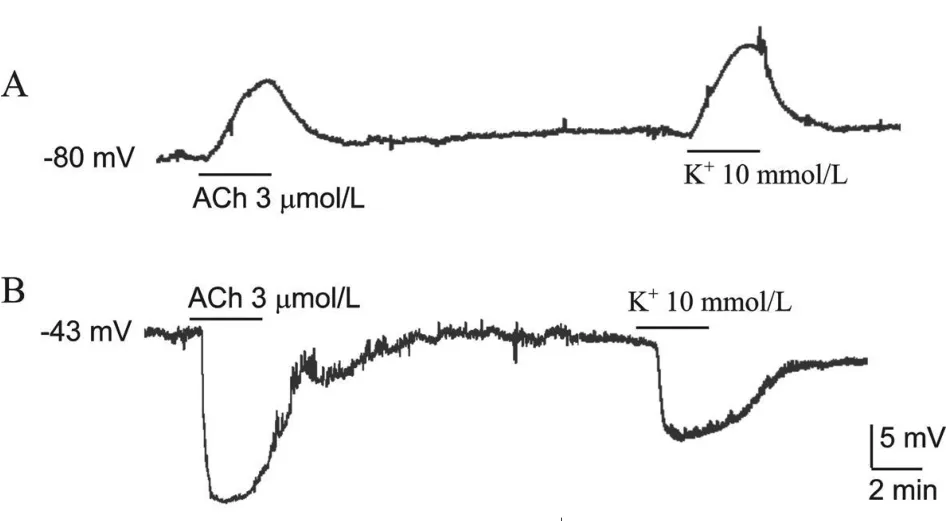
Fig.2 Responses induced by high K+and ACh in high and low RP cells
2.2 Kir介导CA细胞RP的双峰分布
实验中预灌流Kir阻断剂Ba2+,结果发现Ba2+可以浓度依赖的去极化低RP细胞(图 3A),1、3、10、30、100、300、1000、3000μmol/L 的 Ba2+引起 CA 细胞去极化幅度分别为(0.45±0.27)mV(n=4)、(0.48±0.24)mV(n=4)、(3.6±0.82)mV(n=7)、(6.7±0.96)mV(n=10)、(16±1.5)mV(n=11)、(37±3.7)mV(n=11)、(36±3.2)mV(n=7)、(45±2.4)mV(n=7),EC50是 120μmol/L(图 3B)。应用 ≥100μmol/L Ba2+后低RP细胞去极化到高RP水平,ACh介导反应的形式也发生相应改变,图4显示CA细胞初始为低 RP水平,3μmol/L ACh引起去极化反应 ,持续灌流 100μmol/L Ba2+阻断 Kir后 ,细胞去极化到高RP水平,此时3μmol/L ACh引起超级化反应。

Fig.3 Effect of Ba2+on RP of CA cells

Fig.4 Kirmediated conversion between high and low RP of CA
3 讨论
微动脉是小动脉的末梢分支,直径在5~100μm之间,和小动脉共同决定了血管的外周阻力。目前已知微动脉上表达的主要功能性K+通道包括钙激活的 K+通道(Ca2+-activated K+channels,KCa)、ATP敏感的 K+通道(ATP-sensitive K+channels,KATP)、Kir和电压依赖K+通道(voltage-gated K+channels,KV)[6]。其中Kir是维持微动脉细胞RP的重要通道[7]。Kir通道主要表达在小直径的微动脉上。目前认为Kir通道主要参与维持微动脉细胞RP和血管紧张度调节[7]。Kir也被认为是微动脉自身调节的关键跨膜蛋白[3],在脑动脉、肾脏动脉、提睾肌和冠状动脉基础舒缩运动中,Kir通道发挥重要作用[8]。前期研究发现在离体豚鼠耳蜗螺旋动脉上血管细胞RP独特的双峰分布由Kir通道的激活或失活介导[4,5],本实验所得结果与之一致。
ACh不仅是神经递质,同时也是一种有效的血管舒张物质,参与许多血管床的调节活动。研究发现,在微动脉上ACh可引起双向反应[5],既引起细胞超极化反应也可以引起去极化反应。当内皮细胞功能完整时,ACh引起血管平滑肌细胞超极化并舒张血管,剥除内皮细胞层后,ACh引起血管平滑肌细胞去极化反应并收缩血管[9]。目前普遍认为ACh引起细胞超极化反应和舒张血管是由内皮超极化因子或内皮舒张因子介导。在豚鼠耳蜗螺旋动脉上我们证实ACh通过激活内皮细胞膜上的KCa通道,致使K+外流,引起内皮细胞超极化反应[11]。对于血管平滑肌细胞来说,ACh引起超极化反应幅度的60%是由内皮细胞经内皮细胞与平滑肌细胞之间的缝隙连接通道传来,剩余的40%则是内皮细胞释放到细胞外的K+,导致[K+]o浓度升高,激活血管平滑肌细胞上的Kir和Na+-K+泵引起。另一方面,直到现在ACh引起去极化和收缩血管的机制仍不清楚。在豚鼠耳蜗螺旋动脉上我们证实ACh通过激活非选择性的阳离子通道和失活Kir通道引起细胞去极化反应[10]。本实验中也发现在CA细胞上ACh引起双向反应,既在高RP细胞上引起超极化反应,而在低RP细胞上引起去极化反应。在后期的工作中ACh在CA上引起去极化和超极化的离子机制将是我们重点研究内容。
[1]Faraci F M,Sobey C G.Role of potassium channelsin regulation of cerebral vascular tone[J].J Cereb Blood Flow Metab,1998,18(10):1047-1063.
[2]Welsh D G,Segal S S.Endothelial and smooth muscle cell conduction in arterioles controlling blood flow[J].Am J Physiol,1998,274(1 Pt 2):178-186.
[3]Edwards F R,Hirst G D,Silverberg G D.Inward rectification in rat cerebral arterioles;involvement of potassium ions in autoregulation[J].J Physiol,1988,404:455-466.
[4]Jiang Z G,Qiu J,Ren T,et al.Membrane properties and the excitatory junction potentials in smooth muscle cells of cochlear spiral modiolar artery in guinea pigs[J].Hear Res,1999,138(1-2):171-180.
[5]Jiang Z G,Si JQ,LasarevM R,et al.Two resting potential levels regulated by the inward-rectifier potassium channel in the guinea-pig spiral modiolar artery[J].J Physiol,2001,537(3):829-842.
[6]Ko E A,Han J,Jung I D,et al.Physiological roles of K+channels in vascular smooth muscle cells[J].J Smooth Muscle Res,2008,44(2):65-81.
[7]Park W S,Son Y K,Kim N,et al.Acute hypoxia induces vasodilation and increases coronary blood flow by activating inward rectifier K(+)channels[J].Pflugers Arch,2007,454(6):1023-1030.
[8]Chrissobolis S,Sobey C G.Inwardly rectifying potassium channels in the regulation of vascular tone[J].Curr Drug Targets,2003,4(4):281-289.
[9]Jiang Z G,Shi X R,Guan B C,et al.Dihydropyridines in-hibitacetylcholine-induced hyperpolarization in cochlear artery via blockade of intermediate-conductance calcium-activated potassium channels[J].J Pharmacol Exp Ther,2007,320(2):544-551.
[10]Ma K T,Guan B C,Yang Y Q,et al.ACh-induced depolarization in inner ear artery is generated by activation of a TRP-like non-selective cation conductance and inactivation of a potassium conductance[J].Hear Res,2008,239(1-2):20-33.
