雷公藤多苷对大鼠卵泡发育及其旁分泌调控机制的影响Δ
2011-05-22杨涓高慧韩冰董江川重庆医科大学附属第一医院重庆市400016承德医学院附属医院承德市067000天津中医药大学第二附属医院天津市00150重庆医科大学中医药学院重庆市4011
杨涓,高慧,韩冰,董江川(1.重庆医科大学附属第一医院,重庆市 400016;.承德医学院附属医院,承德市 067000;.天津中医药大学第二附属医院,天津市 00150;4.重庆医科大学中医药学院,重庆市 4011)
雷公藤多苷(GTW)是临床应用最广泛的雷公藤制剂,具有免疫调节、抗炎、抗肿瘤等药理作用。部分自身免疫性疾病女性患者服药后发生月经紊乱和闭经,故成为卵巢早衰的医源性因素之一[1]。既往研究表明,GTW对生殖功能具有抑制作用,表现为月经周期延长、闭经、血浆雌二醇(E2)水平下降,卵泡雌激素(FSH)升高,故认为其作用靶点在卵巢[2],而对其生殖毒理的研究则以细胞凋亡为主要研究方向[3],未见雷公藤对卵泡发育调控因子影响的研究报道。本课题组通过对大鼠卵巢结构观察及各级卵泡计数比较研究GTW对各发育阶段卵泡的影响,并通过对旁分泌调控因子卵泡刺激素特异受体(FSHR)、表皮生长因子(EGF)和缝隙连接蛋白 43(Cx43)mRNA的表达观察GTW对卵泡发育调控机制的影响,探讨其生殖毒理机制。
1 仪器与材料
1.1 仪器
PMr10AD型倒置相差显微镜(日本Olympus公司);JEM-1010型透射电镜仪(日本电子公司);SYD-K2030型冷冻病理切片机(沈阳誉德电子仪器有限公司);荧光定量聚合酶链式反应(PCR)仪(瑞士罗氏公司);722型紫外分光光度计(上海天普分析仪器有限公司)。
1.2 试药
GTW片(湖南协力药业有限公司,批号:20050402);Trizol RNA提取试剂(美国Invitrogen公司,批号:15596026);LightCycle SYBR Green I RNA一步法扩增试剂盒和LightCycle质控盒(德国Roche公司);基因引物由宝生物(大连)有限公司合成。
1.3 动物
SPF级SD大鼠,12周龄,♀,体重(260±10)g,由北京大学医学部实验动物部提供(动物生产许可证号:SCXK(京)2002-0001)。每日行阴道脱落细胞涂片,凡间隔4~5 d出现2次动情期者纳入实验。
2 方法
2.1 分组和给药
将大鼠随机分为正常(等容蒸馏水)和GTWⅠ、Ⅱ、Ⅲ、Ⅳ、Ⅴ(5、10、20、50、75 mg·kg-1)组。除正常组外,其余各组ig相应GTW片水溶液,每天1次,连续28 d,第29天处死大鼠。
2.2 组织学观察
切取的卵巢组织用4%多聚甲醛固定,常规脱水、石蜡包埋、连续5µm切片后苏木精-伊红(HE)染色、封片,取最大剖面切片光镜下观察,并计数具有正常结构的各级卵泡数、卵泡总数及黄体数。卵泡分级方法参考文献[4,5]:小卵泡直径<30µm,中卵泡直径30~600µm,大卵泡直径>600µm;电镜组织经固定、冲洗、脱水、包埋、半薄切片定位后制成超薄切片,醋酸铀、柠檬酸铅双染色,透射电镜仪观察卵巢超微结构。
2.3 组织总RNA提取
总RNA提取:参照Trizol RNA抽提试剂盒说明书进行抽提。将卵巢组织加入液氮研磨后,加入1.5 mL trizol匀浆,加入氯仿振荡离心,取上层水相加入异丙醇静置离心,取沉淀加75%乙醇,振荡离心,倒掉乙醇吹干,加无RNA酶水振荡、离心、水浴再离心。完整性检测:取总RNA稀释液与Lodding buffer混合加入凝胶孔中电泳,紫外透射电镜仪上于254 nm波长处紫外光观察,完整的真核细胞核糖体RNA可见28、18、5 S 3条电泳带。纯度、浓度检测:取3 μL RNA样品稀释10倍,于紫外分光光度计探头上测定280/260(核酸/蛋白)、280/230(核酸/有机相)及浓度(ng·µL-1)数值。
2.4 Real-time PCR检测
FSHR、EGF和Cx43的基因引物序列见表1。

表1 FSHR、EGF和Cx43的基因引物序列Tab 1 The gene primer sequence of FSHR,EGF and Cx43
2.4.1 反应系统 (总量20µL)Mix SYBR GreenⅠ(4µL),Resolution Solution(2 µL),MgCl2stock solution(2.4 µL),Enzyme mix(0.4 µL),Primer(上下游)(各1 µL),Total RNA(阴性对照用水)(800 ng),H2O(PCR-grade)(可变化)。反应条件:55℃ 30 min,合成cDNA;95℃ 30 s孵育,56.1℃退火10 s,72℃延伸15 s,循环40次;60℃建立融解曲线。
2.4.2 目的基因检测 用建立的实时荧光PCR反应条件检测目的基因的循环阈(Ct)值,依照标准曲线计算起始模板拷贝数。定量PCR仪扩增完成后自动生成荧光强度曲线,该荧光强度曲线反映所有标本不同循环时的荧光强度,阳性标本呈现典型的S型曲线,阴性对照即使扩增50个循环也为不规则的波浪线。
2.5 统计学方法
数据采用SPSS 11.5统计软件进行分析处理。所有计量资料均以表示,两样本比较采用成组t检验。P<0.05表示有统计学意义。
3 结果
3.1 组织形态学观察
光镜下观察,正常组卵巢内可见原始卵泡、生长卵泡、成熟卵泡等各级卵泡,卵泡排列紧密,未见明显的闭锁卵泡,黄体数目较多,血管丰富;GTWⅠ组与正常组相当;GTWⅡ组卵巢轻度间质纤维化改变,血管减少,小卵泡明显减少;GTWⅢ、Ⅳ、Ⅴ组卵巢间质纤维化改变明显,血管明显减少,各级卵泡及黄体明显减少。HE染色结果见图1。
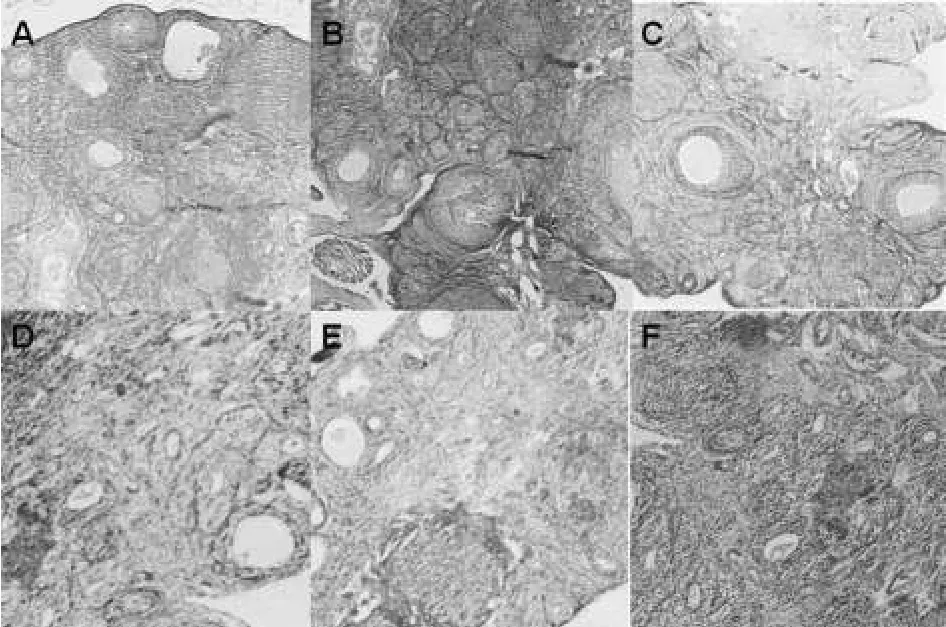
图1 HE染色结果(HE×40)A.正常组;B.GTWⅠ组;C.GTWⅡ组;D.GTWⅢ组;E.GTWⅣ组;F.GTWⅤ组Fig 1 Results of HE staining(HE×40)A.normal group;B.GTWⅠ group;C.GTWⅡgroup;D.GTWⅢgroup;E.GTWⅣgroup;F.GTWⅤgroup
电镜下观察,正常组卵巢内卵泡排列紧密有序,卵泡膜清晰,胞质内可见丰富的线粒体及游离核糖体,细胞核圆形,有明显的核仁,染色质均匀;GTWⅠ组卵泡排列有序,卵泡膜清晰,颗粒细胞层丰富,结构清晰,胞质内细胞器丰富,细胞核较大,核仁明显,核染色质欠均匀;GTWⅡ、Ⅲ组细胞排列尚有序,细胞间隙稍增宽,胞质较丰富,细胞器轻度变性,线粒体空泡变较明显,核膜间隙增宽,核染色质欠均匀;GTWⅣ、Ⅴ组超微结构明显受损,卵泡细胞层次紊乱,大小不一,细胞间见明显间隙,胞质内细胞器减少且结构不清,部分细胞核呈斑块状凝集,细胞核异染色质凝集趋边,核膜不清。电镜下观察结果见图2。
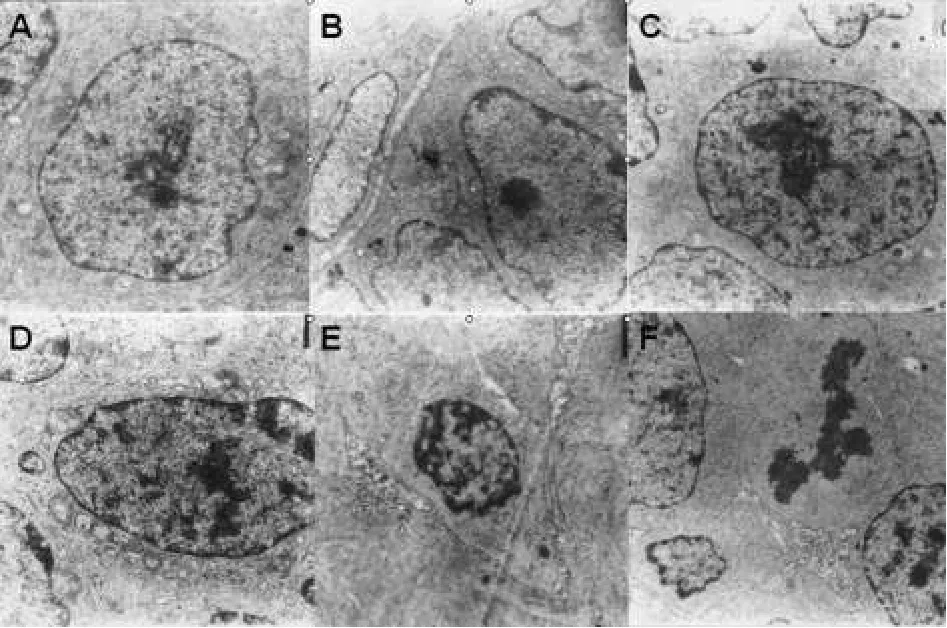
图2 电镜下观察结果(TEM×6000)A.正常组;B.GTWⅠ组;C.GTWⅡ组;D.GTWⅢ组;E.GTWⅣ组;F.GTWⅤ组Fig 2 Observation results under electric microscope(TEM×6000)A.normal group;B.GTWⅠ group;C.GTWⅡgroup;D.GTWⅢgroup;E.GTWⅣgroup;F.GTWⅤgroup
3.2 各级卵泡、黄体计数比较
GTW各组小卵泡较正常组均显著减少,且小泡数量与用药剂量呈负相关;GTWⅠ、Ⅱ组大卵泡较正常组无明显减少,而GTWⅢ、Ⅳ、Ⅴ组均显著减少(P<0.01或P<0.05),且大泡数量与用药剂量呈负相关;除GTWⅠ组外,其他各组黄体均显著减少(P<0.01或P<0.05),且黄体数量与用药剂量呈负相关。大鼠各级卵泡和黄体计数的比较见表2。
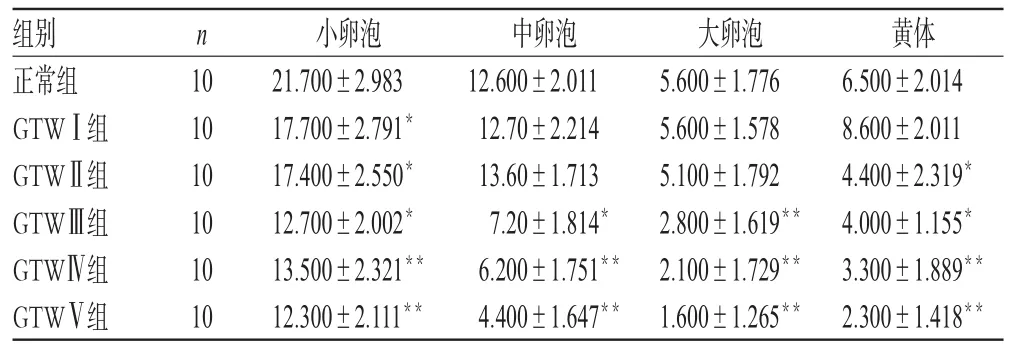
表2 大鼠各级卵泡和黄体计数的比较Tab 2 The amounts of different levels follicles and corpus luteum in ovary
3.3 卵巢组织FSHR、EGF及Cx43 mRNA表达水平比较
GTW各组FSHR mRNA表达较正常组均无显著性差异;GTWⅠ、Ⅱ组EGF mRNA表达较正常组无显著性差异,其他各组均显著降低(P<0.01或P<0.05),且表达强度与用药剂量呈负相关;除GTWⅠ组外,其余各组Cx43 mRNA表达均显著降低(P<0.01或P<0.05),且表达强度与用药剂量呈负相关。卵巢组织FSHR、EGF及Cx43 mRNA表达的比较见表3。
4 讨论
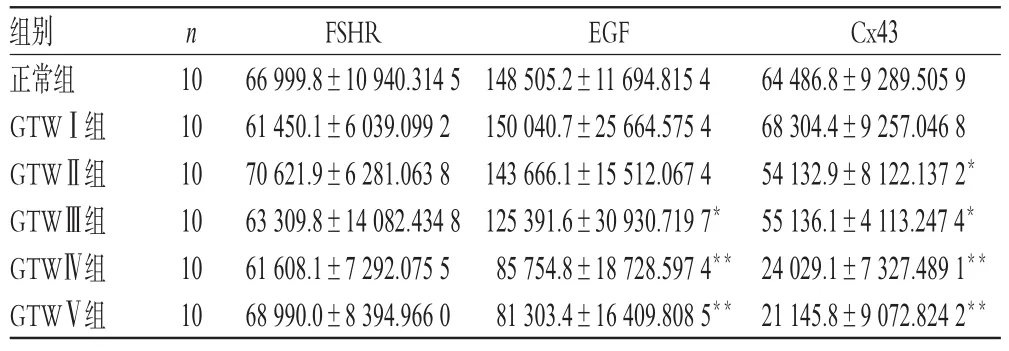
表3 卵巢组织FSHR、EGF及Cx43 mRNA表达的比较Tab 3 The mRNA expression level of FSHR,EGF and Cx43 in ovary
既往研究表明,GTW导致生殖抑制的靶点在卵巢[1]。卵泡是卵巢功能的物质基础,卵泡数量及结构的改变对卵巢功能影响较大。原始卵泡数提示卵巢储备能力,窦状卵泡数则是对卵巢低反应性者的单一预测指标[6]。卵泡发育受卵巢血流影响,始基卵泡没有单独的血供,由基质血管传递营养物质和激素,故卵巢血流与卵巢反应密切相关[4]。因此,本研究采用卵巢组织病理学观察结合卵泡计数比较的方法评价GTW对卵泡发育的影响。结果表明,GTW导致卵巢血管减少,组织发生纤维化改变,卵泡颗粒细胞层减少,透明带模糊不清,提示GTW可导致卵母细胞发育环境受到损害;进一步观察显示卵泡细胞器减少且变性,组织呈明显的凝集性损害,提示卵母细胞本身亦受到了GTW的影响。对各级卵泡的计数比较显示,各剂量组小卵泡均明显减少,提示即使低剂量GTW亦可能对卵巢储备造成影响,而随用药剂量增大,则中、大卵泡数和黄体数明显减少,提示卵泡的发育与GTW用药剂量呈负相关。
FSH是刺激卵泡发育最重要的激素[7],可促使窦前卵泡及窦状卵泡的颗粒细胞(GC)增殖与分化,缝隙连接形成、分泌卵泡液,使卵泡生长发育[8]。但FSH的生理功能需通过分布于性腺的特异性受体FSHR介导,因此FSHR的表达量直接影响卵巢对FSH反应性。卵母细胞不存在FSHR,FSH对其发育的调节必须通过旁分泌途径实现,EGF和Cx43是重要的中间环节,三者共同调节卵泡的发育。EGF可对FSH的促卵母细胞成熟作用有促进效应,而FSH能显著增加颗粒细胞中EGF的结合点,因此认为FSH对卵泡生长的调节是通过EGF及其受体来实现的[9]。卵泡处于无血管的微环境中,缝隙连接介导卵母细胞和其周围体细胞(颗粒细胞和卵泡膜细胞)间的代谢交换,传递内分泌和旁分泌的生长因子,GC通过缝隙连接持续低水平发送cAMP信号至卵母细胞,使卵母细胞滞留在减数分裂阶段,并通过LH诱导信号途径(也是一种缝隙连接)使卵母细胞最终成熟。因此,缝隙连接对于卵泡的发育以及甾类激素的分泌具有十分重要的意义。Cx43蛋白是卵巢组织表达最多的连接蛋白[10,11]。本研究表明,各GTW组FSHR mRNA表达较正常组均无显著性差异,而EGF及Cx43 mRNA表达较正常组显著下降,其表达量与药物剂量呈负相关,提示GTW并非通过降低卵巢对FSH反应性来影响卵泡发育,而是通过降低EGFmRNA表达影响FSH的旁分泌途径,并通过降低CX43mRNA表达影响卵母细胞和其周围体细胞间的代谢交换和内分泌、旁分泌生长因子的传递,从而影响卵泡的发育。
[1]杨 涓,董江川,韩 冰.雷公藤多苷对女性生殖内分泌系统的影响[J].中国药理学与毒理学杂志,2006,20(5):437.
[2]谷春霞,陶学濂,葛秦生,等.雷公藤多苷片所致闭经原因的探讨[J].中国医学科学院学报,1989,11(2):151.
[3]姜姣姣,郝 丽,王瑞峰,等.雷公藤多苷及雌孕激素治疗对大鼠卵巢Bcl-2和Bax表达的实验研究[J].成都医学院学报,2009,4(3):177.
[4]马晓玲,高云荷,郭红宇,等.促性腺激素释放激素类似物预防化疗对大鼠卵巢损伤作用的研究[J].生殖与避孕,2005,25(3):137.
[5]Ataya KM,McKanna JA,WeintraubAM,et al.A luteinizing hormone-releasing hormone agonist for the prevention of chemotherapy-induced ovarian follicular loss in rats[J].Cancer Res,1985,45(8):3651.
[6]Popovic Todorovic B,Loft A,Lindhard A.A prospective IVF/ICSI patients treated with ecombinant FSH.A suggestion for a recombinant FSH dosage normogram[J].Hum Repord,2003,18(4):781.
[7]Strauss JF,Steinkampf MP.Pituitary-ovarian interactions during follicular maturation and ovulation[J].Am J Obster Gynecol,1995,172(2):726.
[8]曹泽毅主编.中华妇产科学[M].第2版.北京:人民卫生出版社,2004:44.
[9]Hattori MA,Shinohara Y,Yoshino E,et al.Human growth hormone augmentation ofepidermalgrowth factor binding sites on rat granulosa cells[J].J Endocrinol,1994,142(1):69.
[11]Cecconi S,Ciccarelli C,Barberi M,et al.Granulosa celloocyte interactions[J].Eur J Obstet Gynecol Reprod Biol,2004,115(S1):19.
