非洲猪瘟研究进展
2011-05-18王志亮
王志亮
(中国动物卫生与流行病学中心,山东 青岛 266034)
非洲猪瘟(ASF)是由病毒(ASFV)引起的家猪和野猪的一种高度接触性传染病,所有品种和年龄的猪均易感。家猪感染后出现发热、高病毒血症和出血性病变等典型特征,发病率高,但死亡率因感染毒株和猪品种的不同而有所差异,从5%到100%不等。通常将临床表现分为最急性、急性、亚急性和慢性四种类型,最急性和急性型病死率高,解剖病变与古典猪瘟类似,(但病程更短,盲肠结肠见不到溃疡,脾脏见不到梗死)。不同种类的野猪感染后临床表现差异很大,其中欧亚野猪、美洲野猪的临床表现与家猪类似,而非洲的疣猪、丛林野猪等多呈阴性感染,北美的花斑野猪对本病具有抵抗力。目前,ASF诊断和检测技术非常成熟,但疫苗研究却一直未能成功,因此历史上所有消灭非洲猪瘟的国家,都是通过及时准确的诊断检测和严格有效的封锁扑杀等措施取得成功的。
1 流行病学
发病猪的血液和分泌物中含有大量病毒,钝缘蜱属的软蜱可以感染、繁殖并传播病毒,因而带毒家猪、野猪和钝缘蜱都是该病的宿主和传染源。研究表明,钝缘蜱属的软蜱,尤其是O.moubata、O.erraticus等钝缘蜱,其寿命可长达20年之久,不仅可长期携带病毒,也可通过交配和卵传递病毒。ASFV主要通过消化道和钝缘蜱叮咬感染,但在同一猪群内也可通过呼吸道感染。ASFV可通过不同的方式进行传播:远离非洲且历史上无疫情的国家多通过含ASFV的猪肉制品或运输工具废弃的残羹传入;接壤的国家还可以通过带毒野猪的迁移传入;此外有软蜱存在的国家,病毒还能通过软蜱与野猪(尤其是疣猪)之间的循环得以长期维持,并伺机传染给家猪。一般情况下,直接接触感染的潜伏期为5~15 d,而软蜱叮咬感染的潜伏期在5 d之内。
2 历史分布
迄今,全球共有49个国家曾经发生或仍有ASF流行,特别是近年来高加索地区疫情严峻,对我国构成极大威胁。ASF疫情最早于20世纪初发现于肯尼亚,1921年,蒙哥马利对欧洲家猪引入肯尼亚后的疫情发生情况进行了详细描述,随后许多非洲国家均有报道,而且至今仍在撒哈拉以南地区流行。1957年,ASF首次在非洲大陆以外的地区出现,葡萄牙里斯本机场附近的猪场因饲喂了来自安哥拉航班的泔水而暴发疫情,随后西班牙(1960)、法国(1964)、意大利(1967)、前苏联(1977)、马耳他(1978)、比利时(1985)、荷兰(1986)等欧洲国家均有发生,虽然多数国家很快扑灭了疫情,但葡萄牙和西班牙的疫情却长期存在,直到1994和1995年才真正消灭。意大利的撒丁岛由于存在野猪感染和康复带毒猪,从1978年首次传入以来,疫情一直存在。美洲部分国家,如古巴(1971、1980)、巴西(1978)、多米尼加(1978)和海地(1979)等都曾发生过ASF疫情,但相继扑灭。2007年,欧洲大陆出现第二次流行,疫情首先在格鲁吉亚Poti港附近的农场出现,随后迅速传至亚美尼亚、阿塞拜疆和俄罗斯联邦等周边国家。此次疫情的发生,可能与饲喂了国际货轮上被ASFV污染了的肉品垃圾有关,目前仍呈扩大蔓延趋势,已造成巨大损失。
3 病原研究
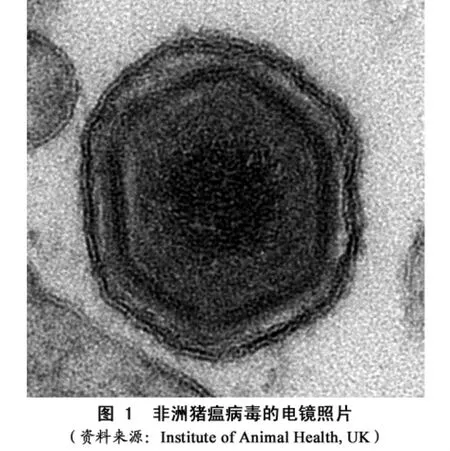
ASFV是非洲猪瘟病毒科非洲猪瘟病毒属中的唯一成员。在形态上类似虹彩病毒,在基因组结构复制方式上类似痘病毒,实际并不相同。完整的病毒颗粒直径约200nm,具有复杂的多层结构,外被囊膜,内有核衣壳,20面体对称,六边形外观。病毒中部为高电子密度核心,直径约80nm,由病毒基因组以及完成早期转录所必需的酶(如DNA依赖性RNA聚合酶、mRNA加帽酶、多腺苷酸聚合酶等)和一些DNA结合蛋白组成(如P14.5、P10等);核心外围是核心衣壳,由 P150、P37、P34、P14 等蛋白组成;其外侧是源自内质网的内囊膜(含 P54、P32、P22、P12、CD2v等)和围绕在内囊膜周围的病毒衣壳(含P72、P17等);病毒在出芽时可获得外囊膜(含P24、P12、CD2v、P54等)。病毒能诱导易感动物产生高滴度抗体,但不具备保护作用,仅具有诊断意义。多数毒株感染单核-巨噬细胞后具有红血球吸附能力,可用玫瑰花环试验证实。
3.1 病毒基因组
ASFV基因组为线状双股单分子DNA,全长约170~192kb。中部为中央保守区(C区),长度约125kb,该区域的一些基因(如P72基因)常作为ASFV基因分型的依据;C区还含有一个4 kb的中央可变区(CVR),位于 P72伴侣蛋白基因 B602L(9RL),在不同基因型或同一基因型的不同毒株之间都存在差异;C区两测各有一个可变区,分别称为VL(38~48 kb)和 VR(13~22 kb),含有 5个多基因家族(MGF),每个多基因家族都可发生缺失、增加、分化等变异,这在不同毒株之间差异很大,与病毒抗原变异、逃避宿主防御系统的机制有关;基因组的两端为共价闭合环状结构,均含有长度为2.1~2.5 kb的颠倒重复序列(TIR)。
3.2 病毒编码蛋白
基因组编码蛋白的数量因毒株不同而有所差异,一般为150~175种,分布在DNA两条链上。有的基因是以多聚蛋白(如PP220、PP62等)的形式表达,经翻译后加工形成大小不等的多种蛋白分子。迄今,发现纯化的病毒粒子中至少含有54种蛋白,而感染的巨噬细胞中至少有100种病毒相关蛋白,这些蛋白的功能包括形成病毒的结构、实现病毒感染、催化病毒复制转录以及逃避宿主防御系统等。其中至少有50种蛋白具有免疫原性,在自然感染过程中能诱生抗体,特别是细胞结合蛋白(如P72、P54和P12)以及病毒内吞相关蛋白(如P32)等都具有很高的抗原性。虽然这些蛋白不足以诱导产生保护性免疫反应,但却足以用于血清学诊断。
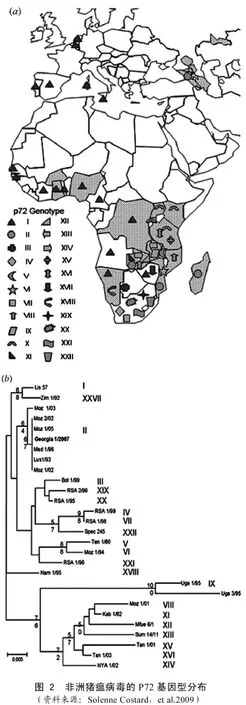
3.2.1 P72 又称P73,分子量73.2 kD,位于细胞内病毒粒子的表层,是由B646L基因编码的主要衣壳蛋白,具有很高的保守性。B646L基因C-末端约478 bp的核酸片段常用于ASFV分子诊断、遗传进化分析和基因型鉴别,利用该片段可将ASFV分成22个基因型,其中,2007年传入高加索地区的ASFV毒株为基因II型。
P72产生于病毒感染的晚期,含有优势抗原决定簇,能诱生高滴度的特异性IgG抗体。由于P72保守性高、抗原性好且易于分离纯化,目前已作为主要抗原用于ASFV-IgG抗体检测。
3.2.2 P54 又称 j13L,分子量 19.9 kD,由 E183L基因编码,属于I类膜蛋白,含半胱氨酸残基,分子间以二硫键相连形成二聚体,存在于病毒的内外囊膜上。在感染细胞过程中,P54蛋白能与胞质动力蛋白轻链LC8直接结合,从而促进病毒与宿主细胞的吸附和侵入。体外实验中,纯化的P54蛋白或其抗体能阻断病毒与易感细胞的结合,但活体试验并不明显。在感染细胞内,P54通过N末端跨膜区与内质网膜结合,通过收敛作用,促进病毒囊膜前体的形成,因此是病毒复制的必需蛋白。
由于P54是一种抗原性强的膜结合蛋白,病毒感染后能产生针对P54的高滴度的IgG和IgM抗体,用P54蛋白建立的ELISA抗体检测方法,具有很高的敏感性、特异性和稳定性,与OIE全病毒抗原ELISA水平相当,用弱毒攻毒后7~10 d即可检测到抗体,而且其制备过程不需要高的生物安全条件,因此是目前综合评价最好的ELISA诊断抗原。
3.2.3 P32 又称P30,分子量23.6kD,由CP204L基因编码,是一种磷蛋白,与病毒侵入有关。P32含有优势抗原决定簇,能诱导较强的体液免疫应答,而且,P32能在病毒感染的早期进行表达和分泌,产生抗体较早,因此,基于P32的ELISA常用于非洲猪瘟感染的早期诊断。
3.2.4 PP62 又称PP60或P60,是一种多聚蛋白,分子量60.5 kD,由CP530R基因编码,在病毒复制晚期表达,经病毒编码的SUMO样蛋白酶裂解形成P35和P15两种病毒结构蛋白,这一过程是在感染细胞内的病毒工厂中完成的。有研究表明,PP62抗体检测ELISA,具有很高的敏感性。
3.2.5 PP220 又称P220,也是一种多聚蛋白,分子量281.5 kD,由CP2475L基因编码,晚期表达,经SUMO样蛋白酶裂解生成P150、P37、P34和P14,这4种蛋白约占ASFV蛋白总量的25%,是构成核心壳的主要成分,在病毒形态形成过程中起着重要作用。
3.2.6 其它蛋白 P12由O61R基因编码,具有细胞吸附功能;S273R基因编码SUMO样蛋白酶,能水解多聚蛋白;CD2v由EP402R基因编码,类似CD2,能使感染细胞具有红血球吸附特性,是ASFV惟一的糖蛋白;B602L(又称9RL)为P72伴侣蛋白,协助完成病毒衣壳的组装;P14.5为DNA结合蛋白,在病毒粒子向胞浆膜迁移过程中发挥作用。ASFV还象痘病毒一样,编码胸苷激酶、DNA聚合酶、DNA连接酶、RNA聚合酶、解旋酶等大量完成复制和转录功能的酶类,此外,还有许多蛋白的生物学和免疫学功能目前尚不清楚。
3.3 病毒分型
ASFV血清中和试验结果很不确实,因此血清分型难以进行,也无实际意义。在病原分子流行病学调查研究中,多采用P72基因序列分析的方法进行基因分型,迄今全球流行的ASFV毒株可分为22个基因型,其大致分布见图2。
3.4 抵抗力
ASFV非常稳定,对热、腐败、酸碱和蛋白酶均具有较高耐受性。在有血清介质的情况下存活时间:5℃为6年,室温为18个月,37℃为1个月,56℃为3.5 h。对pH变化抵抗力强,一般在无血清条件下,在pH3.9~11.5范围内稳定,pH13.4时仍能存活21 h;在有血清条件下抵抗力更强,pH3.1存活22 h,pH3.9存活3 d,pH13.4存活7 d。室温条件下,在粪便中可存活11 d,腐败血液中15 w;4℃条件下,在血液中存活18个月;在腌制干火腿中可存活150 d;在半熟肉以及泔水中也可长时间存活。
ASFV对乙醚和氯仿等脂溶剂敏感,消毒剂中季铵盐、碘制剂和苯酚类效果较好,而0.8%NaOH、含2.3%有效氯的次氯酸盐、0.3%福尔马林以及3%邻苯基苯酚均可在30min钟内灭活。
3.5 培养特性
ASFV可在猪单核巨噬细胞、骨髓细胞和白细胞中生长,可从猪血分离白细胞、仔猪骨髓中分离骨髓细胞、猪肺中分离巨噬细胞用于病毒分离培养;某些毒株经适应后也可在MS(Monkey stable,猴稳定细胞系)、Vero、猪肾、牛肾等细胞以及鸡胚中生长;有的实验室还采用软蜱进行病毒的传代培养。
多数毒株感染白细胞后1~3 d出现病变,并能吸附猪的红血球,可通过红血球吸附试验(HAD)加以证实。传代细胞适应毒引起的细胞病变更加明显,在胞浆中可见包涵体,细胞容易脱落,可用荧光抗体或PCR方法等方法检测细胞中的病毒。
4 感染与免疫
4.1 感染发病机制
ASFV对单核巨噬细胞具有明显的亲和力,病毒以不同方式进入机体后,可直接或通过血液循环感染局部淋巴组织中的单核巨噬细胞,大量增殖后,再次进入血液,吸附于红细胞等血细胞,随血液循环感染更多部位的单核巨噬细胞,稍后可进一步感染内皮细胞、巨核细胞、中性细胞和肝细胞等多种细胞类型。同其它出血热病毒一样,ASFV可导致血管内皮细胞凋亡,使血管通透性增加,从而引起广泛的出血性病变,在感染后期,则进一步发展成弥漫性血管内凝血(DIC),抗体与细胞成分的免疫复合物可能在这一过程发挥作用。在淋巴组织中,ASFV强毒株能导致大量的淋巴细胞凋亡,由于病毒不能直接感染T和B淋巴细胞,推测这种凋亡是由病毒感染的巨噬细胞表面或释放的细胞因子引起的,并最终导致T和B细胞数量显著减少,从而对ASFV免疫应答受到损伤。
多数ASFV分离株能使家猪发生急性出血热,感染后8~14 d,致死率可高达100%,某些中等毒力的毒株,致死率会降低至30%~50%,而伊比利亚半岛分离的弱毒株,症状轻微,致死率很低。强毒或中等毒感染后,猪血毒滴度可达到每毫升108个半数红细胞吸附单位(即108HAD50/mL),但康复之后血毒水平较低,病毒在组织中复制也显著减少。新生仔猪人工感染表明,最早于感染后8 h即可出现初次病毒血症,15~24 h出现第二次病毒血症,30 h几乎所有组织均可测到病毒,72 h即可达到最高滴度。弱毒感染后,虽然在淋巴组织中可检测到中等水平的病毒滴度,但血毒滴度很低且仅能从少数猪中检出。康复猪能长期、持续带毒,这一特性说明ASFV能有效地逃避宿主防御系统。
4.2 免疫应答
感染ASFV强毒的猪多在出现体液免疫应答之前就已死亡,存活时间稍长的猪则可出现特异性体液和细胞免疫应答,康复猪对同源毒株的攻击能产生较强保护力,但对异源毒株却没有抵抗力。早期研究表明,用弱毒株进行攻毒,1周后部分猪血清中出现补体结合(CF)抗体,2周后多数猪CF抗体阳性,部分猪开始出现琼扩(AGP)抗体,3周后所有猪CF和AGP抗体阳性,可维持数月以上。用ELISA试剂盒,多数在感染后7~10 d即可检测到抗体,而且由于持续感染的存在,抗体可持续终生。
ASFV不能使机体产生具有保护作用的中和抗体,体外中和试验也大都得出同样结论;另一方面,该病毒诱导产生的特异性细胞免疫应答,仅能提供部分但并不充分的免疫保护。有研究者认为耐过病猪能够抵抗同源毒株的攻击,是由于产生了干扰物质的缘故。
5 诊断试剂与疫苗研究
由于目前尚无有效的疫苗,所有ASF的控制和消灭措施,均基于快速准确的诊断。ASF诊断方法有很多,包括病原分离、红细胞吸附试验、PCR检测、补体结合反应、琼脂扩散试验、ELISA、免疫印迹(IB)、免疫荧光(IF)等。
5.1 诊断试剂
5.1.1 诊断抗原 可采用基因表达的方法制备抗原,也可采用病毒的细胞培养物制备抗原。
基因表达抗原,如 P72、P54、P32、PP62、A104R、B602L、K205R等,均被用于ELISA抗体检测试剂的开发,其中P72、P54等应用较广,如西班牙INGENASA公司生产的ASFV抗体阻断ELISA试剂盒和双抗夹心ELISA试剂盒,均以P72表达抗原及其单抗为基础,分别用于抗体和病原检测。
全病毒抗原,采用ASFV弱毒株感染MS等传代细胞系制备,是目前OIE推荐的抗原制备方法,可广泛用于ELISA、免疫印迹和琼扩试验等。
5.1.2 诊断抗体
阳性血清 可采用ASF康复猪血清制备,也可采用攻毒的方法制备。后者需在ABSL-3实验室中进行,一般先用高滴度的弱毒株肌肉注射攻毒,再用低滴度的强毒株攻毒,根据需要可重复攻毒,最后一次攻毒后10 d,采血分离血清,56℃30min灭能,经相应方法(如 ELISA、CF、AGP等)标定后,小量分装,-20℃保存。
单抗 ASFV多种蛋白的单抗已研制成功,有的已用于诊断,如INGENASA夹心ELISA、阻断ELISA等均以P72不同表位单抗作为捕获或指示抗体。
5.1.3 抗原检测ELISA 以单抗为基础的夹心ELISA,可用于ASFV抗原检测,特异性较高。INGENASA夹心ELISA试剂盒,以包被的P72(P73)单抗吸附样品中的病毒抗原,用针对P72另一表位酶标单抗显示抗原的存在,可用于检测血液、脾脏或淋巴结中的病毒抗原。
5.1.4 抗体检测ELISA(OIE国际贸易指定试验)
间接ELISA 该方法以全病毒抗原或表达抗原(如P72,P54等)包板,借以吸附血清中的ASFV抗体,然后以酶标SPA(或抗猪IgG)指示抗体的存在,阳性样品有颜色反应。
阻断ELISA 包被抗原同间接ELISA,指示抗体采用针对某一蛋白(如P72)的酶标单抗,如果血清中有ASFV抗体,则单抗与包被抗原结合受阻,可根据OD值计算阻断率,从而估计阳性值的高低,强阳性样品无颜色反应。
5.1.5 PCR检测(OIE国际贸易指定试验)
普通PCR根据ASFV分离株BA71V之P72基因保守序列设计引物,扩增基因组第88363~88619位核苷酸片段,总长度257 bp,该引物既可单独用于ASFV核酸检测,也可与猪瘟病毒引物混合用于鉴别诊断。
荧光定量PCR根据ASFV分离株BA71V之P72基因第2041~2290位核苷酸序列设计引物和探针,扩增长度250 bp,该方法比普通PCR敏感性更高。
5.2 疫苗与展望
迄今,所有疫苗的尝试均没有成功。这是由病原多变、主要侵害免疫屏障、容易逃避免疫系统、不能诱生有效中和抗体、涉及复杂的细胞免疫以及动物宿主本身的遗传特性等多种因素决定的。
早期疫苗的研究主要集中在灭活疫苗和弱毒疫苗。大量研究表明,灭活疫苗虽然能够诱导机体产生抗体,但几乎没有保护作用。弱毒疫苗虽然对同源强毒有一定保护效果,但由于ASFV的高度变异性,其安全性很差,时常引发疾病,导致病原严重扩散。西班牙和葡萄牙在ASF传入的早期曾尝试使用弱毒疫苗,但最终均以失败而告终,弱毒疫苗的使用导致了疫病大面积、长时间流行,严重影响了疫病控制和消灭的进程。
近20年来,运用分子生物学和免疫学技术对ASF的疫苗和免疫问题也进行了诸多探索性研究。ASFV在吸附和进入细胞过程中,有P30、P54、P72等多种病毒蛋白参与,因此ASF亚单位疫苗和重组疫苗的研究大多倾向选取这些基因,但用杆状病毒等表达系统研制的亚单位疫苗,仅能延缓临床症状出现的时间并在一定程度上降低病毒血症水平,却并不能产生足够的保护。
虽然如此,基于弱毒株或重组病毒等所进行的基础研究,对未来ASF疫苗的研究策略仍具有一定的启发意义。研究发现,ASFV弱毒株感染机体所产生的特异性CD8+CTL,能识别巨噬细胞被ASFV强毒感染后所形成的SLA I类分子-抗原复合物,引发这些巨噬细胞的凋亡;研究还发现,弱毒株的保护作用还与机体产生的NK细胞活性水平成正相关,也与巨噬细胞感染病毒后所释放的细胞因子有关。这些证据表明,弱毒疫苗的保护作用可能主要由细胞免疫来完成。因此,未来ASF疫苗的研究,应致力于研制能有效刺激保护性细胞免疫的安全疫苗,如重组伪狂犬病毒疫苗、毒力基因缺失疫苗、具备刺激细胞免疫能力的多肽疫苗等。由于ASFV是一种能发生高度变异的大病毒,存在着许多逃避宿主免疫系统的复杂机制,加上病毒感染、致病和免疫过程牵扯到许多成分和表位,近期在疫苗研究上取得突破仍很困难,只有通过基础研究的不断深入以及对病毒特性的不断了解,才有可能找到新的思路。
[1]王君玮,王志亮.非洲猪瘟[M].北京:中国农业出版社,2010.
[2]Carmina Gallardo,Ana Luísa Reis,Gladys Kalema-Zikusoka,et al.Recombinant Antigen Targets for Serodiagnosis of African Swine Fever[J].Clinical and Vaccine Immunology,2009,16(7):1012-1020.
[3]Office International des Epizooties(OIE).African swine fever[M]//OIE.Manual of diagnostic tests and vaccines for terrestrial animals.Paris:OIE Press,2008.
[4]Dixon L K,Chapman D.African swine fever virus[M]//Mathy B W I,Van Regenmortel M H V.Encyclopedia of Virology.3rd ed.United Kingdom:Elsevier Ltd,2008:43-51.
[5]Jose Manuel Sá nchez-Vizcaí no,Beatriz Martí nez-Ló pez,Marta Martí nez-Avilé s,et al.Scientific Review on African Swine Fever[J].Science Report,2009(5):1-141.
[6]Fernandez P J,White W R.Atlas of Transboundary Animal Diseases[M].Paris:OIE Press,2010:20-29.
