OCTREOTIDE的131I标记及GRAVES眼病炎症细胞的体外摄取
2011-05-16王荣福周颖明张一帆
卢 霞,王荣福,闫 平,周颖明,张一帆
(1.北京大学第一医院 核医学科,北京 100034;2.上海交通大学医学院附属瑞金医院 眼科,上海 200025)
甲状腺相关眼病(Thyroid Associated Ophthalmophy,TAO),又称“Graves眼病”,是甲状腺疾病引发的最常见的眼眶病变之一,严重时可导致患者失明。目前临床上还缺乏行之有效的Graves眼病的治疗方法。在Graves眼病活动期,球后组织浸润的淋巴细胞和活化的成纤维细胞表达生长抑素受体(Somatostatin Receptor,SSTR),其数量与炎症活动度呈正相关[1-3]。[Tyr3]octreotide是人工合成的含八个氨基酸多肽的生长抑素类似物(SSA),被131I标记后与生长抑素受体亚型 SSTR2、SSTR5有高亲和力,在恶性肿瘤临床显像方面已获得成功[4]。但关于炎症细胞对放射性核素标记octreotide的摄取情况还未见报道。
关于131I标记octreotide已有很多报道,并且标记率较高。标记物多用于肿瘤显像及治疗研究。由于131I能够发射β射线,对细胞造成非特异的杀伤作用。本工作拟采用已对octreotide进行结构修饰后形成的[Tyr3]octreotide进行131I标记,并考察标记物体外结合炎症细胞的能力,初步探讨其应用于Graves眼病诊疗的可行性。
1 主要实验材料
1.1 主要试剂
[Tyr3]octreotide的合成:由北京中科亚光生物科技有限公司在Apex 396全自动多肽合成仪上采用固相合成法合成,合成的粗提物经高效液相色谱法(HPLC)分离纯化,纯度达到99%,其化学结构示于图1。
无载体131I-NaI:原子高科股份有限公司产品;氯胺 T(Ch2T):纯度 >98%,Aldrich Chemical公司产品;Sephadex G-10:Pharmacia Biotech公司产品;胎牛血清:购自GIBCO生物制剂公司。其他试剂均为分析纯,购自北京化学试剂公司。
1.2 细胞
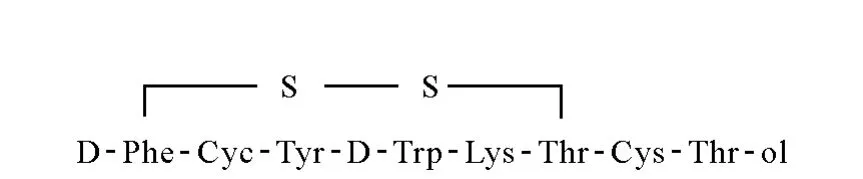
图1 [Tyr3]octreotide的结构
HUVEC血管细胞株、内皮细胞培养基ECM:购自裕恒丰生物科技有限公司;IL-6细胞因子:北京谱京康利科技有限公司产品;T淋巴细胞、成纤维细胞(NIH3T3)及小鼠脂肪细胞(3T3L1)、RPMI-1640及高糖/DMEM 培养基:购自南京凯基生物科技有限公司。
2 实验方法
2.1 [Tyr3]octreotide的131I标记
2.2.1 氯胺T法
在阿贲道夫管内依次加入51μL 0.05 mol/L pH=7.5的磷酸盐缓冲液(PBS)和20μL[Tyr3]-octreotide(溶于0.05 mol/L PBS溶液中),再加入20μL 37 MBq Na131I,随即加入9μL氯胺 T(溶于0.05 mol/L PBS中),总反应体积为100μL,震摇3 min,加入0.1 mL 10%的人血清白蛋白中止反应。混匀30 s,加入1.85 mL NH4 HAc混匀,待测。
采用纸层析法测定131I-[Tyr3]octreotide标记率,展开剂为V(甲醇)∶V(水)=1∶3。用Sephadex G10柱对标记液进行纯化,0.05 mol/L磷酸缓冲液(PB)洗脱,按每管0.5 mL收集淋洗液,用γ计数仪测每管的放射性计数,用于细胞结合实验。
2.2.2 Iodogen法
取1个 Iodogen(150μg)涂管,依次向其中加入 20 μg[Tyr3]octreotide,37 MBq Na131I,用0.05 mol/L p H=7.4的PB补足至65μL,在旋涡混合器上轻轻振荡反应15 min,此后加入100 μL 0.05 mol/L pH=7.4的 PB,混匀。
标记率的测定及标记物的纯化方法同2.2.1节。
2.3 炎症细胞对131I-[Tyr3]octreotide的摄取
2.3.1 细胞培养 在ECM培养基中添加内皮生长因子、5%胎牛血清及青霉素和链霉素后,将HUVEC血管细胞株培养于ECM培养基中;在RPMI-1640培养基中添加10%胎牛血清后用于培养悬浮的 T淋巴细胞;用高糖/DMEM(含10%胎牛血清)培养基培养贴壁生长的成纤维细胞及脂肪细胞。
2.3.2 细胞摄取实验 待细胞长至80%,生长状态良好后铺于24孔板上,细胞数量约为3×104,培养 24 h后,向每孔内加入37 kBq131I-[Tyr3]octreotide,在不同时间点分别测定培养液和细胞的放射性计数,计算不同时间点不同细胞对131I-[Tyr3]octreotide的摄取率。摄取率=细胞中的放射性计数/(培养液与细胞放射性总和)×100%。
2.4 数据处理
3 结果与讨论
3.1 [Tyr3]octreotide的131 I标记结果
采用氯胺T法进行[Tyr3]octreotide的131I,标记率最高达85%。
采用Iodogen法进行[Tyr3]octreotide的131I,标记率为76%。实验中,用 0.05 mol/L的PB溶解[Tyr3]octreotide,与乙酸相比,标记率无明显变化。相比之下,用氯胺T法能得到较高的标记率,因此,选择用氯胺T法进行标记。
3.2 氯胺T法标记条件优化
3.2.1 氯胺T用量对标记率的影响
按照2.2.1节的标记方法,其他反应条件不变,[Tyr3]-octreotide的用量选择1.4μg,改变氯胺 T 的用量(1.6、90、180、270和 360 μg),观察其对标记率的影响,结果示于图2。由图2可以看出,随氯胺T用量的增加,标记率呈现降低的趋势,氯胺T用量为1.6μg时标记率最高,达到85%。氯胺T的用量增加到90μg后,标记率已很低。这是由于氯胺 T是一种性质温和的氧化剂,用量过大会导致蛋白质结构和活性的严重损伤,但并不能使标记率明显提高,反而使标记多肽的活性下降。某些多肽对氯胺 T较敏感,在标记反应中需要进一步减少氯胺T用量。本工作选择氯胺T用量为1.6μg[5]。
3.2.2 [Tyr3]-octreotide用量对标记率的影响
按照2.2.1节的标记方法,其他反应条件不变,氯胺T用量选择 1.6μg,改变[Tyr3]-octreotide的用量分别为1.4、8和50μg,观察其对标记率的影响,结果示于图3。图3显示,随着[Tyr3]-octreotide用量的增加,标记率明显降低,[Tyr3]-octreotide的用量为1.4μg时,标记率最高,为85%。本工作选择[Tyr3]-octreotide的用量为1.4μg,与其他多肽氯胺 T法碘标记相比,[Tyr3]-octreotide用量已很小,标记率较高,与文献[5]结果一致。影响蛋白质、多肽标记率的因素,主要决定于蛋白质、多肽分子中酪氨酸残基的数量及它们在分子中暴露的程度。酪氨酸位于[Tyr3]-octreotide环状结构内,考虑是由于空间结构之间的阻力使其不容易被放射性核素碘标记。明确的原因还有待于进一步研究。

图2 氯胺T用量对标记率的影响

图3 [Tyr3]-octreotide用量对标记率的影响
3.3 131I-[Tyr3]octreotide的细胞摄取
在不同时间点,血管细胞、脂肪细胞、T淋巴细胞及成纤维细胞对131I-[Tyr3]octreotide的摄取示于图4。由图4可以看出,血管细胞、T淋巴细胞及成纤维细胞中均有一定量131I-[Tyr3]octreotide的摄取,相对于血管细胞比较稳定的摄取而言,T淋巴细胞摄取131I-[Tyr3]octreotide较多,在3 h摄取量达到最大值。活化的成纤维细胞也有明显的摄取,其摄取量在6 h达到最大值。脂肪细胞摄取131I-[Tyr3]octreotide较少,未出现明显的峰值。
一般认为,Graves眼病的病理改变包括多种炎症因子参与的眶周组织的水肿,T淋巴细胞的浸润,活化成纤维细胞产生大量的葡萄糖胺聚糖,刺激脂肪细胞和肌肉组织的增生,产生突眼症状[6]。T淋巴细胞和活化的成纤维细胞在Graves眼病的发病机制中起重要作用[7]。它们可以大量摄取131I-[Tyr3]octreotide,考虑是因为131I-[Tyr3]octreotide与活化成纤维细胞上表达的生长抑素受体大量结合,而脂肪细胞较少表达生长抑素受体,故131I-[Tyr3]octreotide摄取较少。由于Graves眼病是一种器官自身免疫反应过程,在其发生和发展过程中有许多细胞因子也参与并起着重要作用。其中,IL-6主要由单核巨噬细胞、内皮细胞、T细胞、B细胞及纤维母细胞组成,是具有旁分泌和自分泌的细胞因子,可促进 T细胞和B细胞增殖、分化和分泌免疫球蛋白,参与免疫和炎症过程。Hiromatsu等[8]用 RT-PCR检测了Graves眼病患者的眼外肌与眼眶脂肪组织,发现眼外肌中IL-6表达较高,并且Graves眼病患者眼眶容量与IL-6 mRNA表达呈正相关。为模拟体外Graves眼病病理生理微环境,在本实验细胞培养过程中添加生理浓度的IL-6细胞因子,使得T淋巴细胞及活化成纤维细胞的生物学特性尽量与体内环境一致。

图4 [Tyr3]-octreotide的细胞摄取
4 结 论
1)将octreotide中的苯丙氨酸用酪氨酸替换,合成的[Tyr3]-octreotide能够用于131I标记。
2)采用氯胺T法进行[Tyr3]-octreotide131I标记。标记中,氯胺T和[Tyr3]-octreotide用量分别为 1.6μg和 1.4μg,标记率可达85%。产品需要进一步纯化。
3)Graves眼病主要炎症反应细胞T淋巴细胞和活化的成纤维细胞对131I-[Tyr3]-octreotide均有明显摄取,且明显高于血管内皮细胞和脂肪细胞。结合[Tyr3]-octreotide与生长抑素受体的靶向结合作用和放射性核素的可探测性考虑,131I-[Tyr3]-octreotide具有用于Graves眼病发病过程中炎症反应程度评估的应用潜力。
要结合[Tyr3]-octreotide的化学毒性作用和射线的非特异性杀伤作用,达到抑制Graves眼病炎症反应进程的最终目的,还受限于131I-[Tyr3]-octreotide较低的细胞摄取率,需要进行进一步深入研究。
[1] Prummel MF.Graves'ophthalmopathy:diagnosis and management[J].Eur J Nucl Med,2000,27:373-376.
[2] Gerding MN,van der Zant FM,van der Royen EA,et al.Octreotide-scintigraphy is a disease-activity parameter in Graves'ophthalmopathy[J].Clin Endocrinol,1999,50:373-379.
[3] Marcocci C,Marino M,Rocchi R,et al.Novel aspects of immunosuppressive and radiotherapy management of Graves'ophthalmopathy[J].J Endocrinol Invest,2004,27:272-280.
[4] Bakker WH,Krenning EP,Breeman WA,et al.Receptor scintigraphy with a radioiodinated somatostatin analogue:radiolabeling,purification,biologic activity,and in vivo application in animals[J].J Nucl Med,1990,31:1 501-1 509.
[5] 朱然,范我,许玉杰,等.125I标记的[Tyr3]2oct reotide在小鼠体内的分布及其药代动力学研究[J].苏州大学学报:医学版,2006,26(5):725-733.
[6] Many MC,Costagliola S,Detrait M,et al.Development of an Animal Model of Autoimmune Thyroid Eye Disease[J].J Immunol,1999,162:4 966-4 974.
[7] 胡蜀红.Graves眼病的发病机理[J].国外医学:内分泌学分册,2002,22:98-101.
[8] Hiromatsu Y,Yabg D,Bednarczuk T,et al.Cytokine profiles in eye muscle tissue and orbital fat tissue f rom patients with thyroid-associated ophthalmopathy[J].J Clin Endocrinol Metab,2000,85(3):1 194-1 199.
