抗阻运动诱导骨骼肌生理性肥大的信号传导通路
2011-05-12赵永军陈彩珍卢健
赵永军 陈彩珍 卢健
华东师范大学体育与健康学院(上海 200241)
肌组织具有很强的可塑性,能够在一定范围内改变其体积和质量以适应各种复杂的环境。骨骼肌肥大( skeletal muscle hypertrophy) 是指由力量训练引起的骨骼肌纤维增粗,横断面积增加,以及随之发生骨骼肌功能改善的现象[1]。研究发现肌肉质量的维持是由体内蛋白质合成(protein synthesis)与蛋白质降解(protein degradation)的代谢平衡决定的,这两个过程不是彼此独立的,而是通过细胞内复杂而又精确的信号传导网络协同发挥作用,细胞内信号分子通过感应细胞内外环境的刺激决定骨骼肌蛋白质的合成与分解。抗阻运动作为机体的一种刺激可以使肌原纤维体积和质量及胶原蛋白含量增加[2],本文试图对近年来关于骨骼肌肥大的机制研究进行综述,分析归纳抗阻运动诱导的骨骼肌生理性肥大的细胞分子机制。
目前关于骨骼肌肥大机制的研究主要有两方面:(1)骨骼肌细胞蛋白质代谢正平衡的信号通路(即促进蛋白质合成和抑制蛋白质降解的通路);(2)卫星细胞被激活诱导骨骼肌纤维数量增多的细胞分子通路。
1 抗阻运动诱导骨骼肌细胞蛋白质代谢正平衡的信号传导通路
1.1 抗阻运动诱导肌肉蛋白质合成的信号传导通路
1.1.1 胰岛素样生长因子-1介导的Akt-1信号通路(图 1)
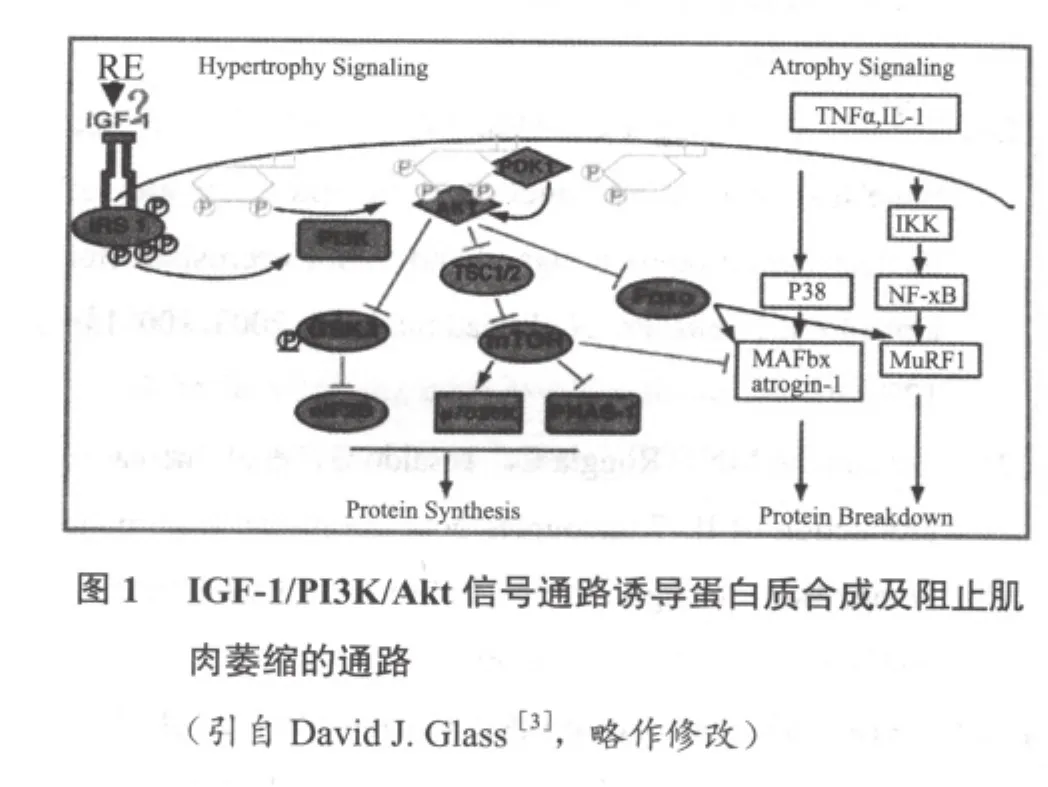
抗阻运动促使胰岛素样生长因子(insulin-like growth factor-I,IGF-1)升高,从而激活PI3K/Akt-1通路是促进骨骼肌细胞内蛋白质合成的主要途径[3]。IGF-1是主要由肝脏分泌的一种调节骨骼肌生长发育的细胞因子,另外,骨骼肌通过自分泌和旁分泌产生IGF-1在调节肌肉生长修复中起着更为重要的作用[4]。当机体受到机械刺激时,特别是在机体进行抗阻运动后,肌肉组织中IGF-1基因发生选择剪接,至少产生两种不同的剪接异构体[5]:一种是循环型或系统型IGF-1——IGF-1Ea,其构成与肝脏型的IGF-1相同,作用是促进肌肉肥大和蛋白合成;另一种异构体为机械生长因子(mechano growth factor,MGF),主要促进卫星细胞的激活,它只在肌肉受到机械刺激时才特异性表达。IGF-1通过与骨骼肌细胞表面的胰岛素样生长因子受体(IGFR)特异性结合,引起IGFR磷酸化,受体磷酸化可募集胰岛素受体底物 -1(insulin receptor substrate-1,IRS-1)到细胞膜并使其也发生磷酸化。磷酸化的IRS-1可激活磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K),该激酶的活化使位于细胞膜上的磷脂酰肌醇(phosphatidylinositol 4,5 trisphosphate,PIP2)磷酸化,即在其肌醇环3位上添加一个磷酸基团,从而形成 PIP3(phosphatidylinositol 3,4,5 trisphosphate,PIP3)。PIP3的形成对于 Akt-1从胞浆募集到细胞膜及其激活是必需的[6]。同时PIP3募集磷酸肌醇依赖的蛋白激酶-1(PDK-1)到细胞膜上,PDK-1可使Akt-1激酶区上苏氨酸308磷酸化,参与Akt-1的激活[7]。只有当Akt-1和PDK-1同时募集到细胞膜,才能使Akt-1充分激活[8]。Akt又叫蛋白激酶B(protein kinase B,PKB),是一类丝氨酸/苏氨酸蛋白激酶,包含三个结构域:氨基端的PH(pleckstrin homology)结构域,中间的激酶(kinase)结构域,羧基端的疏水作用结构域 HM(hydrophobic motif)[7]。Akt-1的激活是由其三级结构共同完成的:(1)PH结构域与磷脂酰肌醇环上第三和第四位磷酸基团特异性结合[9],使Akt-1被PIP3募集到细胞膜内侧;(2)RictormTOR-GβL复合体使HM结构域上丝氨酸残基473磷酸化[10];(3)激酶区上的苏氨酸残基308被同时募集到细胞膜上的PDK-1磷酸化[7]。当这三个条件同时满足时,Akt-1便被充分激活。在未激活态的空间结构中,Akt-1的PH结构域和HM结构域较靠近,而当其PH结构域结合到膜内侧PIP3上后,整个蛋白质分子呈伸展构象,使其激酶区和HM结构域充分暴露[7],丝氨酸473和苏氨酸308被磷酸化,从而引发下游细胞分子的激活。
Akt-1是蛋白质合成的重要中间激酶,可以激活下游雷帕霉素靶体蛋白(mammalian target of rapamycin,mTOR)信号传导通路和糖原合酶激酶3β(glycogen synthase kinase 3β,GSK-3β) 信号传导通路。首先为mTOR信号途径:TOR是一类高度保守的丝氨酸/苏氨酸激酶,它能够对营养、生长因子、细胞内能量以及应激做出应答,调控细胞生长和代谢,存在于所有真核生物中。TOR包括两个结构和功能不同的多蛋白复合体TORC1和TORC2,哺乳动物TORC1(mTORC1)具有雷帕霉素敏感性,由mTOR、raptor、mLST8组成,主要功能是调节翻译、转录、核糖体生物发生、营养物质转运和自体吞噬,从而调节细胞生长[11]。mTORC2是非雷帕霉素敏感的,由mTOR、rictor、mSINI、PRR5、mLST8组成,主要功能是通过调控肌动蛋白细胞骨架介导细胞生长的三维控制[11]。在抗阻训练诱导骨骼肌肥大中,两种形式的mTOR都发挥了作用。其中,活化的Akt-1可激活mTORC1复合体:一方面,激活的mTORC1复合体可以使核糖体上的P70S6K激酶(S6K)磷酸化而使其活化[12],活化的S6K可使核糖体S6蛋白处于高磷酸化状态,增强mRNA翻译,直接促进蛋白质的合成;另一方面,激活的mTORC1复合体可磷酸化真核生物翻译起始因子4E结合蛋白-1(eukaryotic initiation factor- 4E- binding protein-1,eIF4E-BP-1),使eIF4E-BP-1失活进而释放真核生物翻译起始因子4E(eukaryotic initiation factor- 4E,eIF4E),被释放的eIF4E与eIF4G结合,形成复合体eIF4E-eIF4G,诱导mRNA翻译,促进蛋白质合成[13]。mTORC2即前面所提到的Rictor-mTORGβL复合体,近年来发现它可使Akt-1 HM结构域上的丝氨酸473磷酸化,进而组成Akt-1激活的一部分[10]。mTOR的一个重要调节机制就是其负反馈调节环(negative feedback loop),过度激活的mTORC1和S6K可抑制胰岛素受体底物-1(IRS-1)的上调,从而反馈性调节蛋白质的合成[11]。另外,mTORC2是Akt-1的上游激活剂,而mTORC1又是Akt-1的下游作用底物,这种由同一类物质的不同复合体调节的Akt-1活性可能存在着反馈性调节,是今后值得研究的方向。其次为GSK-3β信号途径:GSK-3也是一类广泛存在的丝氨酸/苏氨酸蛋白激酶,对于调节细胞生长和分化、凋亡、神经变性和蛋白质合成有重要作用[14]。GSK-3有两种存在形式——GSK-3α和GSK-3β,两种亚型在激酶区有98%的氨基酸相同,整个分子有87%相同[15],它们在结构上最大的区别是GSK-3α在氨基端有一个延伸和在羧基端的易变性。虽然两种亚型很相似,但它们在功能上不可替代,研究发现敲除GSK-3β的动物胚胎是致命的,并且不可通过GSK-3α的过量表达代偿[16],而相反的,GSK-3α敲除小鼠可以存活[17]。最近的研究发现GSK-3α的下降可以使ISR-1蛋白质表达上升[18],而GSK-3β的下降却没有引起这一现象发生[14]。GSK-3的组成型本身具有活性,GSK-3α上丝氨酸21磷酸化可使其失活,而GSK-3β上丝氨酸9的磷酸化可使其失活[15]。抗阻运动诱导Akt-1活化,活化的Akt-1可以直接使GSK-3β上丝氨酸9磷酸化从而使其失活,失活的GSK-3β解除了对真核生物翻译起始因子2B(eukaryotic initiation factor- 2B,eIF2B)的抑制作用,从而促进蛋白质的合成增加。实验证明大鼠抗阻运动训练后,肌组织内eIF2B含量增加,由eIF2B介导的蛋白质合成也相应增加[19]。
抗阻训练通过激活IGF-1/PI3K/Akt-1/mTOR/S6K通 路,IGF-1/PI3K/Akt-1/ mTOR/eIF-4E-BP-1/eIF4E通 路,IGF-1/PI3K/Akt-1/mTOR/GSK-3β/eIF2B通路促进蛋白质合成,增加肌肉质量与体积。但最近研究发现,抗阻训练后15 min,mTOR、P70S6K和S6磷酸化程度增加,但Akt-1的磷酸化程度没有变化[20],推测抗阻训练诱导mTOR通路变化不依赖于Akt-1磷酸化[21],表明抗阻训练诱导mTOR通路还可能存在其他激活途径。因此,对抗阻训练诱导mTOR通路激活及其下游的信号分子的变化,还需要深入研究。
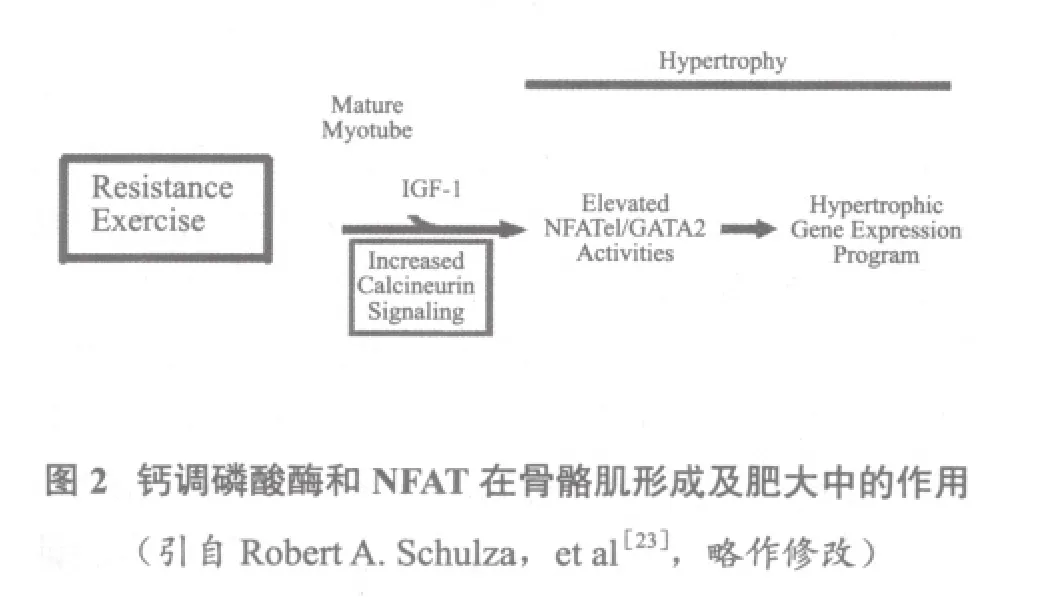
1.1.2 钙调磷酸酶介导的骨骼肌肥大信号传导通路(图 2)
钙调磷酸酶(calcineurin)是一种丝氨酸/苏氨酸蛋白磷酸酶,其活性依赖Ca2+和钙调蛋白(calmodulin,CaM)。活化T细胞核因子(nuclear factor of activated T cells,NFAT) 是 Calcineurin 的直接靶分子。1999年Dunn证明在骨骼肌纤维肥大的过程中Calcineurin发挥着重要作用,抗阻运动训练诱导胰岛素生长因子的增加,可引起肌纤维细胞内钙离子的缓慢增加,并最终导致Calcineurin的激活[22]。激活的Calcineurin使NFATc1去磷酸化,并使其由胞浆转位至核内,与转录因子GATA2结合,即生肌细胞中去磷酸化的NFATc1和GATA2转录因子结合,最终激活骨骼肌肥大相关基因的转录程序[23]。现已证明NFAT有三种亚型:NFATc1,NFATc2,NFATc3,它们各自存在于不同的细胞中,分别为:生肌细胞(myoblasts),初期肌小管(nascent myotubes),成熟肌小管(mature myotubes)[24],不同形式的NFAT可以激活不同的基因表达。虽然已经证明Calcineurin/NFAT信号通路在肌肉肥大机制中发挥重要作用,但这条通路的精确调控机制还不是很清楚,有待深入研究。
1.1.3 肌肉抑制素介导的骨骼肌肥大信号传导通路
1997年McPherron等研究发现一种分泌型生长分化因子,将其命名为GDF-8(growth differentiation factor - 8),因其对肌肉生长有负调控作用,故也称为肌肉生长抑制素(Myostatin)[25]。肌肉生长抑制素在各个组织中表达情况不一,主要在骨骼肌中进行表达,是组织差异性表达基因,该基因突变可导致骨骼肌肥大[26]。通过基因敲除技术(gene knockout) 使小鼠的Myostatin基因C端生物活性区缺失,突变纯合体小鼠可以正常存活并能够生育后代。排除性别年龄的影响后检测其体重发现,纯合突变体小鼠比杂合体或野生型小鼠重约30%,体重增加主要由于肌纤维数量增加而不是脂肪增加造成的,突变鼠骨骼肌比野生型小鼠多2~3倍。突变鼠骨骼肌肌纤维数目比野生型鼠高86%,DNA含量高约50%。表明突变鼠既有肌细胞的增生,也有肌纤维的肥大。由此得出,Myostatin是小鼠骨骼肌生长发育的抑制因子[25]。目前动物、人体实验研究发现,增加肌肉的机械负荷将导致肌肉体积增大,同时肌肉生长抑制素水平下降,提示肌肉生长抑制素参与了运动对骨骼肌的促进机制。对人类的研究发现,年轻个体经过9周抗阻训练(每周3次),力量和骨骼肌体积增加的同时,肌肉生长抑制素mRNA表达显著降低37%[27]。有研究[28]发现,Myostatin通过与ActRIIB(activin receptor type IIB) 结合开启下游信号通路,但关于抗阻运动中Myostatin的具体激活机制以及其发挥作用的机理还有待大量实验的进一步研究。
1.2 抗阻运动抑制肌肉蛋白质降解的信号转导通路(图 1、图 3)
研究证明骨骼肌肌肉萎缩伴随着MuRF1(muscle ring finger1)和MAFbx(muscle atrophy F-box)的显著升高,表明MuRF1和MAFbx在肌肉蛋白质降解中扮演重要角色[29]。并且有证据表明抗阻运动诱导的IGF-1升高的同时可使MuRF1和MAFbx下调[29-31],说明IGF-1可通过某种信号通路抑制MuRF1和MAFbx的活性,从而减少蛋白质的降解。而IGF-1诱导的Akt通路可阻断MuRF1和MAFbx的转录[31],进一步研究表明正是Akt-1通过使转录因子FOXO(forhead box O)磷酸化后与14-3-3蛋白相作用,使FOXO停留在胞浆内而不能进入细胞核内,因为FOXO的脱磷酸化状态对于参与蛋白质降解的MAFbx和MuRF1转录因子的激活是必要的[30],所以当磷酸化的FOXO使MAFbx和MuRF1的转录过程阻断,蛋白质降解受到抑制。因为用雷帕霉素处理并不会影响FOXO的移位,所以由Akt激活的mTOR可能不参与FOXO的磷酸化[32]。
另外,Myostatin在抑制蛋白质水解通路中也发挥一定的作用。研究发现在Myostatin敲除小鼠中由地塞米松介导的MAFbx 、MuRF1和FOXO3a mRNA升高现象消失[34],而用Myostatin处理过的肌小管C2C12发现蛋白质降解因子MAFbx和MuRF1 mRNA与遍在化蛋白一起升高,并伴有FOXO1的磷酸化比率下降[35]。研究还发现PGC-1α——一种可以抑制MAFbx 和MuRF1表达的细胞因子——在Myostatin异常表达体外动物模型中表达下降[36],说明抗阻运动诱导的Myostatin含量下降可以减少对PGC-1α的抑制,而PGC-1α的增加抑制FOXO / MAFbx和MuRF1通路从而使蛋白质降解减少,相对促进肌肉的肥大。

2 抗阻运动介导卫星细胞诱导骨骼肌纤维数量增多的细胞分子通路
抗阻训练诱导卫星细胞激活目前研究比较透彻的是肝细胞生长因子(hepatocyte growth factor,HGF)和胰岛素样生长因子(IGF-1)/机械生长因子(MGF)[37]。
2.1 HGF诱导的卫星细胞激活
抗阻训练可使骨骼肌分泌出HGF,并且其分泌受到释放到组织的一氧化氮的影响[37,38],体外实验研究表明,HGF可刺激卫星细胞活化并且导致其分化[39]。HGF与卫星细胞表面相应受体结合受体可使卫星细胞募集一系列调节蛋白,如Grb1/Grb2、SHC、Crk等,这些调节蛋白激活下游信号传导通路,使卫星细胞分化进行有丝分裂,在复制自己的同时,产生一条新的肌纤维,从而促进肌肉肥大。
2.2 IGF-1/MGF诱导的卫星细胞激活
抗阻运动可使MGF表达升高,MGF的生理功能在于增加肌肉或修复肌肉,而它的这种功能是通过激活卫星细胞来介导的,Hill等[40]研究了肌肉损伤后MGF 表达、卫星细胞数量与卫星细胞激活的标志物M2cad、MyoD 基因表达变化的时间曲线,结果表明在肌肉损伤大约1h之后便出现了MGF mRNA表达峰,随后立即出现卫星细胞激活标志物MyoD、M2cad mRNA的峰值,而IGF-IEa表达峰值在一周后才出现,说明MGF与肌肉损伤后卫星细胞激活有关。肌纤维生长或损伤修复过程中卫星细胞的激活需要MGF的刺激作用,如MGF表达不足就会影响卫星细胞的激活,从而导致肌肉萎缩及功能缺失。抗阻训练可使骨骼肌细胞产生两种IGF-1亚型,即IGF-1Ea和MGF。为了测定IGF-I 不同剪接的两种异构体的生物学功能,采用肌肉注射的方法,把含有MGF cDNA 的表达载体注入到肌纤维内,结果发现2周内肌肉质量增加了20%,采用肌肉冷冻切片测量肌纤维的横截面积发现增加25%,而肌肉体积的增加只有被注射的肌肉而非全部的肌纤维,同时肌肉力量也有类似程度的增加[41]。而另外一些类似实验表明,注射IGF-IEa cDNA后肌肉质量也增加了约20%,但是这是在注射4个月后才出现的结果[42]。这表明MGF促肌肉肥大的效果要显著高于IGF-IEa,说明抗阻运动诱导MGF表达升高引起的骨骼肌肥大机制与IGFIEa是不同的。作用于卫星细胞上的IGF-I也是通过其促进蛋白质合成的通路发挥作用的,而MGF在抗阻训练后的肌肉修复和增长中起了双重作用,一方面它激活了卫星细胞,另一方面也合成了肌肉修复所需要的蛋白质,这可能就是为什么其修复和使肌肉组织增长的效力高于IGF-I的原因。
3 结语与展望
综上所述,抗阻训练诱导骨骼肌肥大涉及多条信号传导通路,各条通路间又有着千丝万缕的联系,正是各条信号通路复杂的交叉联系使骨骼肌细胞能在训练后产生适应性肥大,但不同抗阻训练方式是否对各条信号通路具有特异性还有待研究,以及由各条信号通路中发生的磷酸化/去磷酸化作用联想到是否还有其它的细胞分子激活方式如甲基化、氨基化、巯基化、遍在蛋白化作用等。虽然近年来这方面研究取得了很大的成就,但是抗阻训练诱导的骨骼肌肥大的精细机制还有待实验的进一步研究与证实。
[1]邓树勋,王健,乔德才.运动生理学.北京:高等教育出版社,2005. 309.
[2]Miller BF,Olesen JL,Hansen M,et al. Coordinated collagen and muscle protein synthesis in human patella tendon and quadriceps muscle after exercise. J Physiol,2005,567(Pt3):1021-1033.
[3]Glass DJ. Skeletal muscle hypertrophy and atrophy signaling pathways. Int J Biochem Cell Biol,2005,37(10):1974-1984.
[4]Stewart CE,Rotwein PI. Insulin-like growth factor-II is an autocrine survival factor for differentiating myoblasts.J Biol Chem,1996,271(19):11330-113381.
[5]McKoy G,Ashley W,Mander J,et al. Expression of insulin growth factor-I splice variants and structural genes in rabbit skeletal muscle induced by stretch and stimulation. J Physiol,1999,516(2):583-592.
[6]Chan TO,Rittenhouse SE,Tsichlis PN. Phosphoinositide 3-kinase signalling – which way to target? Trends Pharmacol Sci,2003,24:366-376.
[7]Hanada M,Feng J,Hemmings BA. Structure,regulation and function of PKB/ AKT: a major therapeutic target. Biochem Biophys Acta,2004,1697(12):3-16.
[8]Anderson KE,Coadwell J,Stephens LR,et al. Translocation of PDK-1 to the plasma membrane is important in allowing PDK-1 to activate protein kinase B. Curr.Biol,1998,8 : 684-691.
[9]Frech M,Andjelkovic M,Ingley E,et al. High affinity binding of inositol phosphates and phosphoinositides to the Pleckstrin homology domain of RAC protein kinase B and their influence on kinase activity. J Biol Chem,1997,272:8474-8481.
[10]Sarbassov DD,Guertin DA,Ali SM,et al. Phosphorylation and regulation of Akt/ PKB by the rictor - mTOR complex. Science,2005,307(5712):1098-1101.
[11]Hall MN. mTOR-what does it do? Transplantation Proceedings,2008,40:S5-S8.
[12]Fingar DC,Blenis J. Target of rapamycin(TOR):an integrator of nutrient and growth factor signals and coordinator of cell growth and cell cycle progression. Oncogene,2004,23 : 3151-3171.
[13]Bodine SC. mTOR signaling and the molecular adaptation to resistance exercise . Med Sci Sports Exerc,2006,38(11):1950-1957.
[14]Ciaraldi TP,Carter L,Mudaliar S,et al. GSK-3β and control of glucose metabolism and insulin action in human skeletal muscle. Mol Cell Endocrinol,2010,315 :153-158.
[15]Doble BW,Woodgtt JR. GSK-3: tricks of the trade for a multi-tasking kinase. Cell Sci,2003,116 :1175-1186.
[16]Hoeflich KP,Luo J,Rubie EA,et al. Requirement for glycogen synthase kinase 3-β in cell survival and NF-kappaB activation. Nature,2000,406:86-90.
[17]MacAulay K,Doble BW,Patel S,et al. Glycogen synthase kinase 3-specific regulation of murine hepatic glycogen metabolism. Cell Metab,2007,6:329-337.
[18]Ciarald TP,Nikoulina SE,Bandukwal RA,et al. Role of GSK3 in insulin action in cultured human skeletal muscle cells. Endocrinology,2007,148:4393-4399.
[19]Kubica N,Bolster DR,Farrell PA,et al. Resistance exercise increases muscle protein synthesis and translation of eukaryotic initiation factor 2Bepsilon mRNA in a mammalian target of rapamycin - dependent manner. J Biol Chem,2005,280(9):7570-7580.
[20]Mascher H,Tannerstedt J,Brink-Elfegoun T,et al.Repeated resistance exercise training induces different changes in mRNA expression of MAFbx and MuRF-1 in human skeletal muscle. Am J Physiol Endocrinol Metab,2008,294(1):E43-51.
[21]Coffey VG,Zhong Z,Shield A,et al. Early signaling response to divergent exercise stimuli in skeletal muscle from well-trained human. FASEB,2006,20:190-192.
[22]Dunn SE,Burn JL,Michel RN. Calcineurin is required for skeletal muscle hypertrophy. J Biol Chem,1999,274:21908-21912.
[23]Robert A,Schulza,Katherine EY. Calcineurin signaling and NFAT activation in cardiovascular and skeletal muscle development. Developmental Biology,2004,266:1-16.
[24]Abbott KL,Friday BB,Thaloor D,et al. Activation and cellular localization of the cyclosporine A-sensitive transcription factor NFAT in skeletal muscle cells. Mol Biol Cell,1998,9 :2905-2916.
[25]Mcpherron AC,Lawler AM,Lee SJ. Regulation of skeletal muscle mass in mice by a new TGF-β super family member. Nature,1997,387(6628):83-90.
[26]郭丽,王天云,王俐,等.半定量反转录—聚合酶链反应分析大鼠不同组织肌肉生长抑制素基因的表达.中国组织工程研究与临床康复,2008,2(11):2164-2166.
[27]Stephen MR,Gregory FM,Robert EF,et al. Myostatin gene expression is reduced in human with heavyresistance strength training:a brief communention. Exp Biol Med,2003,228(6):706-709.
[28]Xiangyang Z,Stavros T,Li-fang L,et al. Myostatin signaling through Smad2,Smad3 and Smad4 is regulated by the inhibitory Smad7 by a negative feedback mechanism. Cytokine,2004,26:262-272.
[29]Nishi M,Yasue A,Nishimatu S,et al. A missense mutant myostatin causes hyperplasia without hypertrophy in the mouse muscle. Biochem Biophys Res Commun,2002,293:247-251.
[30]Sandri M,Sandri C,Gilbert A,et al. Foxo transcription factors induce the atrophy related ubiquitin ligase atrogin-1 and cause skeletal muscle atrophy. Cell,2004,117:399-412.
[31]Stitt TN,Drujan D,Clarke BA,et al. The IGF-1/PI3K/Akt pathway prevents expression of muscle atrophy-induced ubiquitin ligases by inhibiting FOXO transcription factors. Mol Cell,2004,14 :395-403.
[32]Latres E,Amini AR,Amini AA,et al. IGF-1 inversely regulates atrophy-induced genes via the PI3K/Akt/mTOR pathway. J Biol Chem,2005,280:2737–2744.
[33]Favier FB,Benoit H,Freyssenet D. Cellular and molecular events controlling skeletal muscle mass in response to altered use. Pflugers Arch,2008,456(3):587-600.
[34]Gilson H,Schakman O,Combaret L,et al. Myostatin gene deletion prevents glucocorticoid-induced muscle atrophy. Endocrinology,2007,148:452-460.
[35]McFarlane C,Plummer E,Thomas M,et al. Myostatin induces cachexia by activating the ubiquitin proteolytic system through an NF-kappaB-independent,FoxO1-dependent mechanism. J Cell Physiol,2006,209 :501-514.
[36]Durieux AC,Amirouche A,Banzet S,et al. Ectopic expression of myostatin induces atrophy of adult skeletal muscle by decreasing muscle gene expression. Endocrinology,2007,148:3140-3147.
[37]Tatsumi R,Liu X,Pulido A,et al. Satellite cell activation in stretched skeletal muscle and the role of nitric oxide and hepatocyte growth factor. Am J Physiol Cell Physiol,2006,290 :C1487-C1494.
[38]Wozniak AC,Anderson JE. Nitric oxide-dependence of satellite stem cell activation and quiescence on normal skeletal muscle fibers. Dev Dyn,2007,236:240-250.
[39]Sheehan SM,Tatsumi R,Temm-Grove CJ,et al. HGF is an autocrine growth factor for skeletal muscle satellite cells in vitro. Muscle Nerve,2000,23:239-245.
[40]Hill M,Goldspink G. Expression and splicing of the insulin like growth factor gene in rodent muscle is associated with muscle satellite(stem)cell activation following local tissue damage. J Physiol,2003,549(2):409-418.
[41]Goldspink G. Impairment of IGF-I gene splicing and MGF expression associated with muscle wasting . Int J Biochem Cell Biol,2006,38(3):481-489.
[42]Musaro A,McCullagh K,Paul A,et al. Localized IGF-I transgene expression sustains hypertrophy and regeneration in senescent skeletal muscle. Nat Genet,2001,27(2):195-200.
