Aβ25-35致PC12细胞凋亡和线粒体跨膜电位损伤关系研究*
2011-05-07张红刘剑秦大莲章卓
张红 刘剑 秦大莲,2 章卓,2△
(1.泸州医学院药学院药理教研室,四川 泸州 646000;2.药品与功能食品研究中心,四川 泸州 646000)
随着老龄社会的到来,阿尔茨海默病(Alzheimer disease,AD)患者越来越多。AD为慢性进行性神经变性疾病,以认知功能和记忆损害、日常生活能力进行性下降、神经心理症状和精神行为异常为主要特征。由于其涉及机制复杂,目前尚无有效手段治疗。β-淀粉样蛋白异常沉积、细胞凋亡在AD的发病中起着重要作用,β-淀粉样蛋白(β-amyloid protein,Aβ)由 39-43个氨基酸组成,相对分子质量约为(4.0-4.2)×103,聚集态的Aβ25-35可以导致神经细胞凋亡,损伤神经细胞[1]。目前各实验室对Aβ25-35致PC12细胞凋亡的最适浓度与最适时间各有不同,对Aβ25-35致 PC12细胞凋亡原因是否与改变线粒体跨膜电位有关也未见研究,据此本研究通过采用不同浓度的Aβ25-35在不同时间诱导PC细胞凋亡,确定Aβ25-35诱导PC细胞凋亡的最适浓度和最佳时间,并进一步分析其凋亡和线粒体跨膜电位(M TP)改变间关系,为建立阿尔茨海默病细胞模型,进一步阐明阿尔茨海默病的分子机制奠定基础。
1 材料与方法
1.1 材料
Aβ25-35(北京奥普森有限公司);PC12细胞(购自武汉大学CCTCC细胞库);Annexin V-FITC细胞凋亡检测试剂盒(Keygen公司,批号 20101202);Hoechst 33342以及 PI(Sigma,USA);DM EM/F12培养基,胎牛血清,马血清(天津灏洋生物制品科技责任有限公司);CCK-8试剂盒(碧云天生物技术研究所)。
1.2 仪器
倒置相差显微镜(日本Olympus公司,CKX41型);CO2培养箱(日本Sanyo公司,M CO-15AC型);超净工作台(苏州净化设备有限公司,SW-CJ-1F型);离心机(北京医用离心机厂,LG10-3A型);电子天平(上海民桥精密科学仪器有限公司,FA1104N型);超低温冰箱(日本Sanyo公司,MDF-192型);高压消毒锅(上海申安医疗器械厂,LDZX-40BI型);酶标分析仪(北京普朗新技术有限公司,DNM-9602型);优普超纯水机(成都超纯科技有限公司,UPH-IV-10T型);激光共聚焦扫描显微镜(德国LEICA公司,TCS SP5型)。流式细胞仪(美国 BD公司,SBK-YLQX-003552型)。
1.3 Aβ25-35配制方法
将 Aβ25-35溶于超净水,配成16000μmol◦ L-1母液分装,-20℃冻存,使用前于37℃孵育 1 w,使其变为聚集状态。
1.4 PC12细胞培养及分组
PC-12细胞株完全培养液为 DM EM+5%胎牛血清+10%马血清+青链霉素,培养瓶多聚赖氨酸铺底,5%CO237℃培养箱中培养。每3~4 d传代1次。倒置显微镜观察细胞生长情况。分组:①阴性组:不加任何处理因素。②实验组:Aβ25-35按160,80,40,20,10,5,2.5μ mol◦L-17个浓度进行处理,处理时间按6,12,24 h进行设计。
1.5 CCK-8法检测细胞活性
取对数生长期的PC12细胞,0.25%胰酶制成单个细胞悬液,细胞浓度为1×105◦L-1接种于 96孔板,每孔90 μ l,培养24 h待其贴壁后加药。每孔加Aβ25-3510 μ l,每个浓度 4个复孔,Aβ25-35 终浓度分别为 160,80,40,20,10,5,2.5μmol◦L-1,阴性组加等体积无血清 RPMI 1640,继续培养6,12,24 h后,每孔加入CCK-810μ l继续培养1 h,酶标仪450 nm波长下检测各孔吸光度值,以OD值反应细胞活力情况。
1.6 Annexin V-FITC流式细胞仪检测PC12细胞凋亡
PC12细胞培养和处理同1.5。消化收集细胞,用冷PBS洗两次,将细胞悬浮于AnnexinV混合缓冲液中(1×106◦ml-1),取 100 μ l细 胞 悬液 至 EP 管 中,加 5 μ l Armexin-FITC和5 μ l PI,轻轻振摇细胞,室温下于暗处放置15min,1 h内用流式细胞仪分析。
1.7 Hochest33342/PI双染检测PC12细胞凋亡
PC12细胞培养和处理同1.5。收集细胞悬浮于1mL培养基中,加入 10 μ l Hochest 33342储存液(100 mg◦ L-1,蒸馏水溶解),染色15min;将细胞置于冰上冷却后,离心,去上清,将细胞重悬于 1ml PBS中,加人5 μ l PI储存液(1 g◦L-1,蒸馏水溶解),混匀,荧光显微镜观察。
1.8 罗丹明染色检测线粒体跨膜电位
将不同处理后的 PC12细胞用 0.25%胰酶消化,收集1×l06个细胞,经 PBS 清洗 2 次,与 1μmol◦L-1Rh123 在37℃共同孵育30min,PBS清洗2次,荧光显微镜下观察。
1.9 统计学处理
2 结果
2.1 不同浓度Aβ25-35在不同处理时间对 PC12细胞活力影响
同阴性对照组比较,Aβ25-35处理 6 h仅 160,80μmol◦L-12个浓度组有差异,Aβ25-35处理 12 h和 24 h,Aβ25-3520μ mol◦L-1以 上 组 均 有 统 计 学 意 义 (P<0.05),10μ mol◦L-1以下组处理 6,12,24 h后均无统计学意义(P>0.05),见图 1。
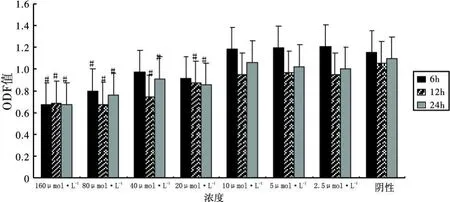
图1 A β25-35不同浓度和不同处理时间对PC 12细胞活力影响
2.2 不同浓度Aβ25-35诱导PC12细胞12 h后凋亡率的变化
将流式细胞检测的早期凋亡率与晚期凋亡率相加得到凋亡率。结果显示,与阴性组比较,Aβ25-3520μmol◦L-1以上组均有统计学意义(P<0.05),但 160,80μmol◦L-1晚期凋亡较多,见图 2。

图2 不同浓度 A β25-35刺激PC 12细胞12 h后凋亡率影响
2.3 不同浓度Aβ25-35诱导PC12细胞12 h后细胞形态变化
Hochest 33342/PI双染显示,阴性对照组细胞形态呈圆形,淡蓝色,无凋亡细胞。Aβ25-3520μmol◦ L-1以上组细胞部分呈凋亡特征性改变,细胞核呈亮蓝色染色,凋亡细胞较多。还可见死亡细胞(红色),160,80μmol◦L-1组死亡细胞多于其他各组,见图3。

图3 不同浓度A β25-35刺激PC 12细胞12 h后凋亡影响
2.5 对线粒体跨膜电位影响
荧光显微镜结果显示,Aβ25-3520μmol◦L-1以上组细胞荧光较强,线粒体跨膜电位降低。提示 Aβ25-3520μmol◦L-1以上浓度可降低PC12细胞线粒体跨膜电位,与凋亡程度呈正相关,见图4。

图4 不同浓度 A β25-35刺激12 h对PC 12细胞线粒体跨膜电位影响
3 讨论
Aβ25-35具有与Aβ全长片段相同的功能,研究显示聚集态的Aβ25-35对神经细胞具有毒性作用,此作用可能与激活细胞外磷脂激酶A2依赖的信号调节途径刺激ROS产物的生成损伤细胞器和细胞骨架有关;还可能通过影响 PI3K/Akt、JNK-CJun-FasL-Fas等信号通路导致细胞损伤[2]。
线粒体内膜两侧电子的不对称分布造成线粒体跨膜电位(△ψm)。正常生理情况下,线粒体内膜通透性很低,仅允许不带电荷的小分子物质通过,对离子(包括质子)几乎不能透过内膜,某些大分子和离子要通过选择性通道或转运蛋白才能通过内膜。内膜的低通透性是维持电化学质子梯度、进行氧化磷酸化的结构基础。线粒体通透性转换孔(Mitochondrialpermeability transition pore,MPTP)开放致线粒体内膜通透性改变(Permeability transition,PT),线粒体内膜允许分子量115kDa的分子自由通过[3]。在细胞凋亡早期,线粒体外膜对蛋白质的通透性增高,线粒体内膜的跨膜潜能降低。当线粒体膜内外的电势差减少时.线粒体膜电位降低,可引起线粒体膜内外一系列的生化改变,如释放具有调控能量代谢和细胞凋亡双重功能的Bcl-2家族及Caspase活化等,引起细胞凋亡的级联反应.最终导致细胞凋亡[4]。罗丹明123(Rhodamine 123)是一种可透过细胞膜的阳离子荧光染料,其在正常细胞中能够依赖线粒体跨膜电位进入线粒体基质,荧光强度减弱或消失。而在凋亡发生时,线粒体膜完整性破坏,线粒体膜通透性转运孔开放,引起线粒体跨膜电位(ΔΨm)的崩溃,Rh123重新释放出线粒体,从而发出强黄绿色荧光。本实验选择罗丹明染色后荧光显微镜检测线粒体跨膜电位。
PC12细胞为大鼠肾上腺髓质嗜铬细胞克隆化的细胞株,具有典型的神经内分泌细胞的特性,它广泛应用于研究神经细胞分化、神经毒性等试验。因此不少实验室通过Aβ25-35刺激PC12细胞导致神经细胞凋亡建立阿尔茨海默病细胞模型,但目前各实验室对Aβ25-35致PC12细胞凋亡的最适浓度与最适时间各有不同[5],对Aβ25-35致PC12细胞凋亡原因是否与改变线粒体跨膜电位有关也未见研究,据此本实验室通过采用160,80,40,20,10,5,2.5μ mol◦L-17个浓度的Aβ25-35在6,12,24h诱导PC细胞凋亡,确定Aβ25-35诱导PC细胞凋亡的最适浓度和最佳时间,并进一步分析其凋亡和线粒体跨膜电位改变间关系。实验结果显示,同正常组比较,Aβ25-3520μ mol◦L-1以上浓度组刺激12 h即可出现细胞活力明显下降,凋亡率明显增加(P<0.05),但160,80μmol◦L-1晚期凋亡较多。荧光显微镜显示细胞有核浓缩和凋亡小体的产生,甚至出现死亡现象,160,80μmol◦L-1组死亡细胞多于其他各组。线粒体跨膜电位降低,与凋亡程度呈正相关。20μmol◦L-1以下各浓度组对PC12细胞活力、细胞凋亡率、线粒体跨膜电位无明显影响(P>0.05)。
因此本实验综合凋亡结果、经济性、时间等多种因素认为,20μ mol◦L-1刺激12 h即可得到理想的 PC12细胞凋亡模型,既省钱又省时,为建立阿尔茨海默病细胞模型,进一步阐明阿尔茨海默病的分子机制奠定基础。
1 孙治坤,潘静,杨红旗,等.PI3K/Akt途径在Aβ25-35诱导细胞凋亡过程中的作用[J].中国病理生理杂志,2009,25(1):84-88.
2 Morishima Y,Gotoh Y,Zieg J,et al.Beta-amyloid induces neuronal apoptosis via a mechanism that involves the c-J un N-terminal dinase pathway and the induction of Fas Ligand[J].J Neuosci,2001,21(19):7551-7560.
3 Zarbock A,Schmolke M,Spieker T,et al.Acute uremia but not renal inflammation attenuates aseptic acute lung injury:A critical role for uremic neutrophils[J].J Am Soc Nephrol,2006,17(11):3124-3131.
4 Bemardi P,Scorrano L,Colonna R,et al.Mitochondria and cell death.Mechanistic aspects and methodological issues[J].Eur J Biochem,1999,264(3):687-701.
5 王亚利,宋天保,路明,等.Aβ25-35诱导PC-12细胞凋亡建立阿尔茨海默病细胞模型[J].西安医科大学学报,2002,23(2):129-132.
