莱芜猪GPx4基因在不同组织中的表达规律研究
2011-05-02杜金芳崔景香陈其美胡艳霞曾勇庆
陈 伟,杜金芳,崔景香,陈其美,胡艳霞,杨 伦,曾勇庆
(山东农业大学动物科技学院,山东泰安 271018)
磷脂氢谷胱甘肽过氧化物酶(Phospholipid hydroperoxide glutathione peroxidase,GPx4)是哺乳动物体内广泛分布的多功能硒蛋白[1],不但参与细胞内抗氧化反应,保护生物膜系统免受氧化损伤[2],而且还在细胞凋亡中起作用[3]。人(GenBank登录号:NM_002085)、褐家鼠(GenBank登录号:NM_017165)、猪(GenBank登录号:NM_214407)等物种的GPx4基因的cDNA已被克隆出来。在不同的物种中GPx4基因结构有所不同,猪GPx4基因的DNA序列包括7个外显子,6个内含子。并且该基因的3′-UTR可以形成颈环结构,5′-UT R和第1内含子中含有参与激素调控的多种元件[4]。目前,对于GPx4基因表达规律的研究主要集中在灵长类动物[5],结果表明,GPx4基因是在组织特异调控下表达的。
莱芜猪是我国优良地方猪种黄淮海黑猪的一个类群,研究表明莱芜猪不但具有肉味香浓、肉质细嫩、系水力强等优良种质特性[6,7],而且还具有良好的抗氧化能力,如肌肉SOD活性显著高于大白猪[6]。已有的研究结果表明:肌肉中GPx4基因的表达量在很大程度上影响猪肉品质的系水力和抗氧化能力[8]。本研究拟从mRNA水平,研究GPx4基因在莱芜猪不同组织中的表达差异,为进一步探索GPx4基因的遗传效应和肉质调控机制奠定基础,希望能够为揭示GPx4基因在地方猪种中的表达特性,以及GPx4对猪抗氧化性能的影响提供科学依据。
1 材料与方法
1.1 实验动物
莱芜猪去势成年公猪5头,平均体重100±5 kg,由莱芜市畜牧兽医局提供。颈静脉放血致死,取脑、心、肝、脾、肺、背最长肌、背膘、大肠、小肠和脊髓 10种组织,立即放入 DEPC水处理过的 EP管,并迅速置于液氮中保存,实验室-70℃保存。
1.2 实验方法
1.2.1 总 RNA的提取 按照 TRIZOL?Reagent试剂盒操作说明分别提取5头猪不同组织的总RNA。用DNase I(Fermentas)处理总RNA,去除基因组污染。紫外分光光度计测定总RNA的浓度,调整浓度至1 μ g/μ L,并用1%琼脂糖胶电泳检测总RNA的完整性。提取的各组织的总RNA于-70℃保存。
1.2.2 引物设计与合成 参考GenBank上公布的猪GPx4(NM_214407)的mRNA序列,利用Primer 5.0软件设计引物,正向、反向引物位于不同的外显子中以消除基因组DNA对RT-PCR的影响。内参基因β-actin的引物序列参照McBryan等[9]人所公布的序列。两对引物均由生工生物工程(上海)有限公司合成,引物详细信息见表1。

表1 引物序列Table 1 Primer sequences
1.2.3 cDNA合成
反转录在20 μ L体系中进行:500 ng引物Oligo-d(T)18和0.5 μ L dNT Ps(2.5 mmol/L)的混合物65℃反应 5 min,冰上冷却至少 1 min,再加5μ L DT T(0.1 mol/L),4 μ L 5×First-Strand Buffer,40 U RNA酶抑制剂(Promega公司)和200 U反转录酶(Invitrogen公司),50℃孵育60 min;产物cDNA-20℃保存备用。用无反转录酶对照进行检测基因组污染。cDNA用水1:20稀释后用于荧光定量PCR反应。
1.2.4 RT-PCR检测
以莱芜猪不同组织 cDNA为模板,25 μ L反应体系:10×PCR Buffer 2.5 μ L,dNTP Mixture(2.5 mmol/L)2 μ L,Mg2+(25 mmol/L)1.5 μ L,正反向引物 (10 μ mol/L)各 0.5 μ L,rTaq DNA 聚合酶 (5 U/μ L)0.5 μ L,cDNA 模板1 μ L,ddH2O 16.5 μ L,反应程序:94℃5 min;94℃30 s,58℃30 s,72 ℃30 s,35个循环;72℃10 min,产物经1.5%琼脂糖凝胶电泳检测。
1.2.5 实时荧光定量PCR检测 标准曲线的绘制:从每种组织的cDNA中各取10 μ L进行混池,倍比稀释8个梯度,在Mx3000PTM(Stratagene,USA)仪器中进行荧光定量反应,获得标准曲线、扩增曲线和熔解曲线,分析所得结果。
实时荧光定量PCR检测:根据SYBR Permix Ex TaqTM(TaKaRa公司)试剂盒建议的反应条件构建15 μ L 反应体系 :SYBR Permix Ex TaqTM7.5 μ L,ROX Reference Dye II 0.3 μ L,上下游引物 (10 μ mol/L)各0.3 μ L,cDNA 模板 5 μ L,ddH2O 补至总体积15 μ L。反应程序:95℃ 15 s;95℃ 10 s,58℃20 s,72℃20 s,40个循环;95℃1 min,60℃30 s,95℃30 s,1个循环。同时,每个样本设无模板对照。定量循环数(Quantification cycle,Cq)小于35时可以被用于计算相对表达量,每个样本重复3次,取其平均值计算定量结果。
1.3 统计分析
利用2-ΔΔCT方法计算各组织中GPx4基因的相对表达量[10]。试验数据采用SAS(9.2)软件的GLM程序进行方差分析,各组织中GPx4表达量差异的显著水平为P<0.05。
2 结果与分析
2.1 RT-PCR检测
从各种组织提取的总RNA通过核酸紫外分光光度计检测其浓度,结果各组织样本的A260/A280均介于1.8~2.0之间。1%琼脂糖凝胶电泳检测结果:28S、18S条带清晰,达到反转录要求。反转录后,以各组织的cDNA为模板进行GPx4基因的RT-PCR反应,PCR产物经1.5%琼脂糖凝胶电泳检测,10种组织均检测到扩增产物(图1)。结果表明10种组织的cDNA均可用于实时荧光定量PCR检测。
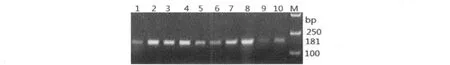
图1 莱芜猪不同组织中GPx4基因检测Fig.1 PCR products of GPx4 gene from different tissues of Laiwu pigs
2.2 标准曲线的建立
内参基因β-actin、目的基因GPx4的荧光定量PCR反应标准曲线分别见图2-A、B。由图2可知,各点分别代表β-actin、GPx4基因的混池cDNA在8个浓度梯度扩增的拷贝数,荧光定量标准曲线的回归系数R2在0.99以上,扩增效率在95%~105%之间,说明结果具有很好的可靠性。

图2 β-actin(A)、GPx4(B)基因的标准曲线Fig.2 Standard curves of β-actin(A)and GPx4(B)gene
图3为β-actin、GPx4基因的实时荧光定量PCR扩增曲线和熔解曲线。从扩增动力学曲线可以看出,目的基因(图3-A)和内参基因(图3-B)平行性较好,拐点清楚,基线平稳;而且β-actin、GPx4基因的熔解曲线(图3-C)符合基因熔解标准,荧光定量PCR产物只有1个峰,说明该PCR反应是特异性的,无引物二聚体及非特异性扩增,满足实验要求。

图3 GPx4、β-actin基因的扩增曲线和熔解曲线Fig.3 Amplification plots,dissociation curves for β-actin and GPx4 gene
2.3 不同组织中GPx4基因的相对表达量
莱芜猪GPx4基因在不同组织中的相对表达量见图4。经内参基因β-actin对莱芜猪不同组织GPx4表达量的校正,GPx4基因在莱芜猪脑、心、肝、脾中mRNA表达水平极显著高于其他组织(P<0.01)。其中,在肌肉中的表达量显著高于脊髓、大肠、背膘和小肠的表达量(P<0.05);在肺中的相对表达量最低,差异显著(P<0.05)。综上,GPx4在莱芜猪10种组织中表达量差异变化明显趋势为:脑、心、肝、脾>肌肉>脊髓、大肠、背膘、小肠>肺。
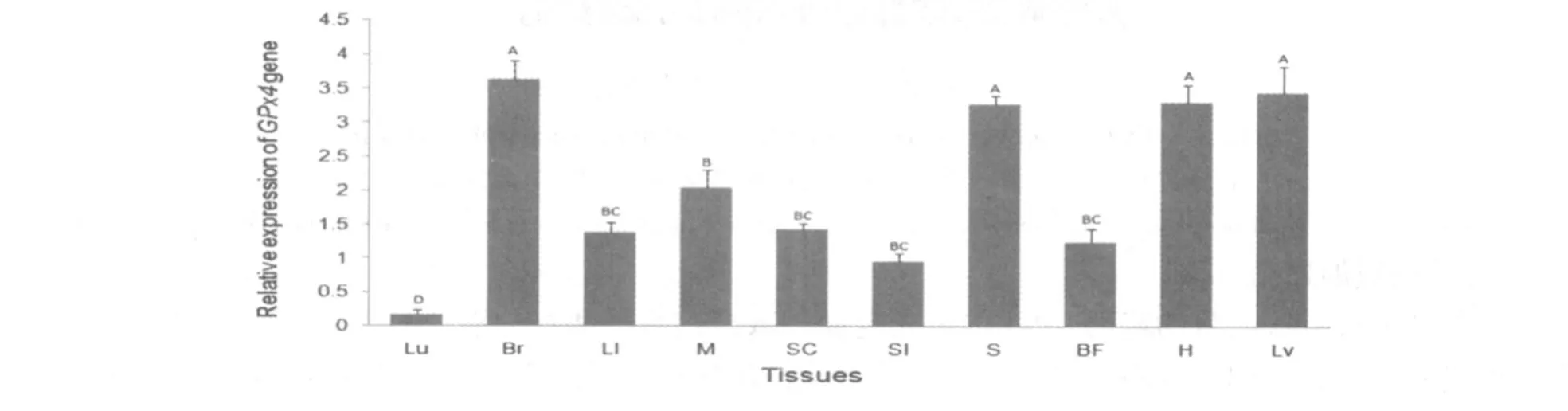
图4 莱芜猪不同组织中GPx4基因的相对表达量Fig.4 Relative expression levels of GPx4 gene in different tissues of Laiwu pigs
3 讨论
需氧生物在氧化循环过程中会产生大量超氧阴离子自由基、过氧化氢等活性氧。过多的自由基将导致一系列氧化损伤,如DNA损伤、脂质氧化等[11]。生物体在长期的进化过程中,形成了一套完整的抗氧化防御体系:非酶类和酶类抗氧化系统。其中,酶类抗氧化剂主要包括超氧化物歧化酶(SOD),过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPx)。
GPx家族中的GPx4是机体内酶类抗氧化系统中的重要成员,在不同组织还发挥重要的抗氧化功能。GPx4由Ursini及其合作者在1982年首次从猪肝脏中分离纯化得到[12],并在1985年描述为“过氧化物抑制蛋白”[13]。GPx4是分子量在20~22 kDa的单体蛋白,不同于GPx家族其他成员的四聚体结构[1]。GPx4是哺乳动物细胞中唯一能直接还原生物膜上的磷脂氢过氧化物,保护生物膜免受氧化应激损伤[14]。Lei等人报道,GPx4在大鼠睾丸内活性最高,是肝脏的15倍,是心脏和肺脏的25倍[15]。
Fukuhara等人研究灵长类动物的谷胱甘肽同工酶时发现:GPx4 mRNA在精巢中高丰度表达,在其他组织(如心、肺等)中表达量较少[5]。在其他动物不同组织中GPx4 mRNA的表达规律基本一致,如小鼠、山羊的GPx4 mRNA在不同组织中的表达规律为:心、脑、肝>肺>背最长肌[16,17]。本研究中莱芜猪GPx4 mRNA在不同组织中的表达趋势与上述规律基本一致。心、脑对氧化应激敏感,因此,GPx4 mRNA的高丰度表达可能对保护心脏和大脑组织免受氧化应激损伤起重要作用。背膘组织中高浓度的多不饱和脂肪酸容易引起脂质氧化,所以在背膘组织中GPx4 mRNA的相对高丰度表达起到更好的抗氧化作用。我们的研究结果提示:GPx4基因在莱芜猪不同组织中广泛分布,但是表达量差异很大;猪GPx4基因在不同组织中参与调控抗氧化方面发挥重要作用,造成这种差异表达的原因还需要更深入的研究以阐明这种机制。
4 结论
本研究采用荧光定量PCR技术检测GPx4基因mRNA在莱芜猪不同组织中的表达规律,结果表明:GPx4 mRNA在心、脑等易暴露于ROS和自由基造成氧化应激环境的组织中高丰度表达,并且显著高于肌肉、脊髓、大肠、背膘、小肠等其它组织中GPx4 mRNA的表达量。在所检测的10种组织中,肺中的GPx4 mRNA表达量最低。
[1] Arthur JR.The glutathione peroxidases[J].Cellular and Molecular Life Sciences,2000,57(13):1825-1835
[2] Conrad M,Schneider M,Seiler A,et al.Physiological role of phospholipid hydroperoxide glutathione peroxidase in mammals[J].Biological Chemistry,2007,388(10):1019-1025
[3] Liang H,Remmen HV,Frohlich V,et al.Gpx4 protects mitochondrial ATP generation against oxidative damage[J].Biochemical and Biophysical Research Communications,2007,356(4):893-898
[4] Brigelius-Flohe R,Aumann KD,BlO cker H,et al.Phospholipid-hydroperoxide glutathione peroxidase.Genomic DNA,cDNA,and deduced amino acid sequence[J].Journal of Biological Chemistry,1994,269(10):7342-7348
[5] Fukuhara R,Kageyama T.Structure,gene expression,and evolution of primate glutathione peroxidases[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2005,141(4):428-436
[6] 李 华,曾勇庆,魏述东,等.猪宰后肌肉SOD与MDA的变化及其对肉质特性的影响[J].畜牧兽医学报,2010,41(3):257-261
[7] 曾勇庆,王根林,魏述东,等.含不同比例莱芜猪血缘杂交猪胴体品质及肉质特性的研究[J].遗传,2005,27(1):65-69
[8] Chen W,Zeng Y,Cui J,et al.Effects of phospholipid hydroperoxide glutathione peroxidase mRN A expression on meat quality of M.longissimus dorsi in pigs[J].European Food Research and Technology,2011,232(3):433-440
[9] McBryan J,Hamill RM,Davey G,et al.Identification of suitable reference genes for gene expression analy sis of pork meat quality and analysis of candidate genes associated with the trait drip loss[J].Meat Science,2010,86(2):436-439
[10] Livak KJ,Schmittgen TD.Analy sis of Relative Gene Expression Data Using Real-Time Quantitative PCR and the 2-ΔΔCtMethod[J].Methods,2001,25(4):402-408
[11] Jin LH,Bahn JH,Eum WS,et al.Transduction of human catalase mediated by an HIV-1 TAT protein basic domain and argininerich peptides into mammalian cells[J].Free Radical Biology and Medicine,2001,31(11):1509-1519
[12] Ursini F,Maiorino M,Valente M,et al.Purification from pig liver of a protein which protects liposomes and biomembranes from peroxidative degradation and exhibits glutathione peroxidase activity on phosphatidylcholine hydroperoxides[J].Biochimica et Biophysica Acta(BBA)-Lipids and Lipid Metabolism,1982,710(2):197-211
[13] Ursini F,Maiorino M,Gregolin C.The selenoenzyme phospholipid hydroperoxide glutathione peroxidase[J].Biochimica et Biophysica Acta,1985,839(1):62-70
[14] Imai H,Nakagawa Y.Biological significance of phospholipid hydroperoxide glutathione peroxidase(PHGPx,GPx 4)in mammalian cells[J].Free Radical Biology and Medicine,2003,34(2):145-169
[15] Lei XG,Evenson JK,Thompson KM,et al.Glutathione Peroxidase and Phospholipid Hydroperoxide Glutathione Peroxidase Are Differentially Regulated in Rats by Dietary Selenium[J].Journal of Nutrition,1995,125(6):1438-1446
[16] Baek I-J,Seo D-S,Yon J-M,et al.Tissue expression and cellular localization of phospholipid hydroperoxide glutathione peroxidase(PHGPx)mRNA in male mice[J].Journal of Molecular Histology,2007,38(3):237-244
[17] 施力光,荀文娟,岳文斌,等.山羊PHGPx基因在不同组织中的表达特点及性腺中的定位[J].中国农业科学,2010,43(17):3653-3659
