栽培红花生长期土壤微生物与土壤理化因子动态
2011-04-25刘红玲田中平曾广萍
陆 爽,张 霞,谭 勇,刘红玲,田中平,曾广萍
(1.石河子大学生命科学学院,新疆 石河子 832003;2.石河子大学药学院,新疆 石河子 832003;3.石河子大学师范学院,新疆 石河子 832003)
红花(Carthamustinctorius)为菊科一年生草本双子叶植物,是中国传统大宗中药材,并集染料、油料和饲料为一体的特种经济作物。新疆是典型的大陆性气候区,日照时数长,昼夜温差大,空气湿度小,但属灌溉农业区,水源稳定,能满足红花对水分的需求,十分有利于红花生长[1]。因此,新疆红花种植已占全国红花种植面积及产量的80%,是我国最大的红花产区[2]。近年来,红花球腐病、叶斑病、根腐病、锈病等病害影响红花的生产,导致农民经济效益严重受损,且破坏绿洲生态系统稳定。乔卿梅等[3]研究认为,药用植物连作由于耕作、施肥、灌溉等方式导致土壤理化性质恶化,引起土壤微生物区系组成定向改变和富集,使植物根部病害发生严重。苗则彦等[4]、陆宁海和吴利民[5]也证实,发病植株根际土壤中的真菌和病原菌数量均有所增加,同时病原菌的大量繁殖也会诱导拮抗菌种群和数量的增加,如棉花黄萎病较轻的田块中真菌数量明显低于重病区,而放线菌数量却显著高于重病区[6]。因此认为微生物群落结构改变是造成植物发病的主要原因[7]。
植被与土壤微生物关系密切[8-9],土壤微生物是陆地生态系统平衡的“稳定器”和土壤养分的“转换器”[10],可及时反映土壤养分状况[11-14]。其主要类群直接参与土壤C、N、K等营养元素循环和能量流动[14-15]。土壤微生物指标已被公认为土壤生态系统变化的预警及敏感指标,在农业可持续发展研究中具重要地位[11]。
目前关于植物-土壤微生物的研究主要集中在农作物上,而对于道地药材红花根围土壤微生物的研究相对较少[15],加之植物不同生长期对营养物质及周围环境的需求不同。因此,本研究选取具红花生长发育独特气候资源的新疆生产建设兵团农六师红花主栽区为土壤采集地,对红花不同生长期土壤微生物与相关环境因子动态变化进行监测,并对期间的土壤微生物群落变化规律及主要环境影响因子进行探索,分析适宜红花生长的土壤微环境,为进一步获得红花最佳栽培条件,防止土壤退化及土传病虫害,科学、规范化种植提供理论依据。
1 材料与方法
1.1研究区概况 新疆生产建设兵团农六师红旗农场,位于天山北麓,准噶尔盆地东南缘,地理坐标88°57′06″~89°30′00″ E,44°08′00″~44°22′30″ N,平均海拔560~620 m。农场年平均气温5~8 ℃,年平均气温日较差12.4 ℃,>10 ℃年积温约3 450 ℃·d,年无霜期156 d,年均降水量163.2 mm,属典型大陆性气候。由于农场所处的特殊地理位置和具红花生长发育的独特气候资源,其红花年种植面积达1 500 hm2。农场自1965年建场至2006年,累计种植红花面积4.63万hm2,是新疆红花的主要集中产地之一。
1.2样品的采集与处理 供试样品于2010年5月19日-8月17日分红花生长不同时期(莲座期、伸长期、花期、种子成熟期)进行采集。选取相同田间处理的不同年限(种植1年、种植2年红花地)及临近打瓜地(对照)为代表性采样点,按“S”五点取样法,采用GPS 定位仪定位采样位置。选取5株健壮植株,去除表层覆盖型土壤,在植株主茎10 cm内垂直取0~5、5~10、10~20 cm土样,采用四分法均匀混合后装入无菌封口聚乙烯袋,带回实验室,一份4 ℃冰箱保存,另一份过筛室内阴干,备用。采样点土壤基本状况见表1。
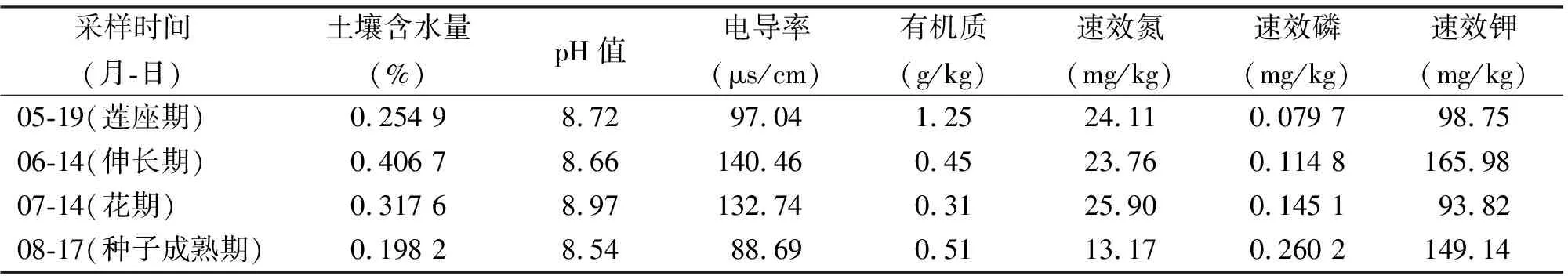
表1 样品采集地概况
1.3微生物数量测定 土壤微生物区系分析采用稀释平板分析法[16]:细菌采用牛肉蛋白胨培养基,以稀释度为10-6的土壤稀释液接种;放线菌采用高氏Ⅰ号琼脂(GA)培养基,以稀释度为10-4的土壤稀释液接种;真菌采用孟加拉红马丁氏琼脂培养基,以稀释度为10-3的土壤稀释液接种,每个样品3个重复。接种后的培养基在恒温下培养若干天后计数,取其平均数作为该样品的微生物数量数据。
1.4土壤理化性质测定 土壤含水量(SM)采用烘干法测定;土壤pH值采用电位测定法测定;有机质(OM)采用重铬酸钾容量法-外加热法测定;速效氮(AN)采用1 mol/L NaOH扩散法测定;速效磷(AP)采用HCl(0.025 mo1/L)-NH4F(0.03 mol/L)浸提,钼锑抗比色法;速效钾(AK)采用1 mol/L NH4OAc浸提-火焰光度法;电导率(EC)总量采用电导法测定[17]。
1.5数据处理
参观巴黎卢浮宫的中国游客或许会疑惑:那些精美绝伦的人体雕塑和旷世画作,会不会是复制品呢?如此多的奇珍异宝,就陈设在游客触手可及的地方,没有管理员看守,允许游客拍照,法国人也太不爱惜这些艺术品了吧?的确,除了三大镇馆之宝之一的《蒙拉丽莎》作了较为明显的隔离外,卢浮宫里的文物大多是以一种开放的姿态展现在世人面前。对于习惯了透过厚厚的玻璃罩观赏文物的我们来说,卢浮宫的这种大方简直令人怀疑其文物的真伪了。
1.5.1主成分分析 红花4个生长期土壤因子主成分分析的重复为9个,包括土壤理化性质和土壤水分等共7个指标,其中土壤理化指标包括0~5、5~10、10~20 cm 土层的速效氮、速效磷、速效钾、有机质、pH值、电导率和土壤含水量,可以反映土壤微环境的肥力状况和土壤质量。这些数据构成一个原始数据矩阵X(7,9),之后利用主成分分析求得4个时期主成分分析的转化矩阵特征根、贡献率和累积贡献率,再计算出各主成分载荷。
1.5.2统计分析 相关分析应用SPSS 17.0,作图采用Origin 7.0和CANOCO软件包进行。
2 结果
2.1红花土壤微生物主要类群的数量季节变化 3种微生物类群在红花不同生长期数量变化复杂(图1)。种植1年、种植2年及对照样地6、7月(红花伸长期、花期)土壤细菌数量呈下降趋势,其中种植2年样地降幅尤其明显,8月(种子成熟期)种植1年、种植2年样地土壤细菌数量明显升高,对照略微降低;种植1年、种植2年及对照样地5、6月(红花莲座期、伸长期)放线菌数目呈增加趋势(P<0.05),而7、8月种植1年及对照样地均呈下降趋势,种植2年放线菌数量显著增加(P<0.05);红花生长期三地真菌数变化趋势相似,均表现为前2个月上升,7月极显著(P<0.01)降低后又呈上升趋势,即:伸长期>莲座期>种子成熟期>花期。此外,5、6月真菌数量为种植1年>种植2年>对照样地,随种植年份增加红花土壤真菌数量呈降低趋势,但7、8月(花期、种子成熟期)趋势却呈现出对照样地>种植2年>种植1年的降低趋势。
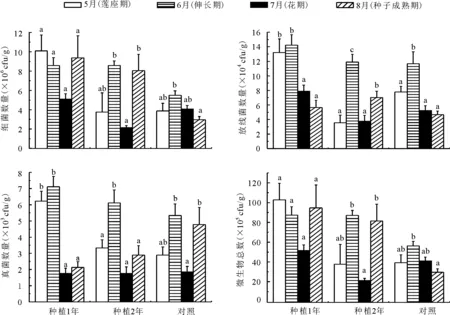
图1 红旗农场红花土壤微生物数量的季节变化
不同种植年份微生物总量大小为:种植1年>种植2年>对照样地,红花生长期微生物总数表现为伸长期>种子成熟期>莲座期>花期。微生物主要类群在种植2年种植样地中均表现为伸长期>种子成熟期>莲座期>花期,说明随种植年限的增加,微生物群落结构趋于稳定,此变化和微生物总数变化趋势一致。
2.2土壤性质主成分分析 主分量分析(principal component analysis,PCA)也叫做主成分分析,它是1954年由Goodall引入植被分析的。PCA是一个完全基于植被结构或组成数据而不需考虑环境梯度、不需选择端点和权重的排序方法[18]。PCA的基本思想就是用较少指标代替和综合反映原来较多的信息,这些综合后的指标就是原来多指标的主要成分[19]。对主成分贡献大的变量其影响程度也大。通常累积贡献率在83%以上时,就可以充分反映相关因子的影响[18]。每个时期前3个主成分累积贡献率分别为83.060%、83.310%、83.310%和86.950%(表2),因此选取的这3个主成分即可反映红花生长期土壤微环境状况。
红花莲座期土壤因子的第一主成分贡献率为39.320%,即为最重要的影响因子。在第一主成分中AP及EC载荷值绝对值较大;第二、三主成分贡献率分别为26.210%和17.520%,其中载荷绝对值较大因子为SM、OM和pH值,表明红花生长初期,日照充足、干旱少雨的红花种植区土壤物理性质较营养物质对红花土壤微生物生长的影响略大。
红花伸长期土壤性质的第一主成分贡献率为43.36%,其中AK、AP、AN载荷值较大(0.287、0.269、0.264),即第一主成分代表了土壤营养;第二主成分(26.82%)中具较高绝对值SM、EC及pH值(0.441、-0.390、0.380)代表了土壤基本理化性质。因此,此时期的营养物质在土壤性质中占主导地位,而待土壤营养元素含量平稳后,土壤理化性质将会成为土壤作用的主要限制因子,可能影响微生物和植物的生长发育。
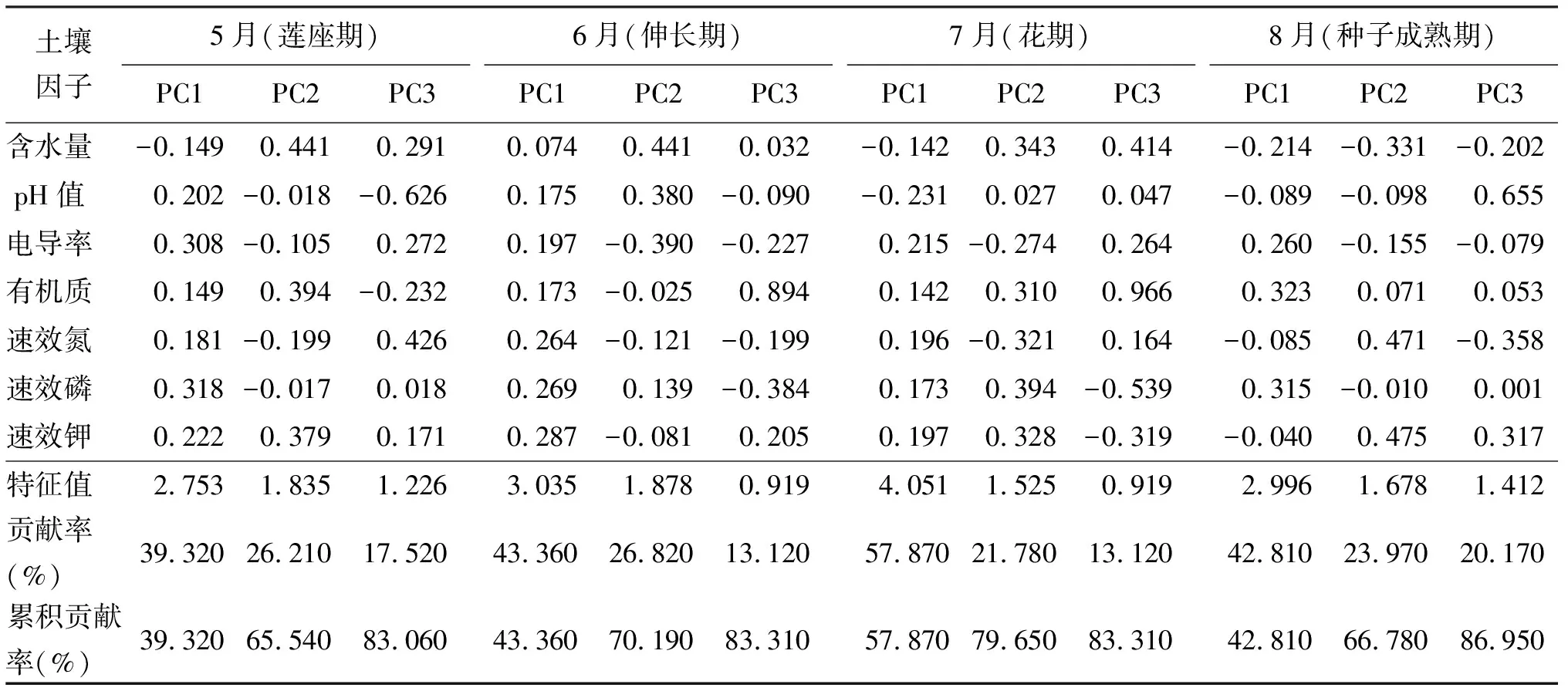
表2 红花生长期土壤因子主成分分析及前3个主成分贡献率和累计贡献率
红花种子成熟期,前3个主成分累计贡献率达86.950%,可以充分反映相关因子的影响。其中以OM为第一主成分主要因子(0.323),AK(0.475)、AN(0.471)为第二主成分主要因子,说明此时期土壤环境以土壤营养物质为主导因素,推测适宜的营养供给可以利土壤环境中的微生物生长、繁殖。
2.3生物数量与环境因子相关性的季节变化 将不同时期土壤因子与微生物3个类群数量在Origin中进行相关、回归分析,得到多组线性回归方程。
红花莲座期(5月)3种微生物主要类群数量与土壤EC及真菌、放线菌数量与AP含量呈显著正相关(P<0.05),这一结果与主成分分析结果一致,即土壤EC和AP对红花根围微生物生长关系密切。细菌与AK达极显著正相关(P<0.01),真菌、放线菌与AP、AK呈显著正相关(P<0.05),说明AP、AK含量较高的土壤可促进真菌、放线菌尤其是细菌生长(表3)。
红花伸长期(6月),细菌与土壤SM、土壤pH值呈显著负相关(P<0.05),结合PCA分析,此时期充足水分和偏高pH值可抑制土壤细菌生长。若为提高红花生长率而添加适量的氮肥、磷肥或钾肥,可能会抑制此时期土壤中细菌的生长。
7月是红花盛开的季节,细菌、真菌与AP呈极显著正相关(P<0.01),与AK呈显著正相关(P<0.05)。说明此时较高浓度的AP和AK对微生物生长具良好的促进作用。
种子成熟期(8月)结果显示,细菌与pH值、放线菌与SM呈显著正相关(P<0.05),放线菌与OM及AP呈显著负相关(P<0.05)。结合PCA分析结果可以看出,OM和AP对红花种子成熟期土壤放线菌生长具明显抑制作用,即较高OM含量不利于放线菌生长。
3 讨论
3.1红花生长期土壤微生物变化趋势 土壤微生物的分布具有一定的季节性,这与有机物的供应、植物生长状况以及温湿度等环境因素有关[20]。季节变化对土壤微生物有影响[21],而也有研究[22]认为季节变化对土壤微生物影响不大。本研究结果显示,土壤微生物数量为伸长期>种子成熟期>莲座期>花期,与张成霞分析结论一致。说明微生物在温度、水分等环境因子适宜条件下,微生物才能在自然界物质循环中充分发挥其分解者的作用[23]。
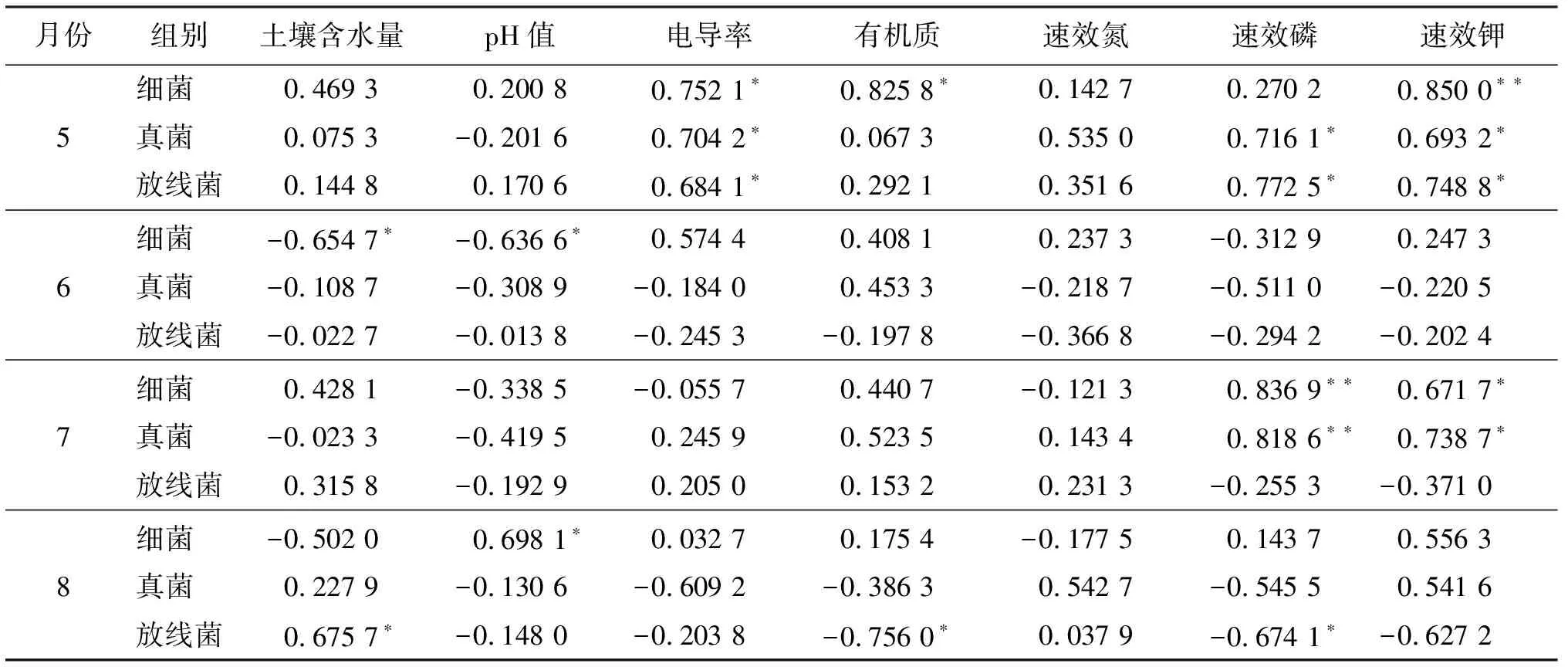
表3 红花不同生长期微生物与土壤环境因子线性回归方程r值比较
土壤微生物的数量分布,不仅可以反映土壤环境质量的变化,而且是土壤中生物活性的具体体现[24]。细菌营养类型多,代谢旺盛、繁殖快,多数情况下其个体数量最多。试验地的降水主要集中在6月和8月,7月天气炎热,地表蒸发量大,而5月由于红花处于生长初期,人为浇灌频繁,有利于细菌喜好湿润,能耐受低氧水平的特性,除7月(红花花期)外,细菌生长迅速。此外,由于细菌占微生物总数的比例最大,所以细菌的变化趋势基本决定了微生物总数的变化趋势。
放线菌的大部分均属好氧腐生菌,其有机营养物类型广泛,对一些复杂的难降解有机物有较强的利用能力,因此在土壤中放线菌对促进碳循环和腐殖质形成有重要作用。此外,放线菌对外界环境的变化反应敏感性较差,对外界环境变化有一定的抵御能力[25]。6月是红花伸长期,此时期放线菌在3个样地中达整个红花生长期的最高值,分析认为此时红花需要大量养分确保生理生长的进行。此外,土壤中一些放线菌还能产生抗生素,对其他有害菌能起拮抗作用[26]。种植2年样地由于连年种植,土壤中会产生多于种植1年样地的病原微生物。因此,在病虫害多发的秋季(8月),正值红花种子成熟期种植2年样地放线菌数量显著增高(P<0.05)。
真菌的菌丝可对土壤微粒进行物理性固定,粘结土壤颗粒形成团聚体时更明显[27],是降解各种有机物的重要类群。对不利环境忍耐力较强,它们的孢子、菌核和菌索忍耐力较强。因此,可广泛分布于各种类型的土壤中。5、6月人为管理下真菌生长较稳定,当温度及水分供给较少的7月到来时,真菌数目下降,但由于其忍耐性强,单个样地此时真菌数目较相似。
3.2微生物与环境因子间关系 微生物在土壤中的分布不仅可以反映环境对其群落组成的影响,还可以表明微生物自身对植物生长、土壤肥力及物质循环和能量转化的现状和趋势的相关性。红花莲座期放线菌、真菌数量与电导率、速效磷、速效钾存在正相关,与它们在此时期的增长趋势结果结合认为:莲座期土壤电导率、速效磷、速效钾是放线菌和真菌数量的决定因子。虽有研究表明盐碱土中细菌、放线菌数量与全盐含量呈显著负相关[28],且随着土壤盐渍化程度的增加土壤微生物数量呈下降趋势[29],但试验样地此时期土壤电导率值较低,其作为第一主成分在一定范围内与微生物数量形成正相关关系。而对于莲座期与细菌呈显著正相关的有机质及与之呈显著负相关的土壤含水量和pH值(伸长期),其数量的降低应归因于土壤有机质含量的降低及由于两时期较频繁的灌水造成土壤盐碱度增加(表1)共同导致细菌数量变化的不规律,即6-7月(伸长期-花期)数量的下降,表明细菌较易受环境因子扰动,使其在群落形成结构中变化不稳定[30]。伸长期-种子成熟期,真菌数量极显著下降后又上升与真菌呈显著正相关关系、速效钾含量的降低后升高有一定联系。此外,研究认为较高的温度导致土壤含水量的降低,引起土壤有机质及土壤其他营养元素在此生态系统地上及地下部分的利用受限[31-32],因此,较高温度同样促使土壤细菌、真菌数量极显著(P<0.01)降低。
值得注意的是含水量虽未成为红花生长各时期的第一主成分,但其在每个时期均存在较大载荷量,说明在干旱环境下,水分含量是限制微生物活性的主要因素[33-34]。此外,红花生长莲座期、伸长期及花期速效磷分别作为第一主成分、第一主成分、第二主成分出现,而有机质只在种植成熟期为第一主成分,暗示速效磷在红花种子成熟期作用不显著,推测红花种植前3个时期应保证田间土壤速效磷量,后期保证土壤有机质的量可以增加土壤微生物活性,进而提高土壤活性。
3.3土壤微生物、植物与环境因子间关系 从植物病害发生的理论来说,土壤生态环境的恶化、土壤微生物区系的破坏,将为植物病害的发生提供更为有利的条件。故土壤微生物的平衡发展也是预防植物病害发生的基础[35-36]。因此,可从土壤微生物变动中获取土壤健康状况信息,以利于植物病害的预测。
放线菌是主要的抗生素产生菌,它们能产生种类繁多的抗生素,不少放线菌在自然界物质循环和提高土壤肥力等方面起着重要作用,有的还能分泌生长激素,刺激作物生长和发芽生根[37-39]。在红花伸长期,3个样地放线菌数量均达整个红花生长期的最高值,分析认为此时期是红花植株生长旺盛期,大量有益菌群的增长不仅可以促进红花茎的伸长,还可以降低此时红花植株的抗病能力。
种子成熟期放线菌与有机质和速效磷呈负相关,即有机质是抑制放线菌生长的关键土壤微环境因子。Noah等[40]研究证实,随土壤中可利用碳含量减少土壤微生物数量降低,微生物群落结构改变。而土壤中施加含碳量高的物质可提高土壤微生物群落G-比例,降低放线菌和G+比例[41]。红花病害多因真菌引起,而真菌占据土壤微生物的绝对优势是因其与土壤pH值间存在负相关关系[42],此时细菌与土壤pH值呈显著正相关,暗示耕地土壤高pH值使真菌、细菌生长具较大竞争性[42],即适量提高土壤pH值抑制真菌生长,可能会防止此红花病虫害。
综上所述,不同植被类型及植物生长期的不同可直接影响土壤中微生物的种类与数量[23,43]。此外,土壤微生物多数属异养菌,它们的分布与土壤有机质含量有明显相关性,土壤肥力状况和理化性质对微生物分布有直接影响,这些因素的改变都会引起土壤中微生物数量的消长和组成的改变[44],而作为土壤营养元素的“源”和“汇”,微生物的生理动态势必还会影响到植物的生长、发育。因此,野外环境下的不可控因素导致土壤因子对微生物数量的影响表现在由其他土壤因子作用后的间接效应,使得后续试验可将室外(田间)与室内(实验室)可控单因子盆栽试验对微生物类群间、土壤因子间关系需综合考虑,此外还可对多年种植红花土壤甚至病害多发状况土壤进行研究,为获得红花最佳栽培条件,防止土传病虫害,科学、规范化种植提供理论依据。
[1]任水莲,王键,王晓梅,等.新疆红花生育气候条件分析与适生种植气候区划[J].中国农业气象,2005,26(2):119-122.
[2]王兆木.发展新疆红花产业的思路与对策[J].新疆农业科学,1998(6):241-244.
[3]乔卿梅,程茂高,王新民.根际微生物在克服药用植物连作障碍中的潜力[J].土壤通报,2009,40(4):957-951.
[4]苗则彦,赵奎华,刘长远,等.健康与罹病黄瓜根际微生物数量及真菌区系研究[J].中国生态农业学报,2004,12(3):156-157.
[5]陆宁海,吴利民.健康与罹病玉米根际微生物数量及真菌区系研究[J].玉米科学,2007,15(5):136-138.
[6]徐瑞富,陆宁海,李小丽.土壤微生物群落对棉花黄萎病的影响[J].棉花学报,2004,16(6):357-359.
[7]郭兰萍,黄璐琦,蒋有绪,等.药用植物栽培种植中的土壤环境恶化及防治策略[J].中国中药杂志,2006,31(9):714-717.
[8]Chabrerie O,Laval K,Puget P,etal.Relationship between plant and soil microbial communities along a succession gradient in achalk grassland in north western France[J].Applied Soil Ecology,2003,24:43-56.
[9]Tscherlo D,Hammesfahr U,Zeltner G,etal.Plant succession and rhizosphere microbial communities in arecently deglaeiated alpine terrain[J].Basic and Applied Ecology,2005,6:367-383.
[10]姚槐应,黄昌勇.土壤微生物生态学及其实验技术[M].北京:科学出版社,2006:180-192.
[11]Bucher A E,Lanyon L.Evaluating soil management with microbial community level physiological profiles[J].Applied Soil Ecology,2005,29:59-71.
[12]任天志.持续农业中的土壤微生物指标研究[J].中国农业科学,2000,33(1):68-75.
[13]杜国坚,何金训.杉木连栽林地土壤微生物区系及其生化特性和理化性质的研究[J].浙江林业科技,1995,15(5):14-20.
[14]Rogers B F,Tate R L.Temporal analysis of the soil microbial community along a top sequence in Pineland soils[J].Soil Biology and Biochemistry,2001,33(10):1389-1401.
[15]江曙,段金廒,钱大玮,等.根际微生物对药材道地性的影响[J].土壤,2009,41(3):344-349.
[16]中国科学院南京土壤研究所.土壤微生物研究法[M].北京:科学出版社,1985:85-176.
[17]鲍士丹.土壤农化分析[M].北京:中国农业出版社,2005:22-108.
[18]张金屯.数量生态学[M].北京:科学出版社,2005:133-140.
[19]宇传华.SPSS与统计分析[M].北京:电子工业出版社,2007:491-506.
[20]Srivastava S C.Measurement of soil microbial bio-mass provides an early indication of changes in total soil organic matter due to straw incorporation[J].Soil Biology and Biochemistry,1992,24:711-714.
[21]邵玉琴,赵吉,杨劼.恢复草地和退化草地土壤微生物类群数量的分布特征[J].中国沙漠,2004,24(2):223-226.
[22]Ma M.Seasonal variation of fungi in soil in the vic-inity of peaking [J].Bulletin for the History of Chemistry,1983:293-297.
[23]张成霞,南志标.放牧对草地土壤微生物影响的研究述评[J].草业科学,2010,27(1):65-70.
[24]蔡晓布,钱成,张永清.退化高寒草原土壤生物学性质的变化[J].应用生态学报,2007,18(8):1733-1738.
[25]姚拓,马丽萍,张德罡.我国草地土壤微生物生态研究进展及浅评[J].草业科学,2005,22(11):1-7.
[26]刘志恒.现代微生物学[M].北京:科学出版社,2001.
[27]杨海君,肖启明,刘安元.土壤微生物多样性及其作用研究进展[J].南华大学学报(自然科学版),2005,12:21-27.
[28]黄明勇,杨剑芳,王怀锋,等.天津滨海盐碱土地区城市绿地土壤微生物特性研究[J].土壤通报,2007,38(6):1131-1135.
[29]乔正良,来航线,强郁荣,等.陕西主要盐碱土中微生物生态初步研究[J].西北农业学报,2006,15(3):60-64.
[30]Turner B L,Haygarth P M.Phosphorus solubilization in rewetted soils[J].Nature,2001,411:258-263.
[31]Susan J G,Cindy E P.Microbial communities in forest floors under four trees species in coastal British Columbia[J].Soil Biology and Biochemistry,2005,37:1157-1167.
[32]Colin W B,Veronica A M,Nancy E M,etal.Linking microbial community structure and function to seasonal differences in soil moisture and temperature in a Chihuahua desert grassland[J].Microbial Ecology,2009,58:827-842.
[33]蔡晓红,杨京平,马维娜,等.稻田根际微生物生物量碳与水分、氮素影响效应分析[J].浙江大学学报(农业与生命科学版),2008,34(6):662-668.
[34]Venkateswarlu B, Rao A V.Distribution of microorganisms in stabilized and unstabilized sand dunes of the Indian Desert[J].Journal of Arid Environments,1981,4:203-207.
[35]李阜棣.土壤微生物学[M].北京:中国农业出版社,1995.
[36]Moony J H,Cushman E,Medina O E.Functional roles of biodiversity[R].New York:John Wiley and Sons,1996.
[37]韦红群,邓建珍,曹建华,等.柱花草根系与根际微生物类群的研究[J].草业科学,2009,26(1):69-73.
[38]向佐湘,方宝华,杨知建,等.桂西北峰丛洼地4种牧草生产力分析[J].草业科学,2007,24(12):48-53.
[39]丁玲玲,祁彪,尚占环,等.东祁连山亚高山草地土壤微生物功能群数量动态及其与土壤环境关系[J].草业学报,2007,16(2):9-18.
[40]Noah F,Joshua P S,Patricia A H.Variations in microbial community composition through two soil depth profiles[J].Soil Biology and Biochemistry,2003,35(1):67-176.
[41]Griffiths B S,Ritz K E,Dobson G.Soil microbial community structure:Effects of substrate loading rates[J].Soil Biology and Biochemistry,1999,31:145-153.
[42]Johannes R.On the ecology of saprotrophic fungi and bacteria in soil: biotic and abiotic control of growth rates[D].Sweden,Lunde:Lund University,2009.
[43]张宗舟,张扬,陈志梅.小陇山不同林地土壤微生物多样性研究[J].草业科学,2010,27(11):66-70.
[44]高婷,张源沛.荒漠草原土壤微生物数量与土壤及植被分布类型的关系[J].草业科学,2006,23(12):22-25.
