口蹄疫病毒抗原决定簇融合基因转化苜蓿
2011-04-25王鸣刚罗茂春彭轶楠
王鸣刚,罗茂春,彭轶楠,卢 真,陈 亮
(1.兰州理工大学生命科学与工程学院,甘肃 兰州 730050;2.龙岩学院生物系,福建 龙岩 364012;3.厦门大学生命科学学院,福建 厦门 361005)
口蹄疫(foot-and-mouth disease,FMD)是由口蹄疫病毒引起的烈性传染病,主要感染偶蹄目动物,患病动物在消化道的皮状粘膜、口、舌、唇、蹄间隙和蹄冠缘、乳房及皮肤的其他无毛发处等部位发生水泡和溃烂。人和非偶蹄动物也可感染此病,但症状较轻。由于猪、牛、羊等主要的家畜均可感染此病,并能形成大规模地流行,所以国际兽疫局将该病列为A 类家畜传染病之首[1]。
1989年美国科学家在烟草(Nicotianatabacum)、马铃薯(Solanumtuberosum)等植物上成功地制造了乙肝疫苗、大肠埃希菌疫苗,用这些植物喂饲小鼠后,均产生了预防接种的效果,引起了植物学、微生物学、免疫学、分子生物学等方面专家的极大兴趣和关注[2]。自第1例转基因植物表达系统生产疫苗出现以来,很多植物疫苗已问世,并在动物和人体内进行了临床试验。结果表明,植物疫苗在预防感染性疾病、治疗肿瘤和自身免疫病等方面是可行有效的[3]。
转基因植物作为生物反应器生产口服疫苗,以其独特的优越性迅猛发展,其研究和应用开辟了植物生物技术的新天地。转基因植物口服疫苗将成为生物制药的重要发展方向[4-6]。
口蹄疫病原为口蹄疫病毒,属小RNA病毒科口蹄疫病毒属,是目前所知病毒中最细微的一级,具有7种不同的血清型。7 种不同血清型可根据核酸同源性大小分为两群:O、A、C 和Asia I 为第1群,SAT1、SAT2、SAT3 为第2群。群内各型同源性达60%~70%,但两群之间同源性仅为25%~40%,各血清型间无血清交叉和交叉免疫现象,各个血清型又包括多个亚型[7]。O型口蹄疫为全世界流行最广的一个血清型,我国流行的口蹄疫主要为O、A、C三型及ZB型[7]。
本试验通过农杆菌介导的方法将口蹄疫抗原决定簇融合基因O21-O14-A21-HBcAg转入苜蓿(Medicagosativa)品种甘农1号中,希望获得转基因植株。从中选出高表达口蹄疫抗原决定簇融合基因的植株,期望通过免疫动物获得对口蹄疫病毒的免疫应答。
1 材料与方法
1.1材料 甘农1号苜蓿品种由甘肃农业大学草业学院提供。农杆菌株EHA105由兰州理工大学植物细胞与分子生物学实验室保存。pCAMBIA1301 双元载体,含T-DNA左右边界序列、植物抗性筛选标记HPT、抗性标记NPT-Ⅱ、报告基因GUS以及多克隆位点(MCS),由澳大利亚CAMBIA实验室提供。O型和A型口蹄疫抗原决定簇融合基因(O21-O14-A21-HBcAg)植物表达载体(pCAMBIA1301-O21-O14-A21-HBcAg)由兰州理工大学植物细胞与分子生物学实验室构建,结构如图1所示。
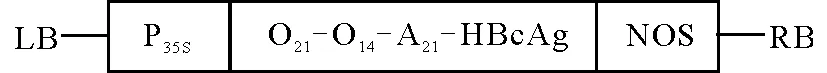
图1 融合基因O21-O14-A21-HBcAg植物表达载体结构
植物诱导(继代)培养基和共培养基(B5H):B5+2,4-D 0.1 mg/L+KT(Kinetin)0.1 mg/L;筛选培养基(B5HHT1):B5+2,4-D 0.1 mg/L+KT 0.1 mg/L+Hyg(潮要素)1 mg/L+Timentin 300 mg/L;诱导胚性愈伤组织培养基(B5HHT2):B5+2,4-D 0.1 mg/L+KT 0.1 mg/L+Hyg 1 mg/L+Timentin 200 mg/L;分化培养基(B5HT):B5+Hyg 1 mg/L+Timentin 100 mg/L;诱导生根培养基(1/2MSHT):1/2MS(蔗糖10 g/L)+Hyg 1 mg/L+Timentin 100 mg/L。
1.2方法
1.2.1苜蓿再生系统的建立 取出芽两周的实生苗叶片作为外植体,平铺至B5H培养基中。继代一次后将愈伤组织转至B5培养基中诱导体胚的分化,两周继代一次,在淡黄色(或黄绿色)愈伤组织上长出绿点。待胚状体长成鱼雷状且可清晰地辨认单个胚状体时,将其单个分离并转至新的B5培养基中继续培养。待胚状体发育成小苗并有少数根后,将小苗移植到1/2 MS生根培养基中诱导生根,移植20 d后统计根生长情况。
1.2.2苜蓿愈伤组织对潮霉素的基础抗性测定 将苜蓿的愈伤组织放置于含不同潮霉素(Hygromycin,Hyg)质量浓度的B5H培养基上,观察其生长状况20 d,进而确定最佳潮霉素抗性筛选质量浓度。
1.2.3转化、筛选和潮霉素抗性植株的再生 取新鲜苜蓿叶片,在B5H中预培养 4 d,待农杆菌培养至OD600约0.6时,取1 mL菌液加到9 mL MS液体培养基中混匀;将经过预培养的叶片加入到上述混合液中,放置20 min。取出侵染后的叶片组织,置于B5H培养基中,暗处共培养4~5 d后取出叶片,转移到B5HHT1培养基中筛选。将筛选20 d后的叶片组织转至B5HHT2培养基中诱导愈伤组织,并在B5HT中诱导分化;分化培养基中分化出小苗后将再生苗移植到1/2 MSHT中诱导生根。然后,移植到营养钵中继续生长。
1.2.4组织化学及分子生物学方法检测 GUS基因(与口蹄疫基因构建在一起的转入基因)活性的组织化学染色检测,参照王关林和方宏筠[8]的方法。
PCR检测与分析:融合基因O21-O14-A21-HBcAg全长900 bp。通过Primer Premier 5软件对融合基因内部序列设计引物,两条引物之间约540 bp。
5′端引物:5′-TGCCTTCTGACTTCTTTCC-3′;3′端引物:5′-CCTGCCTCGTCGTCTAAC-3′。
PCR反应条件为:94 ℃ 预变性5 min;94 ℃ 变性45 s,52 ℃ 退火45 s,72 ℃ 延伸1 min,35个循环;最后72 ℃ 延伸5 min。
2 结果与分析
2.1甘农1号愈伤组织形成及分化情况 甘农1号叶片外植体接种于B5H培养基中,于25 ℃、14 h/d光照条件下培养诱导愈伤,20 d后取其中7个重复组统计愈伤数,出愈率为95.2%。有65个外植体分化出了绿点,分化率达61.9%,分化时间(即愈伤组织上形成第1个绿点所需的时间)为25~35 d。
2.2潮霉素的质量浓度对苜蓿叶片愈伤组织形成的影响 结果表明,在0.5 mg/L的选择压下,抗性愈伤组织形成情况与对照组无明显差异。随着潮霉素质量浓度的提高,愈伤组织逐渐变黄,长势明显减弱。当潮霉素质量浓度为1 mg/L时,20 d后叶片单个外植体部分褐化死亡,部分正常长出愈伤组织,长出的愈伤组织相对于对照组稍小且黄;当潮霉素质量浓度加到2 mg/L时,20 d后叶片基本枯黄,多数不能正常形成愈伤组织(表1)。因此,可确定以甘农1号叶片作为转化材料,其愈伤诱导分化潮霉素的选择压力为1 mg/L。
表1 不同选择压力对苜蓿叶片愈伤组织形成的影响
2.3抗性愈伤组织的筛选及其再生植株的获得 取出在B5H培养基中预培养4 d的叶片,将其同农杆菌菌液混合侵染20 min,经过在B5H培养基上5 d的共培养后,接种于B5HHT1培养基上进行筛选。经约10 d,叶片部分枯黄,某些区域开始突起形成抗性愈伤组织(图2A),20 d后愈伤组织基本覆盖叶片。在B5HHT2培养基上继代一次后转至B5HT培养基上,约两周后抗性愈伤长出绿色的芽点(图2B),并很快的分化成芽。将芽分离置于新的B5HT培养基上培养,经过25~30 d芽逐渐长出叶片,并在基部分化出根(图2C)。最终形成植株52株,出芽率49.5%,其中生根的植株有48株,生根率达到45.7%(图2D)。
2.4组织化学及分子生物学方法检测
2.4.1GUS基因在转化后的愈伤组织中的瞬时表达检测 转化愈伤(叶片)组织在培养30 d后,取抗性愈伤组织进行GUS基因组织化学染色检测,转化愈伤组织块表面部分呈现蓝色斑点(图3)。

图2 转基因苜蓿再生过程

图3 GUS基因在转化愈伤中的瞬时表达(右边为阴性对照)
2.4.2PCR检测结果 以抗性植株叶片分别提取的基因组总DNA为模板,用前面所述引物进行PCR扩增(图4),结果表明,抗性植株扩增出长度约为540 bp条带,与阳性对照一致,而阴性对照(未转化植株)未扩增出任何条带。表明目的基因O21-O14-A21-HBcAg已整合到转化植株的染色体基因组中。在随即检测的7株农杆菌转化再生植株中,有4株呈阳性反应,阳性率为57.1%。

图4 转基因抗性植株PCR扩增结果
3 讨论
3.1基因型对愈伤组织的形成与分化的影响 愈伤组织的形成受到外植体供体的基因型、培养基成分、外界环境等诸多因素的影响,是个复杂的过程。然而,在苜蓿的组织培养中,王鸣刚等[9]先前的研究结果表明苜蓿叶片形成愈伤组织的能力同基因型关系并不大。在本研究中,曾尝试对陇东等其他品种进行愈伤诱导,发现陇东苜蓿在B5H培养基中极不容易形成愈伤,与前人的研究结果[10-11]有不相符之处。
苜蓿愈伤组织的形成大致可分为诱导、细胞分裂和细胞分化3个过程。本研究发现,愈伤组织的长势与分化能力并无必然关联。愈伤组织有可能单极疯长,却并不分化。也有愈伤组织表面分化的绿点不断地细胞分裂,但没有进一步分化成茎叶等结构。而一些叶片,特别是经过潮霉素筛选的叶片,初期会枯萎,在20多天后才开始形成愈伤组织并进一步分化出胚体。在分化能力方面,各个基因型间存在显著差异(结果未列出),甘农1号是最适合的再生体系的品种。
3.2潮霉素对抗性再生的抑制 确定选择压力的要求是:选择性抗生素的浓度既能有效抑制非转化细胞的生长,使之慢慢死亡,又不能对受体植物细胞有严重的毒性,影响转化细胞的正常生长分化。多数研究者采用一步法,即在整个愈伤诱导、分化及生根过程中采用相同的筛选压,筛选压多选择半致死浓度,降低抗生素对转化细胞的损害,但是筛选效率较低。多步筛选法是在外植体最初诱导形成愈伤的几周采用较低的筛选压,等愈伤长到一定程度后,提高抗生素的浓度[12]。也有人采用筛选压浓度先高后低的方法[13],多步法筛选得到的再生苗阳性率较高,但采用先低后高的筛选压容易产生嵌合体,先高后低则由于开始筛选压过高,多数细胞无法正常生长、分化而降低再生率。转基因苜蓿研究中通常采用Austin等[14]建立的一步法,本试验在愈伤形成、分化及生根过程中均使用1 mg/L的潮霉素作为筛选压,初步结果表明阳性率接近50%,筛选效率较高。但在该质量浓度下,再生苗生根明显受到抑制,根生长缓慢且很少有根毛的分化,这可能是由于根组织相对于叶片对潮霉素敏感性更高。
3.3预培养、农杆菌侵染时间及共培养时间对转化效率的影响 预培养可促进细胞分裂,分裂状态的细胞更易整合外源DNA,从而提高外源基因的短暂表达和稳定整合率。陈晨等[15]对预培养影响苜蓿的转化效率的研究表明,预培养5 d抗性愈伤的形成率及稳定转化率都最高。本试验在农杆菌转化前,对叶片进行4~5 d的预培养。
农杆菌侵染外植体时间及共培养时间都会影响转化效率。在侵染过程中,一方面要使农杆菌充分接触叶片,另一方面又要将细菌对植物组织的伤害降低到最小。陈晨等[15]的研究表明,苜蓿叶片侵染20 min时瞬时表达率及抗性愈伤形成率最高。参考不同学者的研究方法,本试验选择农杆菌侵染时间为20 min。
农杆菌与外植体共培养在整个转化过程中是非常重要的环节,T-DNA的转移及整合都在这一时期内完成。农杆菌附着后不能立即转化,只有在创伤部位生存16 h后的菌株才能诱发肿瘤,这一段时间被称为“细胞调节期”[16-17]。因此,共培养的时间必须大于16 h,时间太短不能实现T-DNA的转移和整合。但如果共培养的时间太长,农杆菌过度增殖会使外植体受到毒害甚至死亡,同时后续试验中农杆菌也不易被清除。本试验发现,一般共培养4 d的农杆菌就开始大量生长,继续培养不利于后面叶片的抑菌培养和分化。因此,本试验采用共培养3~5 d后除去叶片表面的农杆菌,置于含Timentin的培养基中诱导愈伤的形成。
3.4抗性苗再生过程中的植株异型现象 本试验发现,从愈伤组织分化出的胚体细胞可进一步分化形成叶片状结构,但该“叶片”较正常植株的叶片更加粗厚,且体积相对较大。这些异化的结构在经过一段时间后有些可以在原有结构上重新长出正常的植株,但是植株与未被农杆菌侵染的正常再生苗相比显得纤弱。这种情况下,要形成正常的植株往往要经历更加漫长的时间。因此,本试验对这些材料提供的培养基渐次降低潮霉素和抗生素的浓度,以缩短出苗时间。
3.5转单一抗原与融合抗原基因植物的比较 Dimarchi等[18]用合成FMDV VP1 141~158和200~213片段氨基酸组成的40个氨基酸肽(半胱氨酸-半胱氨酸-200~213-脯氨酸-脯氨酸-丝氨酸-141~158-脯氨酸-半胱氨酸-甘氨酸),在其中间加上两个脯氨酸和一个丝氨酸,使多肽折成立体构型,大大提高了单段肽(141~158-脯氨酸-半胱氨酸-甘氨酸)在豚鼠中的应答水平,并提出了N-末端氨基酸(半胱氨酸-半胱氨酸)在提高保护应答中的重要性。Brown[19]用化学法合成了FMDV VP1基因编码的140~160及200~213位肽段的基因片段,并在大肠杆菌体内得到了表达,用其免疫牛、猪等都获得了较好的免疫力。Doel 等[20]根据FMDV A、O、C三型的VP1序列分别合成了含各型病毒VP1蛋白的141~158和200~213片段氨基酸残基的多肽。分别将各多肽与油佐剂混合接种牛和豚鼠上,诱导产生了高水平的抗同型病毒和抗接种肽的抗体,并且针对A型和O型FMDV合成的多肽接种的实验动物能抵抗同型病毒的攻击,但C型效果较差。由于我国流行的口蹄疫主要为O、A、C三型及ZB型[7],综合前人试验结果,本试验构建O型和A型口蹄疫特异抗原决定簇融合基因(O21-O14-A21-HBcAg)植物表达载体,并以此转化苜蓿,期望表达特异抗原,进行特异保护。
[1]Knowles N J,Samuel A R.Molecular epidemiology of foot-and-mouth disease virus[J].Virus Research,2003,91:65-80.
[2]Schillberg S,Fischer R,Emans N.Molecular farming of antibodies in plants[J].Natur Wissenschaften,2003,90(4):145-155.
[3]庞伟,侯宗柳. 转基因植物疫苗研究进展[J].中国天然药物,2004,2(3):141-144.
[4]Mason H S,Warzecha H,Mor T,etal.Edible plant vaccines: applications for prophylactic and therapeutic molecular medicine[J].Trends in Molecular Medicine,2002,8(7):324-329.
[5]Streatfield S J,Howard J A.Plant production systems for vaccines[J].Expert Review of Vaccines,2003,2(6):763-775.
[6]曹宏,章会玲,马永祥,等.陇东地区紫花苜蓿品种区域试验研究[J],草业学报,2009,18(3):184-191.
[7]赵凯,陈光辉,张震宇,等.以免疫球蛋白为载体的抗O型口蹄疫病毒基因工程疫苗的构建[J].生物工程学报,2000,12(6):659-683.
[8]王关林,方宏筠.植物基因工程[M].第2版.北京:科学出版社,2002.
[9]王鸣刚,骆换涛,吴亦亮.AtPCS1基因表达载体的构建与转化苜蓿的研究[J].草业科学,2011,28(2):201-206.
[10]Gandonou C,Errabii T,Abrini J,etal.Effect of genotype on callus induction and plant regeneration from leaf explants of sugarcane (Saccharumsp.)[J].African Journal of Biotechnology,2005,4:1250-1255.
[11]王瑞云,岳文斌,任有蛇.不同苜蓿品种对叶片愈伤组织诱导及植株再生的影响[J].中国草地,2004,26:36-39.
[12]郭兆奎,杨谦,姚泉洪,等.转拟南芥AtKup1基因高含钾量烟草获得[J].中国生物工程杂志,2005,25(12):24-28.
[13]Ikram U H.Agrobacterium-mediated transformation of cotton (GossypiumhirsutumL.) via vacuum infiltration[J].Plant Molecular Biology Reporter,2004,22:279-288.
[14]Austin S,Bingham E T,Matthews D E,etal.Production and field performance of transgenic alfalfa (MedicagosativaL.) expressing alpha-amylase and manganese-dependent lignin peroxidase[J].Euphytica,1995,85:381-393.
[15]陈晨,曹致中,贺顺姬,等.农杆菌介导的紫花苜蓿遗传转化体系的建立与优化[J].甘肃农业大学学报,2004,39:516-519.
[16]张万军,王涛.紫花苜蓿愈伤成苗高频再生体系的建立及其影响因子的研究[J].中国农业科学,2002,35: 1579-1583.
[17]韩利芳,张玉发.烟草MnSOD 基因在保定苜蓿中的转化[J].生物技术通报,2004(1):39-42.
[18]Dimarchi R,Brooke G,Gale C,etal.Protection of cattle against foot-and-mouth disease by a synthetic peptide[J].Science,1986,232:639-641.
[19]Brown F.Picornaviruses[A].In:Van Regenmortel M H V,Neurath A R.Immunochemistry of Viruses,vol.II.The Basis for Serodiagnosis and Vaccines[M].Amsterdam:Elsevier,1990:153-169.
[20]Doel T R,Gale C,Amaral C M,etal.Heterotypic protection induced by synthetic peptides corresponding to three serotypes of foot-and-mouth disease virus[J].Journal of Virology,1990,64(5):2260-2264.
