大孔吸附树脂分离纯化锁阳总黄酮效果初探
2011-04-25张庭瑞李志忠
张庭瑞,李志忠
(兰州理工大学生命科学与工程学院,甘肃 兰州 730050)
锁阳(Cynomoriumsongaricum)又名铁棒槌、锈铁棒、地毛球等,是锁阳科锁阳属的单科单属单种植物,多寄生于蒺藜科白刺属(Nitraria)植物的根部,属全寄生种子植物。系多年生肉质草本,无叶绿素,呈紫红色,大部埋于沙中。锁阳中含大量黄酮类化合物[1]。黄酮类化合物具有抗自由基、抗氧化、抗癌、抗菌等多种生理活性及药理作用[2],且无毒无害,对人类的肿瘤、衰老、心血管病等疾病的治疗和预防有重要意义,还被用作食品、化妆品天然添加剂,如甜味剂、抗氧化剂和食用色素等[3-4],因此,成为近年研究、开发和利用的热点[5-7]。目前国内外文献尚未见对锁阳总黄酮纯化的报道。黄酮类化合物最常用的纯化方法为层析柱法,主要利用大孔树脂作为吸附材料。大孔吸附树脂是20世纪60年代初开发的一类有机高聚物吸附剂,大孔吸附树脂分离技术的应用原理主要是利用其吸附性和分子筛作用相结合,依靠其物理性质(如比表面积、孔径等)选择性地吸附药液中有效成分并去除杂质。特点是吸附容量大、再生简单、效果可靠[8]。大孔吸附树脂分离技术被认为是提取分离中草药中水溶性成分的一种有效方法[9]。该技术已比较广泛地应用到中药新药的开发和中成药的生产中,主要用于分离和提纯苷类、黄酮类、生物碱成分及其大规模生产[10]。
1 材料与方法
1.1材料与仪器 锁阳干燥肉质茎(甘肃酒泉产)、芦丁标准品和AB-8型大孔吸附树脂分别由甘肃酒泉市金锁阳天然保健品有限公司、中国药品生物制品检定所和南开大学化工厂提供;亚硝酸钠、硝酸铝、氢氧化钠、无水乙醇、盐酸、氯仿均为分析纯,甲醇为优级纯。
主要仪器设备包括:UV-9200型紫外可见分光光度计;AB104-N型电子分析天平;HH-4型数显恒温水浴锅;TG16型高速台式离心机;SHB-Ⅲ型循环水式多用真空泵;RE 52-88A型旋转蒸发仪;电子调剂万用电炉;Galanz WP750型微波炉;JY92-Ⅱ型超声波细胞粉碎机;BS-2F型振荡培养箱;层析柱(Ф 15 mm×450 mm)。
1.2试验方法
1.2.1样品处理 用清水冲洗干净,置于干燥箱中60 ℃恒温干燥30 min,取出冷却后粉碎,过0.15 mm筛,置干燥器中备用。
1.2.2标准曲线的绘制 以Na(NO3)2-Al(NO3)3-NaOH络合显色分光光度法在510 nm波长处测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线[11-12]。得回归方程y=1.177 9x+0.005 2(r=0.999 75)和芦丁含量y与吸光度x之间的回归曲线(图1)。
1.2.3AB-8型大孔吸附树脂预处理 按下列步骤进行预处理:将树脂以95%工业乙醇浸泡24 h后湿法装柱;用95%工业乙醇冲洗(流速2 BV/h,BV为树脂体积倍数)洗至流出液与水以1∶2混合不产生混浊时,再用大量蒸馏水洗至洗液澄清;用2 BV 5% HCl液冲洗树脂柱(流速4~6 BV/h),然后用水以同样流速洗至中性;用2 BV 2% NaOH液冲洗树脂柱(流速4~6 BV/h),然后用水同样流速洗至中性[13]。
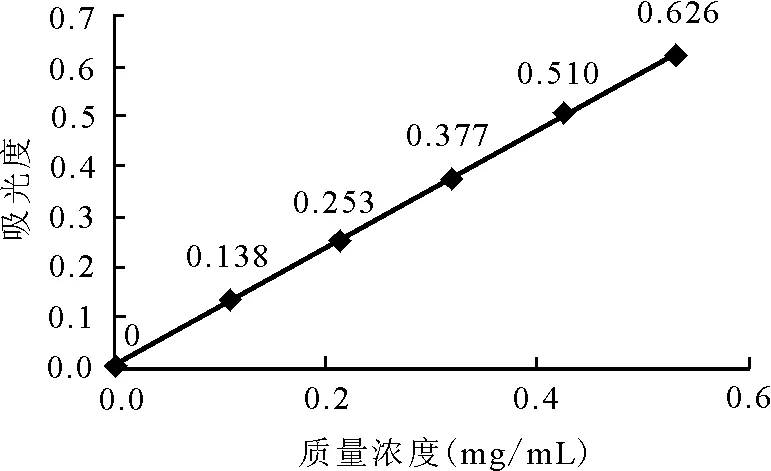
图1 芦丁对照品回归曲线
1.2.4AB-8型大孔吸附树脂纯化粗提液 取备用锁阳30 g,以70%乙醇600 mL在80 ℃下回流1.5 h,以500 W、20 s/20 s、60 s的条件超声波处理2次;再以80 ℃回流1.5 h;减压抽滤,并用少量30%乙醇溶液洗涤滤渣,合并滤液;在45 ℃下减压蒸馏,除去其中的乙醇;将浓缩液以75 mL氯仿分3次萃取脱脂,待完全分层后,收集每次水溶液;离心,取上清液,作为供试液备用。
1.2.5树脂比吸附量的测定 取预处理的干树脂43 g,装入500 mL碘量瓶中,加入供试液185.6 mL,恒温25 ℃,150 r/min,振摇吸附24 h。在1、2、3、4、5、6、7、8、9、10、12、14、16、18、20、22、23、24 h时吸取上清液,测定样品中的总黄酮含量。
按公式A=(C1-C2)×V/W计算在t时刻内树脂对锁阳总黄酮的比吸附量。式中,A为比吸附量(mg/g);C1为吸附前供试液质量浓度(mg/mL);C2为吸附后上清液质量浓度(mg/mL);V为样品液体积(mL);W为干树脂质量(g)。按照“标准曲线绘制”项下的方法精密量取相应体积的稀释液进行处理,测定吸光度[13]。
1.2.6比洗脱量的测定 将上述充分吸附后的树脂,装入层析柱内,树脂柱用120 mL蒸馏水冲洗后,用70%的乙醇洗脱,流速1 mL/min,收集乙醇洗脱液,测定其中所含的黄酮量[13]。
M=(C×V)/W式中,M为比洗脱量(mg/g);C为洗脱液质量浓度(mg/mL);V为样品液体积(mL);W为树脂质量(g)。
2 结果
AB-8型大孔树脂吸附10 h后对锁阳总黄酮的比吸附量超过70%,最终稳定比吸附量达81.933 mg/g(表1),锁阳提取液纯化后纯度达到972.775 mg/g,即97.278%。树脂吸附达到饱和大约需10 h,且由最终洗脱液质量浓度可得出该树脂对锁阳总黄酮的比洗脱量,最高可达53.164 mg/g。

表1 大孔吸附树脂吸附浓度、纯化结果及分析
3 讨论与结论
黄酮类化合物是具有酚羟基的两个苯环(A,B环)通过中央3个碳原子连接而成的一系列化合物,植物体内大部分与糖结合成苷类或碳糖基存在,有的以游离形式存在[5]。黄酮类化合物的溶解度因结构及存在状态(苷或苷元、单糖苷、双糖苷或三糖苷)不同而存在差异,一般游离苷元难溶或不溶于水,易溶于乙醇、甲醇等有机溶剂及稀碱中,其中黄酮、黄酮醇、查尔酮等平面型黄酮类化合物分子间引力较大,难溶于水;而二氢黄酮、二氢黄酮醇及异黄酮等非平面型黄酮类化合物处于半椅子式结构,破坏了分子的平面性,分子间引力较小,其水溶性大于上述平面型黄酮类化合物。黄酮类化合物糖苷化后,水溶性增加,脂溶性降低,一般易溶于热水、甲醇、乙醇、稀碱溶液,而难溶于苯、乙醚、氯仿、石油醚等亲脂性有机溶剂[14]。游离黄酮及黄酮苷一般都含酚羟基,故都可溶于碱中,加酸后又沉淀出来,可利用此性质提取、分离黄酮类化合物[15]。本研究利用黄酮类化合物易溶于乙醇的特性,采用不同浓度和条件对其进行提纯。
大孔吸附树脂为吸附和筛选原理相结合的分离材料,其吸附力与树脂的比表面积、表面电性、能否与被吸附物形成氢键等有关,筛选原理是由于本身多孔性结构所决定[16]。在确定分离条件时,首先根据黄酮类化合物分子体积大小选择了相适应的大孔吸附树脂,其次根据黄酮类化合物中含有酚羟基确定了树脂的型号(AB-8)和分离条件。洗脱剂选择了最常用且极性较小的乙醇,因为对非极性的大孔吸附树脂,洗脱剂极性越小,洗脱能力越强[17]。
本研究利用AB-8型大孔树脂对锁阳提取液纯化后,黄酮类化合物(即总黄酮)纯度达到97.278%,比洗脱量可达到53.164 mg/g。表明AB-8型大孔树脂对锁阳总黄酮具有极好的吸附性能,用其纯化锁阳黄酮类化合物是可行的。同时,由于AB-8型大孔吸附树脂具有吸附快、吸附容量大、洗脱率高、再生简单、能多次重复使用等优点[18],而且本试验具有设计简单易操作,药品普通易配备,方法标准易实现等明显优势,因此具有较高的重现性。
综合评价,AB-8型大孔吸附树脂对锁阳总黄酮吸附性能和解吸性能均好,具有较高的比吸附量、吸附速度和比洗脱量,且纯化能力极强。说明弱极性的树脂适合用于锁阳总黄酮的分离纯化。为使树脂吸附法成功地应用于工业化生产,除选用性能优良的吸附剂外,还要配合最佳的动态条件,才能获得满意的纯化产物和分离效率,对此还需要进一步研究。
[1]张勇,李彩霞,李鹏,等.醇法提取锁阳中总黄酮的研究[J].甘肃科学学报,2005,17(1):41-43.
[2]李宝兰,张咏梅,卢小康,等.苜蓿总黄酮对小鼠脂类代谢及氧自由基的影响[J].草业科学,2009,26(8):93-96.
[3]张佳,李志忠,张丙云.锁阳的功能研究及产品开发[J].甘肃科技,2006,22(8):204-206.
[4]朱见明,李娜,张亚军,等.苜蓿黄酮的研究进展[J].草业科学,2009,26(9):156-162.
[5]杨红.中药化学实用技术[M].北京:化学工业出版社,2004.
[6]Beret A,Cazenave J P.The Effect of flavonoids on blood-vessel wall interactions[J].Progress in Clinical and Biological Research,1988,280:187-200.
[7]Qin Y,Zhu Z Y,Chen Z Y.Interaction between flavonoids and alpha-tocopherol in human low density lipoprotein[J].The Journal of Nutritional Biochemistry,2000,11:14-21.
[8]侯飞燕,李菁.中药提取现代新技术研究进展[J].中医药导报,2011,17(1):101-103.
[9]孟磊,张相年,赵树进.现代生化技术在中药有效成分提取中的应用[J].药物生物技术,2005,12(2):130-133.
[10]卢艳花.中药有效成分提取分离技术[M].北京:化学工业出版社,2005:87.
[11]武正才,梁晓原,缪菊莲,等.超临界CO2萃取灯盏花中总黄酮成分的工艺研究[J].云南中医学院学报,2004,27(2):34-36.
[12]王文星,安琪,汪莹,等.瑞香狼毒细胞悬浮培养及黄酮积累的研究[J].草业学报,2010,19(6):132-139.
[13]杨星昊,刘海,丁安伟.大孔吸附树脂分离纯化小蓟总黄酮的研究[J].浙江中医杂志,2006,41(1):50-52.
[14]毕丽君,李慧.水芹中总黄酮类化合物最佳提取工艺的研究[J].食品科学,1999(12):35-37.
[15]Harborne J B.黄酮类化合物[M].戴伦凯,译.北京:科学出版社,1983.
[16]李萍.大孔吸附树脂在中草药有效成分研究中的应用[J].天津药学,2002,14(3):9-11.
[17]刘中秋.大孔吸附树脂富集保和丸中橙皮昔的工艺研究[J].中成药,2001,23(8):550-554.
[18]Lin M C,Tsai M J,Wen K C.Supercritical fluid extraction of flavonoids from Scutellariae Radix[J].Journal of Chromatography A.1999,830(2):387-395.
