四种蜂蜜中脂肪酸的气相色谱-质谱分析
2011-03-28朱晓玲朱婕妤
朱晓玲,朱婕妤,朱 露,文 红*,刘 睿,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.武汉市蜂产品质量控制工程技术研究中心,湖北 武汉 430070;3.湖北省产品质量监督检验研究院,湖北 武汉 430061)
四种蜂蜜中脂肪酸的气相色谱-质谱分析
朱晓玲1,2,朱婕妤1,2,朱 露1,2,文 红2,3,*,刘 睿1,2,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.武汉市蜂产品质量控制工程技术研究中心,湖北 武汉 430070;3.湖北省产品质量监督检验研究院,湖北 武汉 430061)
对湖北产荆条蜜、紫云英蜜、柑橘蜜、油菜蜜4个蜂蜜品种中的脂肪酸组成和含量进行分析比较。采用乙醚提取蜂蜜中的脂肪酸,再以硫酸-甲醇溶液进行甲酯化处理,通过气相色谱-质谱联用仪分离鉴定其中的脂肪酸组成和相对含量。结果表明,4种蜂蜜中共分离出14种脂肪酸,其中荆条蜜、紫云英蜜及油菜蜜中分别鉴定出8种脂肪酸,柑橘蜜中鉴定出7种脂肪酸,另外,14种脂肪酸中不饱和脂肪酸占总脂肪酸含量的45.53%~79.31%,饱和脂肪酸占总脂肪酸含量的16.68%~40.77%,4种蜂蜜中均含有棕榈酸和油酸。
蜂蜜;脂肪酸;气相色谱-质谱
蜂蜜是指蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物结合后,经充分酿造而成的天然甜物质[1],是一种传统的天然保健食品,其中富含葡萄糖、果糖,以及酶、维生素、矿物质等多种微量成分[2],营养十分丰富,具有较好的生理功能和药理活性[3]。
我国是世界养蜂大国,我国的蜂群数量和蜂蜜产量均居世界首位,蜂蜜出口量和出口额都居世界前列[4]。随着蜂蜜用途的不断扩大以及蜂蜜消费量的逐年增加,对其中各种营养成分、功能因子以及质量安全问题的研究也在不断深入,包括糖的组成与含量[5-6],黄酮[7]、酚酸的种类与含量[8],淀粉酶活性[9],羟甲基糠醛含量[10],抗生素[11]、农药残留[12]等,但对于蜂蜜中脂肪酸的研究报道较少[13]。脂肪酸作为蜂蜜中的微量生物活性成分之一,不仅可使蜂蜜保持酸性抑制微生物的生长繁殖,更重要的是能以此构建蜂蜜指纹图谱判定蜂蜜的植物来源,鉴定蜂蜜的真伪。目前,国外已有学者对蜂蜜中脂肪酸的指纹图谱构建以及特征标记物的分析进行初步研究,Wilkins等[14]对新西兰蜂蜜的脂肪族二元酸进行了分析,通过对200个新西兰蜂蜜样品进行研究,发现其中的2-甲基-丁二酸和4-羟基-3-甲基-反式-2-戊烯二酸仅存在于新西兰金银花蜜(rewarewa honey)中,可作为新西兰金银花蜜的标记物。本研究主要对湖北产荆条蜜、紫云英蜜、柑橘蜜、油菜蜜中的脂肪酸通过气相色谱-质谱(gas chromatography-mass spectrometry,GCMS)联用法进行分析、鉴定,并比较其中的脂肪酸组成和含量情况,为蜂蜜脂肪酸指纹图谱的建立积累数据和提供相关依据,并为评价蜂蜜的保健和营养价值提供参考。
1 材料与方法
1.1 材料与试剂
湖北产荆条蜜、紫云英蜜、柑橘蜜、油菜蜜为湖北省武汉市小蜜蜂食品有限公司提供,并经其鉴定为单花蜂蜜。
无水乙醚、硫酸、无水甲醇(均为分析纯) 国药集团化学试剂有限公司;水为二次蒸馏水。
1.2 仪器与设备
6890N/5973-GC/MSD型气相色谱-质谱联用仪 美国安捷伦仪器公司;多功能搅拌器、HH-4数显恒温水浴锅 常州国华电器有限公司;BL310电子天平 德国赛多利斯公司。
1.3 样品处理
分别准确称取荆条蜜、紫云英蜜、柑橘蜜、油菜蜜10~15g于500mL烧杯中,加蒸馏水300mL,电动搅拌15min,待混合均匀后移至500mL分液漏斗中,加入100mL无水乙醚,振摇后静置分层,收集有机相,下层水溶液用乙醚重复萃取两次,合并乙醚层,挥发浓缩至1mL。
1.4 脂肪酸的甲酯化
将上述乙醚提取物转至刻度试管中,加入2mL 1%的硫酸-甲醇溶液,在50℃恒温水浴中保温40min,其间每隔5~8min摇晃一次,取出冷却至室温,加入3mL蒸馏水及2mL无水乙醚,振荡分层,取上层清液,待GC-MS分析。
1.5 GC-MS分析条件
1.5.1 气相色谱条件
色谱柱:HP-5弹性石英毛细管柱(30m×0.25mm,0.25μm);升温程序:40℃保持3min,以6℃/min升至280℃,保持15min;汽化温度:250℃;不分流进样,进样量1μL;溶剂延迟:3min;载气(He)流量:1mL/ min。
1.5.2 质谱条件
电子轰击(electron impact,EI)离子源;电子能量70eV;灯丝发热电流0.25mA;电子倍增器电压1000V;离子源温度:200℃;接口温度:250℃;质量扫描范围:m/z40~550。
1.6 测定方法
1.6.1 定性分析
取经1.3、1.4节处理的样品1μL,用气相色谱-质谱联用仪进行分析鉴定。通过G170LBA 化学工作站数据处理系统及NIST98标准质谱谱库做数据处理和化合物检索,根据与质谱谱库中质谱数据匹配度的大小和脂肪酸甲酯的质谱断裂规律,结合人工质谱解析确定样品中各化学成分。
1.6.2 定量分析
通过G170LBA化学工作站数据处理系统,按峰面积归一化法进行定量分析,分别求得各化学成分的相对含量。
2 结果与分析
2.1 脂肪酸定性分析

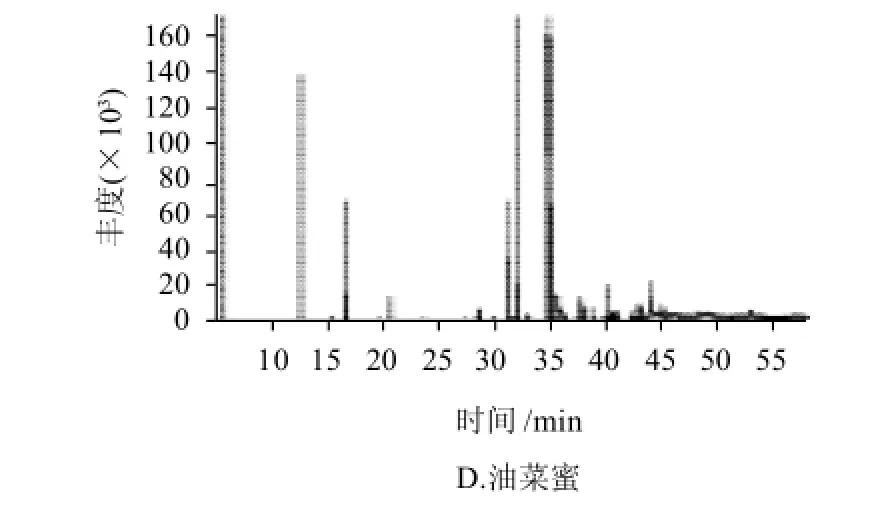
图1 4种蜂蜜中脂肪酸的GC-MS总离子流图Fig.1 Total ion current GC-MS chromatogram of fatty acids in 4 kinds of honey
4种蜂蜜中脂肪酸甲酯的总离子流如图1所示。按面积归一化法进行定量分析,蜂蜜中的脂肪酸及各脂肪酸的相对含量列于表1~4。

表1 荆条蜜中脂肪酸的鉴定结果Table 1 Fatty acids and their relative contents identified in chaste tree honey

表2 紫云英蜜中脂肪酸的鉴定结果Table 2 Fatty acids and their relative contents identified in clover honey

表3 柑橘蜜中脂肪酸的鉴定结果Table 3 Fatty acids and their relative contents identified in citrus honey

表4 油菜蜜中脂肪酸的鉴定结果Table 4 Fatty acids and their relative contents identified in rape honey
由表1~4可知,经计算机检索得到4种植物源蜂蜜中所含化合物的组成情况,但表中部分化合物的相似度较低,仅仅通过质谱匹配将很难对其进行准确定性,如表2中保留时间(retention time,RT) 32.718min的色谱峰所对应化合物的相似度为64%,表3中RT 32.684min的色谱峰所对应化合物的相似度为59%等,因此本实验对表1~4中相似度较低(小于90%)的物质所对应的质谱图进行人工解析以达到准确定性的目的。根据脂肪酸甲酯的裂解规律,采用特征碎片离子对脂肪酸甲酯碳数及双键数目加以确认。沈宏林等[15-16]指出在脂肪酸碎裂过程中具有以下质谱特征:饱和脂肪酸酯易发生C—C键断裂失去烃基(—C3H7),得到[M-43]+的离子,同时易发生麦氏重排给出m/z 74(—CH3OC(OH)=CH2)的碎片离子,以十六烷酸甲酯为例的质谱碎裂具体过程见图2。

图2 十六烷酸甲酯碎裂途径[16]Fig.2 Fragmentation pathway of palmitic acid methyl ester
另外,单不饱和脂肪酸酯易发生γ氢转移及i诱导断裂产生[M-32]+离子,并同时双键迁移发生α断裂产生-C4H7+的碎片离子m/z 55;双不饱和脂肪酸酯易发生羰基α断裂产生[M-31]+离子,双键迁移进行α断裂产生-C5H7+的碎片离子m/z 67[15-16]。
因此,本实验根据上述脂肪酸甲酯的质谱碎裂特征规律及相关文献[15-16]中脂肪酸甲酯的碎片离子特征,对表1~4中相似度低于90%的物质进行解析,其中表2中相似度为89%的RT 35.542min色谱峰所对应物质的质谱图见图3。

图3 表2中RT 35.542min色谱峰的质谱图Fig.3 Mass spectrum of the fraction with retention time of 35.542 min in Table 2
由图3可知,此物质的主要碎片离子为m/z 74、87、143、199、255、298,基峰离子为m/z 74,并同时出现m/z 255,即[M-43]+碎片离子,根据上述脂肪酸甲酯质谱碎裂特征可见,此物质质谱碎片中出现了饱和脂肪酸甲酯的特征碎片,因此可初步判断其为饱和脂肪酸甲酯,由分子离子峰298,可初步计算此物质为C17H35COOCH3,即所对应的化合物为C17H35COOH(十八烷酸)。为进一步确认其结构,结合脂肪酸甲酯裂解的主要碎片离子产生机理对质谱图中的主要碎片离子进行解析,解析结果见表5。从表5可找出各个碎片离子的具体归属,即可进一步判断其为十八烷酸甲酯。

表5 表2中RT 35.542min色谱峰的主要质谱碎片离子解析Table 5 Analysis of major MS fragment ions from the fraction with retention time of 35.542 min in Table 2
表3中相似度为86%的色谱峰(RT 30.796min)对应物质的主要碎片离子为m/z 55、74、98、125、138、157、199,与CAS数据库中报道的癸二酸二甲酯的主要碎片离子相同,因此可判断其为癸二酸二甲酯,所对应的化合物为癸二酸;表2中相似度为64%的色谱峰(RT 32.718min)所对应物质的质谱主要碎片离子为m/z 57、71、85、97、101,基峰离子为m/z 57,未出现脂肪酸甲酯的特征碎片离子,因此可判断其不是脂肪酸甲酯;同理,可得出表3中RT 32.684m in色谱峰所对应物质及表4中RT 40.277min色谱峰所对应物质均不是脂肪酸甲酯。
由此可见,通过计算机检索以及人工解析,在四种蜂蜜中共鉴定出14种脂肪酸,其中荆条蜜、紫云英蜜及油菜蜜中分别鉴定出8种脂肪酸,柑橘蜜中共鉴定出7种脂肪酸,4种蜂蜜中均含有十六烷酸(棕榈酸)、顺-9-十八碳烯酸(油酸)。
2.24 种蜂蜜脂肪酸组成的定量分析
2.2.1 荆条蜜中脂肪酸定量分析
通过上述定性分析及计算机工作站数据处理系统按面积归一化法所得各组分的含量,可知荆条蜜中脂肪酸含量占检出物质总量的65.59%,其中直链饱和脂肪酸占总脂肪酸含量的40.77%,主要是棕榈酸和十八烷酸(硬脂酸),分别占总脂肪酸含量的21.33%和18.16%;不饱和脂肪酸占总脂肪酸含量的57.97%,主要为反式-9-十八碳烯酸(反油酸)和油酸,分别占总脂肪酸含量的46.65%和4.37%;另外,还含有少量苯甲酸,占总脂肪酸含量的1.26%。
2.2.2 紫云英蜜中脂肪酸定量分析
紫云英蜜中脂肪酸含量占检出物质总量的42.56%,其中饱和脂肪酸占总脂肪酸含量的30.85%,主要由棕榈酸、硬脂酸和十七烷酸组成,分别占总脂肪酸含量的16.60%、8.23%和3.31%;不饱和脂肪酸占总脂肪酸含量的69.15%,主要是油酸、8-十八碳烯酸和8,11-十八碳二烯酸,分别占总脂肪酸含量的26.46%、37.30%和5.39%。
2.2.3 柑橘蜜中脂肪酸定量分析
柑橘蜜中脂肪酸含量占检出物质总量的29.87%,其中直链饱和脂肪酸和不饱和脂肪酸分别占总脂肪酸含量的38.71%、45.53%,主要为棕榈酸(占总脂肪酸含量的21.15%)、十七烷酸(占总脂肪酸含量的8.44%)、反油酸(占总脂肪酸含量的27.89%)、油酸(占总脂肪酸含量的14.74%)。另外,还含苯甲酸,占总脂肪酸含量的15.77%。
2.2.4 油菜蜜中脂肪酸定量分析
油菜蜜中脂肪酸含量占检出物质总量的64.22%,其中直链饱和脂肪酸占总脂肪酸含量的16.68%,主要含棕榈酸(占总脂肪酸含量的13.39%)、硬脂酸(占总脂肪酸含量的3.28%);不饱和脂肪酸占总脂肪酸含量的79.31%,主要为7-十八烯酸(占总脂肪酸含量的65.18%)、8,11-十八碳二烯酸(占总脂肪酸含量的9.72%)、油酸(占总脂肪酸含量的4.41%);另外,还含苯甲酸占总脂肪酸含量的3.91 %。
通过对湖北产4种不同植物源蜂蜜脂肪酸组成进行分析,共鉴定出14种脂肪酸,其中含量较高的包括棕榈酸、硬脂酸、反油酸、油酸、8-十八碳烯酸、7-十八碳烯酸;4个蜂蜜品种中均含有棕榈酸和油酸,其中棕榈酸含量最高的是荆条蜜,含量达21.33%,油酸含量最高的是紫云英蜜,含量达26.46%。另外,在荆条蜜及柑橘蜜中鉴定出反油酸且含量较高,而在另外两种蜜中未检出;在荆条蜜、柑橘蜜及油菜蜜中鉴定出苯甲酸,而紫云英蜜中未出现;在油菜蜜中还检出少量二十烷酸(花生酸),另外3种蜜中均未检出,表明不同植物源蜂蜜中脂肪酸在组成及含量上均存在一定的差异。
4种蜂蜜中除柑橘蜜中不饱和脂肪酸含量占总脂肪酸的45.53%,其他蜂蜜中不饱和脂肪酸所占比例均在50%以上,主要以7-十八烯酸、8-十八碳烯酸和油酸为主;其中不饱和脂肪酸含量最高的是油菜蜜,含量达79.31%,其次是紫云英蜜,含量达69.15%。而4种蜂蜜中饱和脂肪酸以棕榈酸、硬脂酸为主,含量最高的是荆条蜜,其占总脂肪酸含量的40.77%。另外,在荆条蜜、柑橘蜜及油菜蜜中鉴定出苯甲酸,含量最高的是柑橘蜜,占总脂肪酸含量的15.7%。
3 结 论
本研究采用乙醚提取蜂蜜中的脂肪酸,经甲酯化处理,用气相色谱-质谱联用仪分析,荆条蜜、紫云英蜜、柑橘蜜、油菜蜜4种蜂蜜中共鉴定出14种脂肪酸,荆条蜜、紫云英蜜及油菜蜜中分别含有8种,柑橘蜜中含有7种。其中油菜蜜中不饱和脂肪酸含量最高,达79.31%,荆条蜜中饱和脂肪酸含量最高,达40.77%,4种蜂蜜中均含有棕榈酸和油酸,荆条蜜、柑橘蜜及油菜蜜中均含有苯甲酸,另外还含有其他种类的含量较少的脂肪酸如:油菜蜜中含有花生酸占总脂肪酸的0.46%等。研究表明:不同植物源蜂蜜中脂肪酸在组成及含量上均存在一定的差异。本研究可为蜂蜜中脂肪酸指纹图谱的建立提供数据积累和研究依据。
[1]中华全国供销合作总社. GB/T 18796—2005 蜂蜜[S]. 北京∶ 中国标准出版社, 2005.
[2]张坚, 刘凤云, 许子俊, 等. 青海省油菜花蜂蜜营养成分的研究[J].营养学报, 1995, 17(2)∶ 234-237.
[3]朱威, 胡福良. 蜂蜜中的抗菌成分及其抗菌机理[J]. 蜂蜜杂志, 2003, 23(6)∶ 5-6.
[4]董捷, 孙丽萍, 闫继红. 我国养蜂业的发展及面向WTO的机遇与挑战[J]. 养蜂科技, 2004(1)∶ 4-5.
[5]阎政礼, 杨明生, 李添宝, 等. 蜂蜜中葡萄糖、果糖和蔗糖NMR定量分析研究[J]. 食品科学, 2009, 30(14)∶ 253-255.
[6]SALIM O, PAUL S, BEY M B, et al. HPLC sugar profiles of Algerian honeys[J]. Food Chemistry, 2010, 121(2)∶ 561-568.
[7]PYRZYNSKA K, BIESAGA M. Analysis of phenolic acids and fiavonoids in honey[J]. Trends in Analytical Chemistry, 2009, 28(7)∶ 893-902.
[8]曹炜, 陈卫军, 宋纪蓉. 不同种类蜂蜜总酚酸含量测定和抗氧化作用的研究[J]. 食品科学, 2005, 26(1)∶ 48-51.
[9]张传慧, 刘春云, 黄腾飞. 影响蜂蜜淀粉酶活性的研究[J]. 安徽农业科学, 1999, 27(4)∶ 413-414.
[10]ZAPPALA M, FALLICO B, ARENA E, et al. Methods for the determination of HMF in honey∶ a comparison[J]. Food Control, 2005, 16(3)∶273-277.
[11]陈天豹, 邓文汉, 卢菀华, 等. 毛细管电泳法检测蜂蜜中残留的抗生素[J]. 色谱, 2001, 19(1)∶ 91-93.
[12]林竹光, 金珍, 马玉, 等. 气相色谱-质谱法分析蜂蜜中多种有机氯农药残留[J]. 分析试验室, 2006, 25(6)∶ 12-17.
[13]CUEVAS-GLORY L F, PINO J A, SANTIAGO L S, et al. A review of volatile analytical methods for determining the botanical origin of honey [J]. Food Chemistry, 2007, 103(3)∶ 1032-1043.
[14]WILKINS A L, LU Yinrong, TAN S T. Extractives from New Zealand honeys.5.aliphatic dicarboxylic acids in New Zealand rewarewa (Knightea eχcelsa) honey[J]. J Agric Food Chem, 1995, 43(12)∶ 3021-3025.
[15]沈宏林, 向能军. 枸杞子脂肪酸成分的GC/MS分析[J]. 质谱学报, 2009, 30(2)∶ 99-104.
[16]沈宏林, 向能军, 高茜, 等. 气相色谱-质谱法分析苦杏仁中脂肪酸成分[J]. 理化检验∶ 化学分册, 2009, 45(11)∶ 1302-1307.
GC-MS Analysis of Fatty Acids in Four Kinds of Honey
ZHU Xiao-ling1,2,ZHU Jie-yu1,2,ZHU Lu1,2, WEN Hong2,3,*,LIU Rui1,2,*
(1. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China;2. Wuhan Research Center on Quality Control Engineering of Bee Products, Wuhan 430070, China;3. Hubei Provincial Supervision and Inspection Research Institute for Product Quality, Wuhan 430061, China)
The composition and contents of fatty acids in four kinds of honey such as chaste tree honey, clover honey, citrus honey and rape honey collected from Hubei province were comparatively analyzed. Fatty acids were extracted by ether and esterified with 1% sulfuric acid-methanol, and then analyzed by gas chromatography-mass spectrometry (GC-MS). Totally 14 fatty acids were identified in four kinds of honey, of which 8 were isolated from chaste tree honey, clover honey and rape honey, and 7 were isolated from citrus honey. Moreover, the content of unsaturated fatty acids accounted for 45.53%-79.31% of total fatty acids, while saturated fatty acids accounted for 16.68%-40.77 %. Palmitic acid and oleic acid were detected in each kind of honey.
honey;fatty acid;gas chromatography-mass spectrometry (GC-MS)
TS207.3
A
1002-6630(2011)16-0338-05
2010-12-08
武汉市科技局工程技术研究中心项目(200920137007);中央高校基本科研业务费专项资金资助项目(200922;2010PY015);华中农业大学校SRF项目(A059)
朱晓玲(1987—),女,硕士,研究方向为蜂产品加工及蜂产品质量控制。E-mail:chuandian1987@yahoo.com.cn
*通信作者:文红(1971—),女,高级工程师,硕士,研究方向为食品质量分析。E-mail:wen_red@sina.com刘睿(1969—),男,副教授,博士,研究方向为蜂产品加工及蜂产品质量控制。E-mail:liurui@mail.hzau.edu.cn
