饲粮添加25-羟基维生素D3对轮状病毒攻毒和未攻毒断奶仔猪血清和肠内容物抗体和细胞因子水平的影响
2011-03-28张克英丁雪梅徐志文白世平
廖 波 张克英* 丁雪梅 徐志文 白世平
腹泻是断奶仔猪生产中危害较大的疾病,严重危害仔猪生产。断奶时期免疫功能低下、消化道发育不完善是仔猪对病原体抵抗差,易发生肠道疾病的重要原因[1-5]。因此,如何通过营养措施调节免疫反应来对抗疾病,从而实现提高仔猪生产的目的成为动物营养学研究的热点。近30年的研究证实,维生素D3,主要是其激素活性形式1,25-二羟基维生素D3[1,25-(OH)2-D3],不仅在传统钙磷稳衡中发挥着重要作用,在调节动物机体的免疫反应中也起着重要作用[6]。1,25-(OH)2-D3能调节T细胞、B细胞和巨噬细胞的分化、成熟、分泌细胞因子和免疫球蛋白[7-10]。在畜禽上的研究显示,1,25-(OH)2-D3对猪[11-12]和牛[13]的免疫功能有重要影响。25-OH-D 3是维生素D3在饲料生产中的最新应用形式,与普通的维生素D 3相比在吸收转运方面有突出的优势[14]。因此,在断奶仔猪饲粮中添加25-OH-D3是否能更好地发挥维生素D3的免疫调节功能值得研究。本试验拟在轮状病毒感染断奶仔猪的条件下,研究饲粮添加高水平的25-OH-D 3对断奶仔猪血清和肠内容物抗体和细胞因子水平的影响,旨在为25-OH-D3在仔猪饲粮中的应用提供参考。
1 材料与方法
1.1 试验材料
1.25 %25-OH-D3(1 μg=40 IU,DSM)、其他单体维生素(Bayer)、MEM 液(Gibco)、胰蛋白酶抑制剂(Sigma)、亮抑蛋白酶肽(Sigma)。
1.2 试验动物及饲粮
试验动物选用48头28日龄断奶的平均体重为(7.35±0.75)kg的杜长大三元杂交仔猪。试验饲粮参照美国NRC(1998)5~10 kg阶段生长猪的营养需要配合成粉状全价料,基础饲粮组成及营养水平见表1。对照组饲粮添加 220 IU/kg(5.5μg/kg)的25-OH-D3,试验组饲粮添加2 200 IU/kg(55.0μg/kg)的 25-OH-D3(为 NRC推荐量的10倍)。
1.3 试验设计与饲养管理
试验采用2×2双因子设计,C-、C+组分别为未攻毒和攻毒对照组,T-、T+组分别为未攻毒和攻毒试验组。所选仔猪按体重相近原则随机分配到4个组中(每组12个重复,每个重复1头猪),单笼饲养,未攻毒处理和攻毒处理各饲养在1间隔离环境控室内。试验期21 d。舍内温度保持在25~28℃。饲养管理按常规饲养管理进行,仔猪自由采食饮水。
1.4 病毒接种
攻毒试验采用的病毒为人轮状病毒(HRV)Wa株,由四川农业大学动物生物技术中心提供。在试验第0天08:00,攻毒处理的每头仔猪用注射器灌服轮状病毒1 mL(轮状病毒浓度为 1×106TCID 50/mL),未攻毒处理的每头仔猪用同样方式灌服同体积MEM液。
1.5 样品采集与制备
在试验第0、5、15、21 天的 08:00,每组分别随机选取6、12、8、4头仔猪,从前腔静脉采血10 mL,3 000 r/min离心10 min取血清,-20℃保存。采血前1天20:00停喂饲粮,使仔猪空腹12 h。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
在试验第5、15、21天分 3次进行屠宰,每次屠宰每组取4头仔猪。在屠宰前,将各组的仔猪按体重相近原则分为3个小组,随机选取1个小组的仔猪进行屠宰。屠宰前1天20:00停喂饲粮,使仔猪空腹12 h。屠宰试验在08:00点开始,通过前腔静脉注射过量戊巴比妥钠(1 mL/kg BW,戊巴比妥钠浓度为1 g/mL)致死仔猪。分别在十二指肠和回盲结节处末端结扎,收集回肠内容物(IC),用MEM液按IC:MEM 液为1∶2的比例稀释IC,加入胰蛋白酶抑制剂 250μg/mL、亮抑蛋白酶肽50μg/mL,以防细胞因子等成分的降解[15],将IC-20℃保存。
1.6 测定指标与方法
血清和IC中的免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、免疫球蛋白 A(IgA)含量采用IgG&A&M试剂盒(Maker)测定,轮状病毒抗体(RV-Ab)水平采用猪轮状病毒抗体酶联免疫吸附试剂盒(ADL)测定,细胞因子白介素-2(IL-2)、白介素-4(IL-4)、白介素 -6(IL-6)、干扰素-γ(IFN-γ)水平采用猪细胞因子酶联免疫吸附试剂盒(ADL)测定。
1.7 数据处理与分析
结果以平均值±标准误表示,数据采用SPSS 13.0软件的GLM的Univariate法进行互作分析,然后进行Duncan氏多重比较,以 P<0.01(极显著),P<0.05(显著)作为差异显著性判断标准。
2 结 果
2.1 抗体
2.1.1 血清IgG、IgM 、IgA 含量
由表2可知,饲粮添加10倍 NRC推荐量的25-OH-D3显著降低了试验第5天仔猪血清IgG含量(P=0.005)和第5、15天血清IgM(P=0.035,P=0.003)和IgA含量(P=0.008,P=0.010)。轮状病毒攻毒显著增加了试验第15天仔猪血清IgG含量(P=0.040)以及第 5、15天血清 IgM(P=0.000,P=0.000)和IgA含量(P=0.002,P=0.043)。25-OH-D3与轮状病毒的交互作用对试验期内各阶段仔猪血清IgG含量均无显著影响(P>0.05),但对试验第15天血清IgM(P=0.000)和IgA含量(P=0.038)有显著影响。

表2 血清IgG、IgM和IgA含量Table 2 IgG,IgM and IgA contents in serum mg/m L
2.1.2 肠内容物IgG、IgM、IgA含量
由表3可知,饲粮添加10倍NRC推荐量的25-OH-D 3有提高仔猪肠内容物IgG、IgM、IgA含量的作用,但作用不显著(P>0.05)。轮状病毒攻毒显著增加了试验第15天仔猪肠内容物IgG(P=0.046)、IgA 含量(P=0.042)。25-OH-D3与轮状病毒的交互作用对试验期内各阶段仔猪肠内容物IgG、IgM、IgA含量都没有显著影响(P>0.05)。
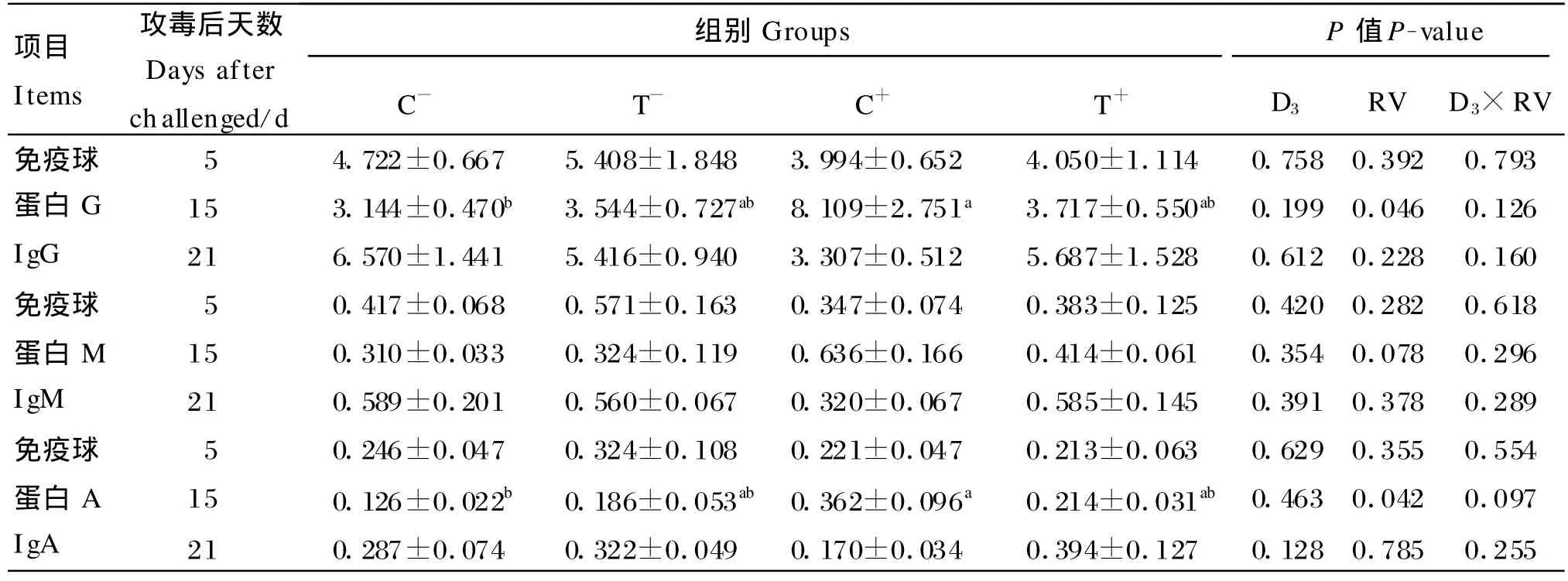
表3 肠内容物IgG、IgM和IgA含量Table 3 IgG,IgM and IgA contents in intestinal contents mg/m L
2.1.3 血清和肠内容物RV-Ab水平
由表4可知,饲粮添加10倍NRC推荐量的25-OH-D3显著提高了试验第5、21天仔猪血清(P=0.018,P=0.002)和肠内容物(P=0.005,P=0.045)RV-Ab水平。轮状病毒攻毒显著增加了试验第5、15、21天仔猪血清(P=0.000,P=0.001,P=0.000)和肠内容物(P=0.000,P=0.000,P=0.000)RV-Ab水平。25-OH-D3与轮状病毒的交互作用对试验第5、21天仔猪血清(P=0.016、P=0.001)和肠内容物(P=0.010、P=0.009)RV-Ab水平有显著影响。
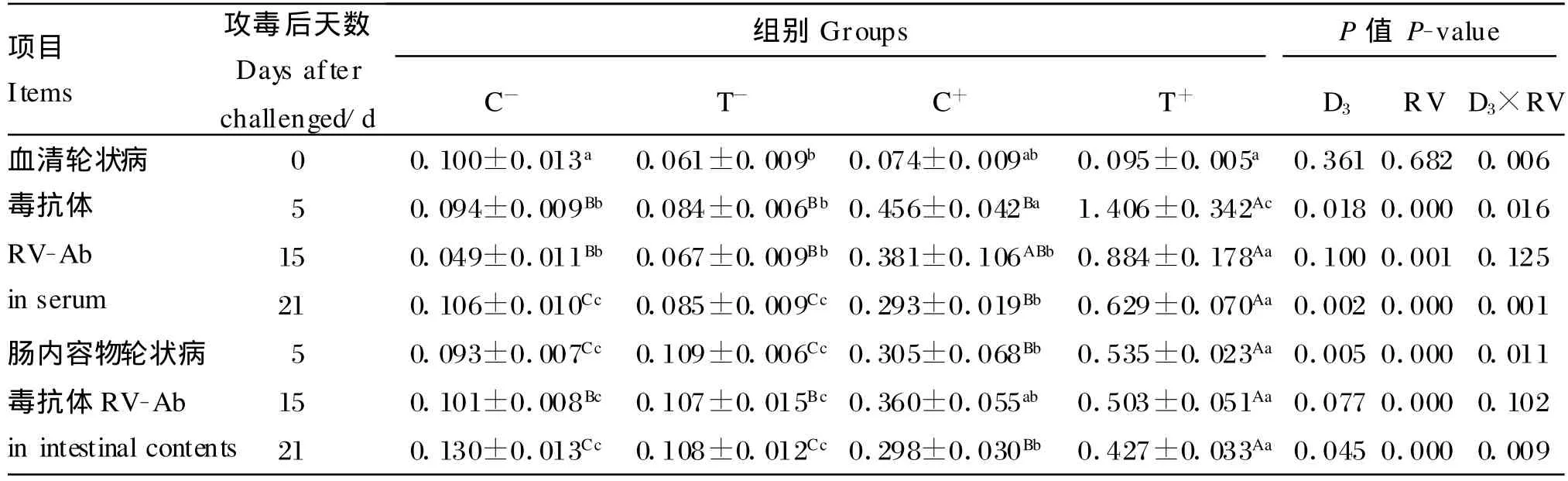
表4 血清和肠内容物轮状病毒抗体水平Table 4 Rotavirus antibody level in serum and intestinal contents IU/m L
2.2 细胞因子
2.2.1 血清细胞因子水平
由表5可知,饲粮添加10倍NRC推荐量的25-OH-D3显著提高了试验第5天仔猪血清IL-4水平(P=0.001),对血清 IL-2 、IL-6、IFN-γ水平无显著影响(P>0.05)。轮状病毒攻毒显著增加了试验第5天仔猪血清IL-2水平(P=0.009)和第15天血清IL-6水平(P=0.006),对血清IL-4、IFN-γ水平无显著影响(P>0.05)。25-OH-D 3与轮状病毒的交互作用对各阶段仔猪血清IL-2、IL-4、IL-6、IFN-γ水平均无显著影响(P>0.05)。
2.2.2 肠内容物细胞因子水平
由表6可知,饲粮添加10倍 NRC推荐量的25-OH-D3显著提高了试验第15天仔猪肠内容物IL-4水平(P=0.001),显著降低了第5、15天肠内容物IL-6水平(P=0.013,P=0.022)和第15天肠内容物IFN-γ水平(P=0.030)。轮状病毒攻毒显著降低了试验第15天仔猪肠内容物IL-4水平(P=0.017),对肠内容物 IL-2、IFN-γ、IL-6水平无显著影响(P>0.05)。25-OH-D 与轮状病毒的交互作用对试验期内各阶段仔猪肠内容物IL-2、IL-6、IFN-γ水平均无显著影响(P>0.05),但对试验第15天肠内容物IL-4水平有显著影响(P=0.047)。
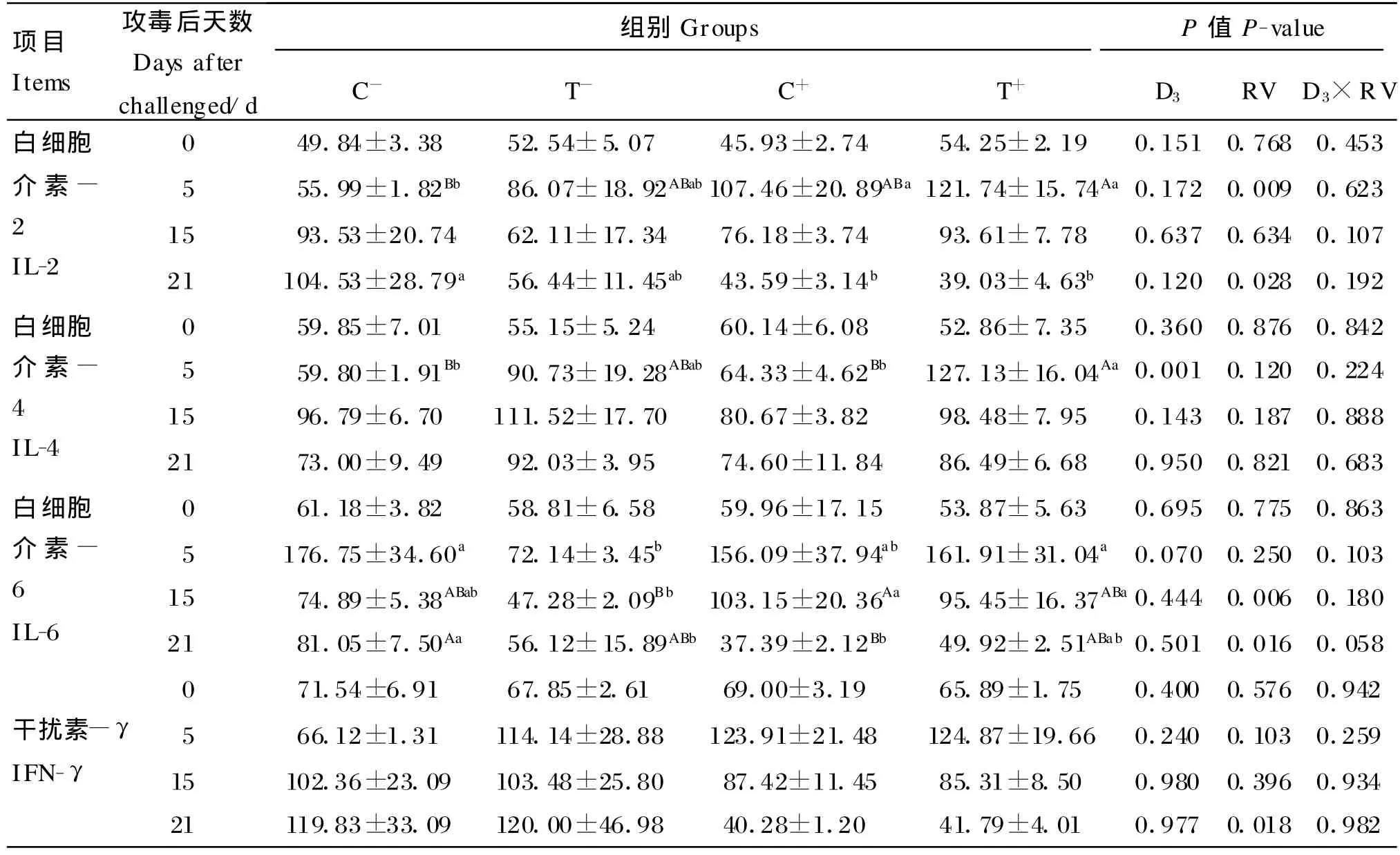
表5 血清细胞因子水平Table 5 Cytokine levels in serum pg/m L
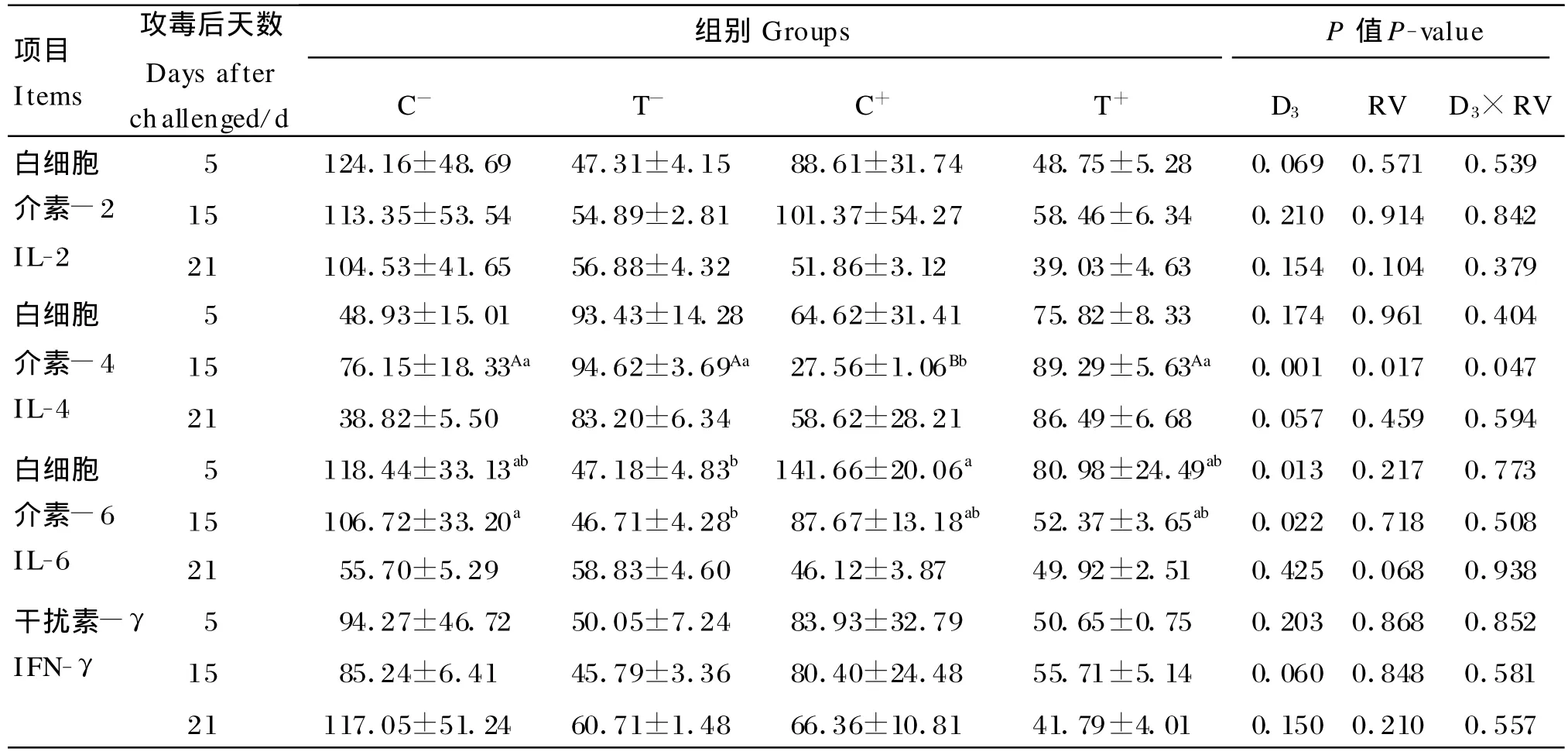
表6 肠内容物细胞因子水平Table 6 Cytokine levels in intestinal contents pg/m L
3 讨 论
3.1 饲粮添加25-OH-D3对轮状病毒攻毒和未攻毒断奶仔猪血清和肠内容物抗体水平的影响
维生素D3主要调节细胞免疫,但对体液免疫和抗体的分泌也有很强的调节作用。Reinhardt等[13]将1α,25-二羟基维生素D3[1α,25-(OH)2-D3]作为免疫佐剂显著提高了乳中埃希氏大肠杆菌IgG、IgM、IgA 抗体水平 。Van der Stede等[16]给仔猪肌肉注射1α,25-(OH)2-D3和人血清白蛋白,同样使特异抗体水平升高。这些研究表明,维生素D3能提高动物抗原特异抗体水平。本试验结果显示,饲粮中添加2 200 IU/kg的25-OH-D3显著提高了断奶仔猪血清和肠内容物RV-Ab水平,对肠内容物IgG、IgM、IgA的产生也有促进作用,但抑制仔猪血清IgG、IgM、IgA的产生。本试验中,未攻毒试验组仔猪血清IgG、IgM、IgA含量在试验第5天后有低于未攻毒对照组的趋势;攻毒试验组仔猪血清IgG、IgM、IgA含量也较攻毒对照组低,只相当于未攻毒对照组水平。上述结果表明,饲粮添加高水平25-OH-D3有降低未攻毒仔猪血清抗体的作用,这与前人的一些报道一致[17-19]。
轮状病毒感染会提高无菌仔猪体内抗体分泌细胞数量[20-22],从而使仔猪产生大量抗体来对抗病毒感染。本试验中,攻毒同样使断奶仔猪血清RV-Ab水平增加。25-OH-D 3与轮状病毒的交互作用对血清IgM、IgA含量和 RV-Ab水平有显著影响,提示25-OH-D3在仔猪遭受轮状病毒攻毒的强应激条件下作用更明显。
本试验中,25-OH-D3降低了断奶仔猪血清总抗体水平,促进肠内容物总抗体分泌,对仔猪体内血清和肠内容物总抗体表现出不同的作用方式,可能与本试验采用的从胃肠道系统攻毒的方式有关。黏膜免疫系统对病原体的防御应答主要取决于抗原刺激后功能性淋巴细胞源源不断由感应部位转移至效应部位[23],使消除效应更为集中。本试验中,仔猪接触病原体和发生免疫反应的部位主要是胃肠道黏膜组织,因此,为了对抗胃肠道受到的病原攻击,仔猪体内包括外周血的大量淋巴细胞迁移到肠道免疫效应部位,在肠道内产生强烈的免疫应答。
3.2 饲粮添加25-OH-D3对轮状病毒攻毒和未攻毒断奶仔猪血清和肠内容物细胞因子水平的影响
IL-2、IFN-γ是 Th1型细胞因子,在 CD4+淋巴细胞参与Th1免疫反应中发挥重要调节作用。IL-4、IL-6是Th2型细胞因子,在CD4+细胞介导的Th2免疫反应中发挥重要调节作用,如促进B细胞产生抗体。辅助T淋巴细胞及其分泌的细胞因子之间有自我加强效应,而分别对其相对立的细胞亚型具有抑制作用[23]。众多研究都一致发现维生素D3可抑制IL-2[24-26]、IFN-γ的产生[27-28]。维生素D3对IL-4的作用在各种报道中不尽一致,大多数研究发现维生素D3促进IL-4的产生[29-31],但也有研究发现1,25-(OH)2-D3抑制极化的初级鼠CD4+细胞产生IL-4[28]。少量研究报道维生素D3抑制IL-6的产生[32]。
Azevedo等[15]的研究发现,感染轮状病毒提高了仔猪血清和肠内容物细胞因子IL-4、IL-6、IFN-γ的水平。本试验中,轮状病毒攻毒提高了试验第5天仔猪血清IL-2、IFN-γ和IL-4水平,第15天血清IL-6水平以及第5天仔猪肠内容物IL-6水平。此结果与 Azevedo等[15]的研究基本一致。本试验结果显示,饲粮中添加2 200 IU/kg的25-OH-D3对断奶仔猪体内细胞因子的影响呈经典的作用模式:提高抗炎症细胞因子IL-4的水平,降低促炎症细胞因子IL-2、IL-6、IFN-γ的水平。上述结果说明25-OH-D 3抑制仔猪Th1型免疫反应,增强Th2型免疫应答。试验还发现,饲粮添加高水平25-OH-D3降低仔猪肠内容物促炎症细胞因子的分泌比其对外周血中的促炎症细胞因子的作用更强烈;同时,25-OH-D3还可提高抗炎症细胞因子的分泌。
4 结 论
①饲粮添加2 200 IU/kg的25-OH-D3显著提高了轮状病毒攻毒断奶仔猪血清和肠内容物RV-Ab水平,对肠内容物IgG、IgM、IgA的产生也有促进作用,但抑制仔猪血清IgG、IgM、IgA的产生。
②饲粮添加2 200 IU/kg的25-OH-D3可以降低轮状病毒攻毒和未攻毒断奶仔猪血清和肠内容物促炎症细胞因子IL-2、IL-6、IFN-γ的分泌并抑制其参与的炎症反应,促进抗炎症细胞因子IL-4的生成并增强其参与的免疫应答,进而表现出提高断奶仔猪抗病力的作用。
[1] BECKER B A,MISFELDT M L.Evaluation of the mitogen-induced prolif eration and cell surf ace differentiation antigens of lymphocytes from pigs 1 to 30 days of age[J].Journal of Animal Science,1993,71(8):2073-2078.
[2] BLECHA F,POLLMANN D S,NICHOLS D A.Weaning pigs at an early age decreases cellular immunity[J].Journal of Animal Science,1983,56(2):396-400.
[3] HAMMERBERG C,SCHURIG G G,OCHS D L.Immunodeficiency in young pigs[J].American Journal of Veterinary Reaseach,1989,50(6):868-874.
[4] WILSON A D,STOKES C R,BOURNE F J.Responses of intraepithelial lymphocytes to T-cell mitogens:a comparison between murine and porcine responses[J].Immunology,1986,58(4):621-625.
[5] STOKES C R,BAILEY M,HAVERSON K,et al.Postnatal development of intestinal immune system in piglets:implications f or the process of weaning[J].Animal Research,2004,53:325-334.
[6] CANTORNA M T,ZHU Y,FROICU M,et al.V itamin D status,1,25-dihydroxyvitamin D3,and the immune system[J].American Journal of Clinical Nutrition,2004,80(6):1717S-1720S.
[7] BINDERUP L.Immunological properties of vitamin D analogues and metabolites[J].Biochemical Pharmacology,1992,43(9):1885-1892.
[8] BOUILLON R,GARMYN M,VERSTUYF A,et al.Paracrine role for calcitriol in the immunesystem and skin creates new therapeutic possibilities for vitamin D analogs[J].European Journal of Endocrinology,1995,133(1):7-16.
[9] HEWISON M.V itamin D and the immune system[J].Journal of Endocrinology,1992,132(2):173-175.
[10] REINHARDT T A,HORST R L,GOFF J P.Calcium,phosphorus,and magnesium homeostasis in ruminants[J].Veterinary Clinics of North America:Food Animal Practice,1988,4(2):331-350.
[11] 李德发,刘焕龙,席鹏彬,等.维生素 D3对断奶仔猪生长性能和免疫机能的影响[J].中国农业大学学报 ,2001,6:87-94.
[12] VAN DER STEDE Y,VERFAILLIE T,COX E,et al.1alpha,25-dihydroxyvitamin D3increases IgA serum antibody responses and IgA antibody-secreting cell numbers in the Peyer's patches of pigs af ter intramuscular immunization[J].Clinical&Experimental Immunology,2004,135(3):380-390.
[13] REINHARDT T A,STABEL J R,GOFF J P.1,25-dihydroxyvitamin D3enhances milk antibody titers to Escherichia coli J5 vaccine[J].Journal of Dairy Science,1999,82(9):1904-1909.
[14] WARD N E.Consideration of vitamin D3absorption may be need[J].Feedstuffs,2004,14:36-37.
[15] AZEVEDO M S P,Y UAN L,POULY S,et al.Cytokine responses in gnotobiotic pigs af ter inf ection with virulent or attenuated human rotavirus[J].Journal of Virology,2006(1):372-382.
[16] VAN DER STEDE Y,COX E,VERDONCK F,et al.Reduced f aecal excretion of F4+-E.coli by the intramuscular immunisation of suckling piglets by the addition of 1alpha,25-dihydroxyvitamin D3or Cp G-oligodeoxynucleotides[J].Vaccine,2003,21:1023-1032.
[17] LEMIRE J M,ADAMSJS,SAKAI R,et al.1alpha,25-dihydroxyvitamin D 3 suppresses proliferation and immunoglobulin production by normal human peripheral blood mononuclear cells[J].The Journal of Clinical Investigation,1984,74(2):657-661.
[18] IHO S,TAKAHASHI T,KURA F,et al.The ef fect of 1,25-dihydroxyvitamin D3on in vitro immunoglobulin production in human Bcells[J].Journal of Immunology,1986,136(12):4427-4431.
[19] LINKER-ISRAELI M,ELSTNER E,KLINENBERG J R,et al.Vitamin D(3)and its synthetic analogs inhibit the spontaneous in vitro immunoglobulin production by SLE-derived PBMC[J].Clinical Immunology,2001,99(1):82-93.
[20] YUAN L,WARD L A,ROSEN B I,et al.Systematic and intestinal antibody-secreting cell responses and correlates of protective immunity to human rotavirus in a gnotobiotic pig model of disease[J].Journal of Virology,1996,70(5):3075-3083.
[21] Y UAN L,KANG S Y,WARD L A,et al.Antibody-secreting cell responses and protective immunity assessed in gnotobiotic pigs inoculated orally or intramuscularly with inactivated human rotavirus[J].Journal of Virology,1998,72(1):330-338.
[22] CHANG K O,VANDAL O H,YUAN L,et al.Antibody-secreting cell responses to rotavirus pro-teins in gnotobiotic pigs inoculated with attenuated or virulent human rotavirus[J].Journal of Clinical M icrobiology,2001,39(8):2807-2813.
[23] 吴玉章,白云,程晓刚.基础免疫学[M].北京:科学技术出版社,2003.
[24] TAKEUCHI A,REDDY G S,KOBAYASHI T,et al.Nuclear factor of activated T cells(NFAT)as a molecular target f or 1alpha,25-dihydroxyvitamin D3-mediated effects[J].Journal of Immunology,1998,160(1):209-218.
[25] SMITH E A,FRANKENBURG E P,GOLDSTEIN SA,et al.Ef fects of long-term administration of vitamin D3analogs to mice[J].Journal of Endocrinology,2000,165(1):163-172.
[26] ALROY I,TOWERS T L,FREEDMAN L P.Transcriptional repression of the interleukin-2 gene by vitamin D3:direct inhibition of NFATp/AP-1 complex formation by a nuclear hormone receptor[J].Molecular and Cellular Biology,1995,15(10):5789-5799.
[27] CIPPITELLI M,SANTONI A.Vitamin D3:atranscriptional modulator of the interferon-gamma gene[J].European Journal of Immunology,1998,28(10):3017-3030.
[28] STAEVA-VIEIRA T P,FREEDMAN L P.1,25-dihydroxyvitamin D3inhibits IFN-gamma and IL-4 levels during in vitro polarization of primary murine CD4+T cells[J].Journal of Immunology,2002,168(3):1181-1189.
[29] BOONSTRA A,BARRAT F J,CRAIN C,et al.1alpha,25-dihydroxyvitamin D3has a direct eff ect on naive CD4(+)T cells to enhance the development of Th2 cells[J].Journal of Immunology,2001,167(9):4974-4980.
[30] CANTORNA M T,WOODWARD W D,HAYES C E,et al.1,25-dihydroxyvitamin D3is a positive regulator for the two anti-encephalitogenic cytokines TGF-beta1 and IL-4[J].Journal of Immunology,1998,160(11):5314-5319.
[31] HAGESTUEN E D,ARRUDA A F,CAMPIGLIA A D.On the improvement of solid-phase extraction room-temperature phosphorimetry for the analysis of polycyclic aromatic hydrocarbons in water samples[J].Talanta,2000,52(4):727-737.
[32] Evans K N,Nguyen L,Chan J,et al.Effects of 25-hydroxyvitamin D3and 1,25-dihydroxyvitamin D3on cytokine production by human decidual cells[J].Biology of Reproduction,2006,75(6):816-822.
