抗草甘膦转基因豆粕对肉仔鸡肠黏膜免疫的影响
2011-03-28谭建庄刘莎莎张宏福卢庆萍萨仁娜杨晓光
谭建庄 刘莎莎,2 孙 哲 张宏福* 卢庆萍 萨仁娜 赵 峰 杨晓光
草甘膦是一种高效低毒的除草剂,主要通过抑制植物体内芳香族氨基酸合成的关键酶——5-烯醇丙酮酸莽草酸 -3-磷酸合成酶(EPSPS)的合成来发挥作用。孟山都公司通过基因工程手段向常规大豆中转入 CP4-EPSPS基因,使大豆能高效表达出 EPSPS,从而使大豆具备了对草甘膦的耐受性,即抗草甘膦转基因大豆(glyphosate-tolerant soybean)。豆粕是我国畜牧养殖业最重要的蛋白质饲料原料之一,目前我国市场上有 70%以上的豆粕是抗草甘膦转基因豆粕(glyphosate-tolerant soybean meal),其潜在的生物安全性问题备受关注。前人对抗草甘膦转基因豆粕的饲用安全性的研究主要集中在对抗草甘膦转基因豆粕的化学成分的比较分析[1-2],饲喂含抗草甘膦转基因豆粕的饲粮对动物生长性能、屠宰性能[3-5]和繁殖性能[6]的影响,以及外源 DNA和蛋白质在动物体内的残留检测[7-8]等方面,而对动物免疫功能影响的研究报道较少。小肠是肉鸡的主要消化器官,也是机体抵御饲料中有害抗原入侵的第一道免疫屏障[9],肠黏膜免疫是机体免疫的重要组成部分。肠黏膜免疫屏障主要由免疫细胞、免疫球蛋白和细胞因子等组成[10]。本试验旨在通过研究饲喂含抗草甘膦转基因豆粕的饲粮对肉仔鸡肠黏膜免疫屏障的影响,从黏膜免疫方面评价抗草甘膦转基因豆粕的饲用安全性,为转基因饲料的安全性评价提供试验依据。
1 材料与方法
1.1 试验设计与动物分组
试验选用 1日龄爱拔益加(AA)肉仔鸡 360只,公母混养,随机分为 2组,每组 5个重复,每个重复 36只鸡。每笼为 1个重复,各重复随机排布于鸡舍的不同位置,分别饲喂含抗草甘膦转基因豆粕和常规非转基因豆粕的饲粮。采用 3层立体笼养,常规免疫程序进行免疫,自由采食饮水,试验期 21 d。
1.2 豆粕与试验饲粮
试验用转基因豆粕品种为孟山都 RR抗草甘膦转基因大豆(40-3-2),由秦皇岛金海粮油工业有限公司提供;常规非转基因豆粕品种为国产大豆,由黑龙江庆丰集团克山昆丰油脂有限公司提供。
试验饲粮采用玉米 -豆粕型饲粮,参照 NY/T 33—2004 0~3周龄肉鸡营养需要推荐量配制,其组成及营养水平见表 1。
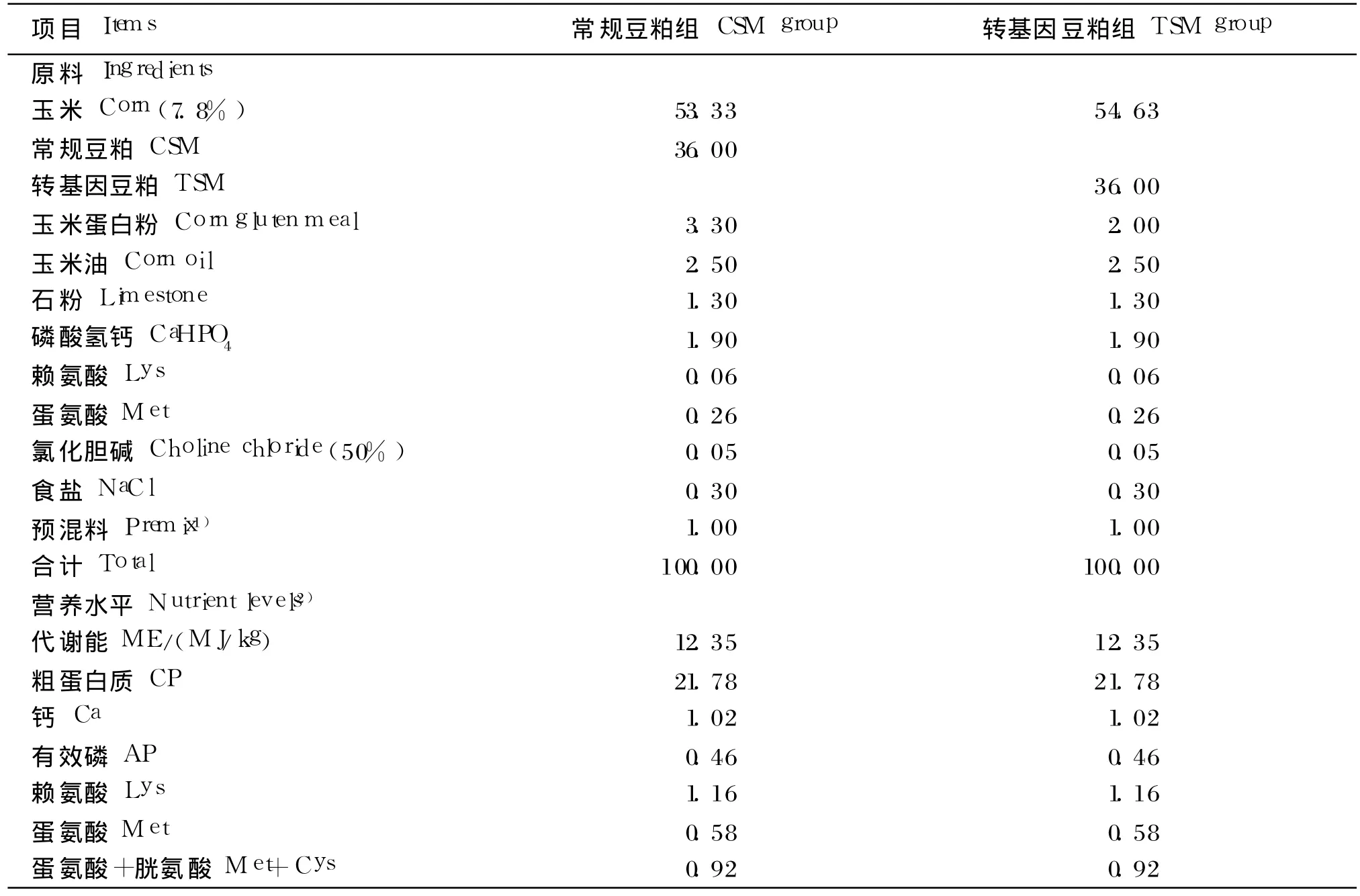
表1 饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the diets(air-dry basis) %
1.3 样品采集和处理
于试验第 21天从每个重复随机选取 3只鸡屠宰,快速取十二指肠(派依尔节处)、空肠(卵黄蒂前 1 cm处)和回肠(回盲口前 5 cm处)各 1 cm,立即置于 4%的甲醛溶液中固定,常规石蜡包埋、连续切片,切片厚 5μm。
取空肠组织 2 g、空肠食糜(卵黄蒂前 5 cm处)2 g于 Axgen离心管中,液氮速冻,-80℃保存。称取空肠组织 100 mg于 1 mL细胞裂解液(北京赛驰生物科技有限公司)中,在玻璃匀浆器冰浴匀浆,4℃ 10 000 r/min离心 5 min,取上清液;称取 500 mg空肠食糜于 1.5 mL 0.01 mol/L的 PBS(pH=7.2)中,涡旋混匀,10 000 r/min离心 5 min,取上清液。取空肠组织匀浆和食糜上清液,采用碧云天 BCA蛋白定量试剂盒进行蛋白定量后,-20℃保存备测其他指标。
1.4 指标测定方法
苏木素 -伊红(HE)染色,400倍光学显微镜下观察,每张切片选取 5根走向平直、完整的小肠绒毛,统计 100个小肠上皮内淋巴细胞(intestinal intraepithelial lymphocytes,iIEL)的数量。
空肠食糜上清液中分泌型免疫球蛋白 A(sIgA)含量的测定,采用美国 Bethy公司 IgA酶联免疫吸附试验法(ELISA)试剂盒(货号为:E30-103);组织匀浆上清液中辅助性 T细胞(T helper cells,Th1、Th2)细胞因子白细胞介素 -2(IL-2)和白细胞介素 -6(IL-6)含量的测定采用美国 Rapidbio公司的 ELISA试剂盒(货号分别为:11R020和11R040)。sIgA含量以 sIgA测定值与食糜上清液中总蛋白含量的比值(μg/mg)表示;IL-2和 IL-6含量以测定值与组织匀浆上清液中总蛋白含量的比值(pg/mg)表示。
1.5 数据分析
采用 SAS 8.0中 2样品平均值的 T检验程序进行显著性分析,数据以“平均值 ±标准误”表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 抗草甘膦转基因豆粕对肉仔鸡 iIEL数量的影响
由图 1可以看出,转基因豆粕组肉仔鸡小肠绒毛结构正常,iIEL散布于小肠绒毛上皮柱状细胞之间,胞浆极少,细胞核大而圆,染色较深,同常规豆粕组肉仔鸡相比,未见明显变化。从表 2的数据可以看出,转基因豆粕组与常规豆粕组肉仔鸡小肠(十二指肠、空肠和回肠)iIEL数量均无显著差异(P>0.05)。同时可以看出各处理肉仔鸡iIEL数量从十二指肠、空肠到回肠依次递减。
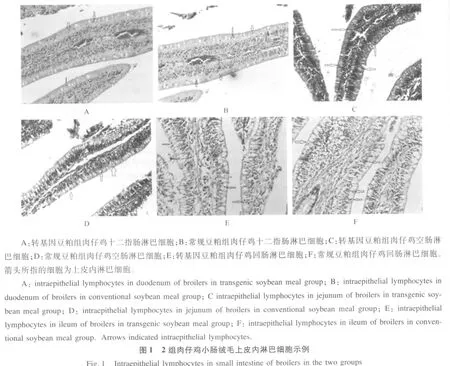

表2 小肠上皮内淋巴细胞数量Table 2 Number of intraepithelial lymphocytes in small intestine cell/100 absorb cells
2.2 抗草甘膦转基因豆粕对肉仔鸡空肠食糜中sIgA含量及组织中 Th1/Th2细胞因子水平的影响
由表 3、表 4可以看出,在试验第 21天,转基因豆粕组与常规豆粕组肉仔鸡空肠食糜中 sIgA含量无显著差异(P>0.05);2组肉仔鸡空肠组织中Th1细胞因子 IL-2和 Th2细胞因子 IL-6的含量及IL-2/IL-6均差异不显著(P>0.05)。

表3 抗草甘膦转基因豆粕对肉仔鸡空肠食糜中 sIgA含量的影响Table 3 Effects of glyphosate-tolerant soybean meal on the sIgA content in jejunum chyme of broilersμg/mg

表4 抗草甘膦转基因豆粕对肉仔鸡空肠组织中细胞因子含量的影响Table 4 Effects of glyphosate-tolerant soybean meal on the contents of cytokines in jejunum tissue of broilers pg/mg
3 讨 论
3.1 抗草甘膦转基因豆粕对肉仔鸡 iILE数量的影响
小肠黏膜内淋巴细胞群是肠黏膜免疫的主要效应器官,它主要存在于小肠绒毛上皮和固有层内。iIEL以 T淋巴细胞为主(约占 80%),但也有少量的 K(kill)细胞和 NK(natural kill)细胞。它的功能主要是保护机体免受肠腔病原体和毒素的侵害及分泌细胞因子[11-12]。本研究结果显示,饲喂含抗草甘膦转基因豆粕的饲粮没有引起肉仔鸡 iIEL数量的变化,没有引起肉仔鸡 iIEL的异常免疫反应,未对肉仔鸡 iIEL的免疫功能产生不良影响。且 iIEL数量呈现出从十二指肠到回肠逐渐降低的趋势,这与杨倩等[13]、杨玉荣等[14]报道的正常 iIEL变化结果一致。
3.2 抗草甘膦转基因豆粕对肉仔鸡空肠食糜中sIgA含量的影响
sIgA是肠黏膜免疫中的主要效应因子,它具有阻断肠道病原微生物和抗原物质对肠黏膜的黏附、中和病毒和毒素、激活补体等作用[15]。当肠腔中sIgA分泌不足时,肠黏膜会因为食物中的病原体或其他大分子抗原的侵害,产生免疫炎症。肠腔 sIgA分泌量的改变是评价肠黏膜免疫功能的一项重要指标[16]。本试验研究显示,转基因豆粕组与常规豆粕组空肠食糜中 sIgA含量无显著差异,表明饲喂含抗草甘膦转基因豆粕的饲粮没有对 sIgA的分泌造成不良影响。
3.3 抗草甘膦转基因豆粕对肉仔鸡空肠组织中Th1/Th2细胞因子分泌的影响
辅助性 T细胞是机体重要的免疫调节细胞,根据其产生细胞因子的不同可以分为 Th1和 Th2亚群。Th1亚群主要分泌 IL-2、干扰素 -γ(IFN-γ)、干扰素 -α(IFN-α)和肿瘤坏死因子 -β(TNF-β)等,主要参与细胞免疫;Th2亚群主要分泌 IL-4、IL-5、IL-6、IL-10和 IL-13等,主要参与体液免疫。在正常生理状态下,Th1/Th2处于一个动态平衡状态,Th1/Th2的不平衡可造成疾病的不同病理状态。本试验研究结果显示,在试验第 21天,常规豆粕组与转基因豆粕组肉仔鸡 IL-2和 IL-6的分泌量差异不显著,IL-2/IL-6差异不显著,表明饲喂含抗草甘膦转基因豆粕的饲粮未对肉仔鸡空肠组织中Th1/Th2细胞因子的分泌及其免疫平衡产生不良影响,同时也说明饲喂抗草甘膦转基因豆粕没有引起肉仔鸡肠黏膜产生病理性变化。
Finamore等[17]研究显示断奶小鼠在连续饲喂转基因 Bt蛋白玉米(Mon810)30 d后,血清中 Th1细胞因子 IFN-γ含量虽未出现显著变化,但是血清中 Th2细胞因子IL-6和IL-13的含量显著增加。这表明饲喂转基因玉米引起了断奶小鼠 Th1/Th2免疫平衡向 Th2方向偏移,与本试验结果不同,具体是由于试验动物的不同、还是由于试验材料的不同而导致还有待进一步研究验证。
4 结 论
饲喂含抗草甘膦转基因豆粕的饲粮在试验期间未引起肉仔鸡 iIEL数量、空肠食糜中 sIgA含量和空肠组织中 Th1/Th2细胞因子的含量发生显著性变化,未对所检测的各项肠黏膜免疫指标产生不良影响。
[1] PADGETTE S R,TAYLOR N B,NIDA D L,et al.Thecomposition of glyphosate-tolerant soybean seeds is equivalent to that of conventional soybeans[J].The Journal of Nutrition,1996,126(3):702-716.
[2] MCCANN M C,LIU K S,TRUJILLO W A,et al.Glyphosate-tolerant soybeans remain compositionally equivalent to conventional soybeans(Glycine max L.)during three years of field testing[J].Journal of Agriculture and Food Chemistry,2005,53(13):5331-5335.
[3] HAMMOND B C,VICINI J L,HARTNELL C F.The feeding value of soybeans fed to rats,chickens,catfish and dairy cattle is not altered by genetic incorporation of glyphosate tolerance[J].The Journal of Nutrition,1996,126(3):717-727.
[4] CROMWELL G L,LINDEMANN M D,RANDOLPH JH,et al.Soybean meal from roundup ready or conventional soybeans in diets for growing-finishing swine[J].Journal of Animal Science,2002,80:708-715.
[5] TAYLOR M,HARTNELL G,LUCAS D,et al.Comparison of broiler performance and carcass parameters when fed diets containing soybean meal produced from glyphosate-tolerant(MON 89788),control,or conventional reference soybeans[J].Poultry Science,2007,86:2608-2614.
[6] BRAKE D G,EVENSON D P.A generational study of glyphosate-tolerant soybeans on mousefetal,postnatal,pubertal and adult testicular development[J].Food and Chemical Toxicology,2004,42:29-36.
[7] JENNINGSJ C,KOLWYCK D C,KAYSSB,et al.Determining whether transgenic and endogenous plant DNA and transgenic protein are detectable in muscle from swine fed Roundup Ready soybean meal[J].Journal of Animal Science,2003,81:1447-1455.
[8] ASH J,NOVAK C,SCHEIDELER S E.The fate of genetically modified protein from Roundup Ready soybeans in laying hens[J].Poultry Science,2003,12:242-245.
[9] MACDONALD T T,MONTELEONE G.Immunity,inflammation,and allergy in the gut[J].Science,2005,307:1920-1925.
[10] IIJIMA H,TAKAHASHI I,KIYONO H.Mucosal immune network in the gut for thecontrol of infectious diseases[J].Reviews in Medical Virology,2001,11:117-133.
[11] TAGUCHI T,AICHER W K,FUJIHASHI K,et al.Novel function for intestinal intraepithelial lymphocytes.Murine CD3+, γ/δTCR+T cells produce IFN-γand IL-5[J].Journal of Immunology,1991,147(11):3736-3744.
[12] YANG H,FAN Y Y,FINALY R,et al.Alteration of intestinal intraepithelial lymphocytes after massive small bowel resection[J].Journal of Surgical Research,2003,110:276-286.
[13] 杨倩,练高建,黄国庆.半胱胺对鸡小肠黏膜中分泌型 IgA细胞和上皮内淋巴细胞的影响[J].南京农业大学学报,2002,25(2):89-92.
[14] 杨玉荣,佘锐萍,张日俊.大豆生物活性肽对肉鸡肠道黏膜上皮内淋巴细胞和IgA+生成细胞的影响[J].中国预防兽医学报,2006,28(4):412-415.
[15] MESTECKY JR,MCGHEE J R.Immunoglobulin A(IgA):molecular and cellular interactions involved in IgA biosynthesis and immune response[J].Advances in Immunology,1987,40:153-245.
[16] ZHANG X F,ZHANG X W,YANG Q.Effect of compound mucosal immune adjuvant on mucosal and systemic immune responses in chicken orally vaccinated with attenuated Newcastle-disease vaccine[J].Vaccine,2007,25:3254-3262.
[17] FINAMORE A,ROSELLI M,BRITTI S,et al.Intes-tinal and peripheral immune response to MON810 maize ingestion in weaning and old mice[J].Journal of Agriculture and Food Chemistry,2008,56(23):11533-11539.
