嗜热石油降解菌YBW1的筛选、鉴定及性能研究
2011-03-23王俊卿曾一梅汪浩勇
付 烈,周 稳,王俊卿,曾一梅,熊 平,汪浩勇
(湖北工业大学生物工程学院,湖北 武汉 430068)
利用微生物提高石油采收率(MEOR)可以通过多种作用机理来提高原油开采率,是目前公认的开采油藏中剩余油和枯竭油藏最好的廉价采油方法[1].而当前应用于MEOR的菌株主要是一些嗜温菌[2-3],无法在一些高温油藏的开采中发挥作用.因此,嗜热石油降解菌的筛选及降解机理就逐渐成为当前研究的热点.目前国内外已报道的嗜热石油降解菌存在着种类少、降解性能不够理想的问题.本文就新的嗜热石油降解微生物的筛选及其降解特性进行了研究.
1 材料与方法
1.1 材料
1.1.1 实验材料 实验样品采自湖北省江汉油田王一站地下高温储水.
1.1.2 培养基 LB培养基[4].基础培养基(g/L):Na2HPO4,0.6 g;KH2PO4,0.2 g;NaNO3,4 g;CaCl2,0.01 g;FeSO4,0.01 g;MgSO4,0.3 g;酵母粉,0.1 g;PH值7.2[5].原油培养基:基础培养基中分别添加体积分数为0.1%、2%、60%的原油.液体石蜡培养基:基础培养基中添加体积分数为2%的液体石蜡.
1.2 方法
1.2.1 菌株分离 将地下储水在70℃培养箱温浴15 d后,直接涂LB平板获取单菌落.挑取不同形态单菌落接种至LB培养基70℃过夜培养.将培养液按5%的接种量分别接种至100 mL体积分数为2%的液体石蜡培养基70℃培养7 d.再将培养液按5%的接种量转接至100 mL 2%(体积分数)原油培养基70℃培养15 d,观察原油乳化情况,并且采用平板计数法两天测一次菌液中的活菌数.最后选择原油乳化效果最好、细菌生长最旺盛的细菌进行下一步实验.
1.2.2 菌株的鉴定 生理生化特征鉴定见文献[6-7],菌株的总DNA提取见文献[8].16S rDNA的扩增采用细菌通用引物:8UA forward:5'-AGA GT T TGA TCMTGG CTC AG-3',reverse:5'-ACG GCT ACC T TG TTA CGA CT T-3',扩增条件参照pfu DNA聚合酶(CASarrary)使用说明书.PCR产物的回收采用Gel Extraction Mini Kit(安比奥生物技术公司)完成.纯化产物确认后,采用T/A克隆法克隆到pMD18-T Vector(TaKaRa公司)上送华大基因公司测序.将结果在 Genebank中进行BLAST比对后,用Clustal X 1.8和MEGA4.1软件构建系统发育树[9-10].
最适生长温度测试采用LB培养基培养细菌,尤尼柯UV2000紫外可见分光光度计在600 nm处测量.
1.2.3 菌株在不同烷烃培养基中的生长能力测试
将新鲜单菌落接入LB液体培养基中,65℃过夜培养.分别将5 mL培养液用灭菌生理盐水洗两遍再接种至含2%(体积分数)石油和2%(体积分数)液体石蜡的100 mL基础培养基,不添加石油和液体石蜡的为对照.在65℃、150 r/min培养 18 d,不同时间间隔取样测CFU值.
1.2.4 菌株降黏测试 以5%的接种量将过夜培养液接入 100 mL原油培养基(原油体积分数为60%),65℃、150 r/min培养18 d.低速离心分离油水混合物,吸取上层原油,在50℃采用 NDJ-8S数显黏度计(上海)测定黏度.与不接菌的对照相比较计算降黏率.
1.2.5 不同鼠李糖脂浓度对菌株石油降解率的影响 以5%的接种量将过夜培养液分别接入含不同体积分数的鼠李糖脂(0.05%,0.1%,0.2%,0.3%,0.4%,0.6%,0.7%)的原油培养基(原油体积分数为0.1%),以不接种的原油培养基为对照,置于65℃、150 r/min培养18 d,将培养液倒入分液漏斗中,加入20 g NaCl和5 mL H2SO4摇匀,用 30 mL正己烷萃取.取1 mL萃取液注入25 mL容量瓶里,加正己烷定容.在芳烃特征吸收峰波长256 nm处以正己烷为参比测定吸光度,根据事先准备的标准曲线计算原油降解率[11].
2 结果与分析
2.1 菌株筛选
经过分离从样品中获得6株能够乳化原油且生长比较旺盛的菌株,反复实验确认后选取一株乳化效果最好生长最旺盛的原油降解菌,命名为YBW1.
2.2 菌株鉴定
2.2.1 形态学和生理生化鉴定 将YBW1进行形态观察及生理生化实验,其结果如下:菌落颜色,黄褐色;菌落形态,圆形、光滑 ;菌体宽度,0.6~1 μ m;菌体长度,2~3.5 μ m,革兰氏染色,+;菌体形状,杆状;芽孢,内生孢子;运动性,-;过氧化氢酶,+;氧气需求,好氧.最适温度测试表明其生长范围为45~75℃,最适生长温度为65℃(图 1).

图1 菌株YBW1生长温度曲线
2.2.2 菌株的16S rDNA鉴定 对菌株YBW1的总DNA进行16S rDNA PCR扩增得到约1.5 kb大小的产物(图2).将PCR产物回收、测序,得到1518 bp大小的16S rDNA片段.通过BLAST比对和系统发育树(图 3)分析表明菌株 YBW1与Geobacillus kaustophilus的序列的相似度为100%,进化距离最近.
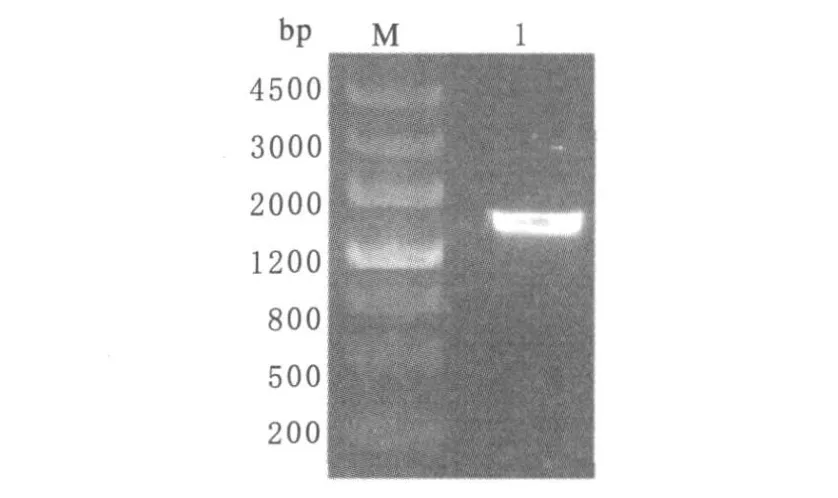
图2 菌株YBW116S rDNA PCR产物
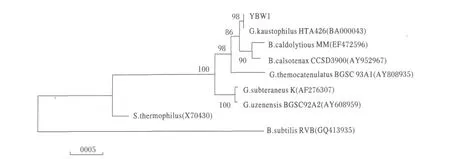
图3 菌株YBW116S rDNA系统发育树
2.3 生长能力测试
活菌计数获得YBW1的生长曲线(图4)表明菌株YBW1在接种后首先会利用培养基中的酵母粉进行生长,但经过3~6 d的适应期,YBW1会先后开始利用液体石蜡和原油中的碳源生长.在第10—13 d,YBW1达到最大生长量,此后随着可利用的碳源逐渐减少,活菌数量也逐步降低.

图4 菌株YBW1生长能力测试曲线
2.4 原油降黏测试
通过对原油的黏度测试,被菌株YBW1作用后原油黏度从65 mPa·s降低到53 mPa·s,降黏率为18.5%.表明菌株YBW1在生长过程中可能降解了部分长链烷烃和产生某种起到降黏作用的生物表面活性剂.
2.5 不同鼠李糖脂浓度下菌株石油降解率的测定
菌株在不同鼠李糖脂浓度下经过15 d的作用.原油降解率测定结果(图5)表明:最佳鼠李糖脂添加量为0.2%,此时获得最大原油降解率14.3%.当鼠李糖脂添加量高于0.3%后会不同程度降低原油降解率.

图5 菌株YBW1在不同鼠李糖脂浓度下原油降解率
3 结论
石油降解菌广泛存在于被石油污染的土壤、河流和海洋中,并且受环境影响较大.本文选择油田地下高温储水为样品成功分离出了一株嗜热石油降解菌——YBW1.在传统的生理生化鉴定基础上采用分子生物学方法,更加准确地鉴定出该菌为Geobacillus kaustophilus.
在生长能力测试中,菌株YBW1在培养初期的生长速度没有在液体石蜡中的快.原因可能是液体石蜡所含有的主要是C12-C18的烷烃,比较容易分散在水中被利用.而原油是由多种不能溶解的成分组成,其中主要是一些长链烷烃(C20以上).所以YBW1会经历一个较长的适应期来产生一些生物表面活性剂使原油乳化,从而达到对原油利用的目的.当原油中的长链烷烃被利用后,原油的黏度也就会降低.这也是YBW1能降低原油黏度和和鼠李糖脂表面活性剂能提高原油降解率的原因.不过,当鼠李糖脂的量过多时会对细菌的细胞膜产生破坏作用抑制细菌生长[12],从而导致原油降解率下降.
近年来极端环境微生物的研究逐渐成为微生物学研究的重点,本文在嗜热石油降解微生物方面做了一些初步探索.下一阶段的研究重点将会放在菌株YBW1利用不同石油烃组分生长和烷烃降解机理的研究上.
[1]Boek M,Boseeker K.Occurrence of biosurfactant-producing bacteria in oil reservoirs,contaminated soils,and surface waters in Northem Gemany[J].Geol Jahrb serD,1997,5(103):147-157.
[2]包木太,牟伯中,王修林,等.微生物提高石油采收率技术[J].应用基础与工程科学学报,2000,8(3):236-245.
[3]Song S F,Zhang Z Z,Li S Y.Progress of microbial enhanced oil recovery in laboratory investigation[J].Petroleum Sci,2004,l(4):23-29.
[4]萨姆布鲁克J,拉塞尔D W.分子克隆实验指南(第三版)[M].黄培堂译.北京:科学出版社,2002.
[5]Lei Wang,Yun Tang,Shuo Wang,et al.Isolation and characterization of a novel thermophilic Bacillus strain degrading long-chain n-alkanes[J].Extremophiles,2006,10:347-356.
[6]布坎南R E,吉本斯N E.伯杰氏细菌鉴定手册(第八版)[M].北京:科学出版社,1984.
[7]东秀珠,蔡秒英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[8]刘 刚,翟朝阳.一种通用的从少量培养液中快速提取细菌染色体DNA的方法[J].西部医学.2004,16(2):111-113.
[9]Kim J D J,Shim S H,Lee C G.Degradation of phenanthrene by bacterial strains isolated from soil refinery fields in korea[J].J Microbiol Biotechn,2005,15(2):337-345.
[10]Harrison,C.J.,Langdale,J.A.A step by step guide to phylogeny reconstruction[J].Plant J,2006,45(4):561-572.
[11]宋茂勇,林建强,魏玉华,等.芽抱杆菌S-l提高石油采收率研究[J].山东大学学报(理学版),2004,39(1):117-120.
[12]Zhang Y M,Miller R M.Effect of a Pseudomonas Rhamnolipid biosurfactant on cell hydrophobicity and biodegradation of octadecane[J].Appl Environ Microbiol,1994,6:2101-2106.
