替米沙坦对肝纤维化大鼠肝组织病理学变化的影响
2011-03-14李国云孟丽萍傅茂英甘建和
李国云 孟丽萍 傅茂英 金 凤 甘建和
肝纤维化的发病机制尚未明确,也缺乏有效的防治手段。本文在四氯化碳诱导肝纤维化大鼠,研究了替米沙坦的抗肝纤维化作用。
资料与方法
一、研究对象 清洁级同系雄性SD大鼠40只,体重190±7g,苏州大学动物中心提供。动物饲养条件:室温26±3℃,相对湿度45%~55%。每日光照12小时,分笼饲养,自由饮水,全价配合饲料喂养。
二、动物模型的制备 随机将40只大鼠按区组分配原则分成正常对照组12只、模型12只和替米沙坦干预组16只。将CCl4与橄榄油按体积4:6配成40%油剂,按0.4ml.100g-1给予模型大鼠腹腔注射,1次/周×3,以后调整为 0.3ml.100g-1腹腔注射,2 次/周,共5周;正常对照组动物以生理盐水腹腔注射。根据人与动物用药量换算方法[1]:即预将已知A种动物每kg体重用药量,估算出B种动物每kg体重用药剂量,先查表1,找出折算系数(W),再按下式计算:B种动物的用药剂量(mg.kg-1)=W×A种动物的用药剂量(mg.kg-1)。以替米沙坦一般人体给药剂量40mg.60kg-1折算成大鼠的剂量为4.16mg.kg-1。将替米沙坦用生理盐水配成1ml溶液,依剂量灌胃,1次/日,自造模第一日起给药,共7周,其余两组动物每日给予生理盐水1ml灌胃。在实验7周末,断颈处死所有大鼠。立即整体切取肝、脾脏,称重,计算肝/脾指数。取适量肝组织,置于10%中性福尔马林液中固定,其余肝组织置液氮中保存。病理切片约4μm,HE染色。参照《肝纤维化诊断及疗效评估共识》[2]进行肝组织炎症活动度及纤维化程度分级、分期。随机选择10个视野,应用炎症活动度半定量计分系统和肝纤维化半定量计分系统(SSS)[3]进行组织病理学疗效评估。
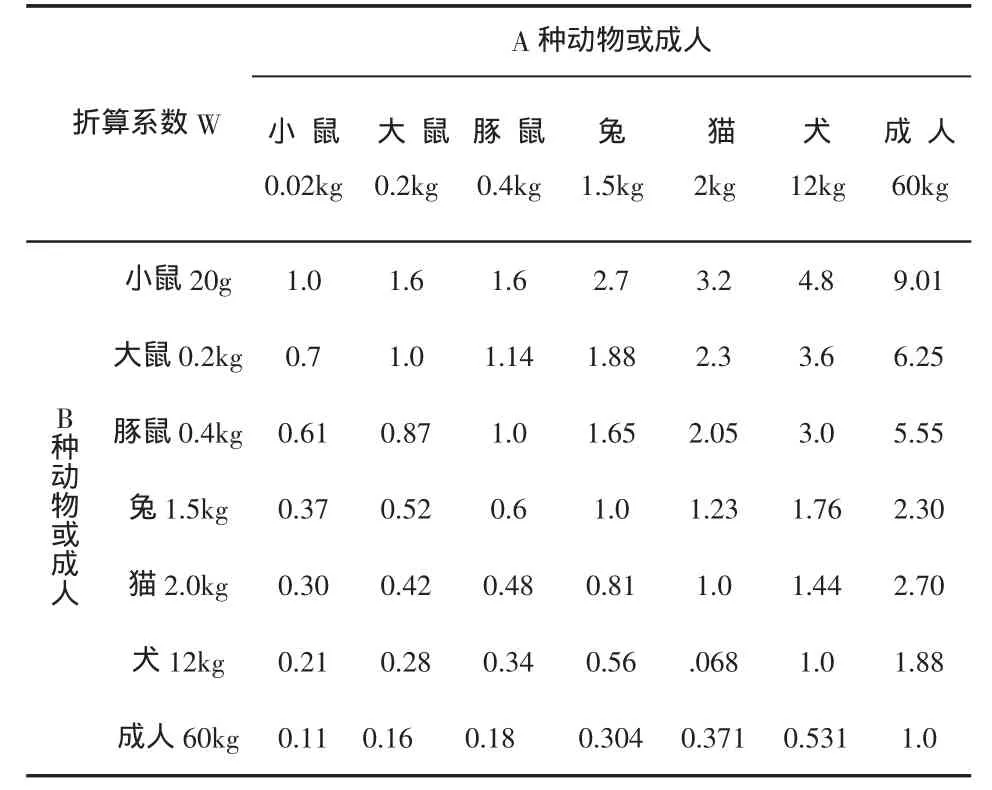
表1 动物与人每公斤体重用药剂量折算系数表
结果
一、一般情况 模型组大鼠死亡4只,干预组大鼠死亡3只。三组大鼠平均体重变化见图1,大鼠肝/脾指数见表2。
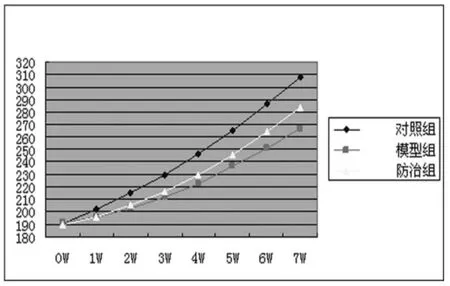
图1 各组大鼠体重变化情况
表2 3组大鼠肝/脾指数()的比较
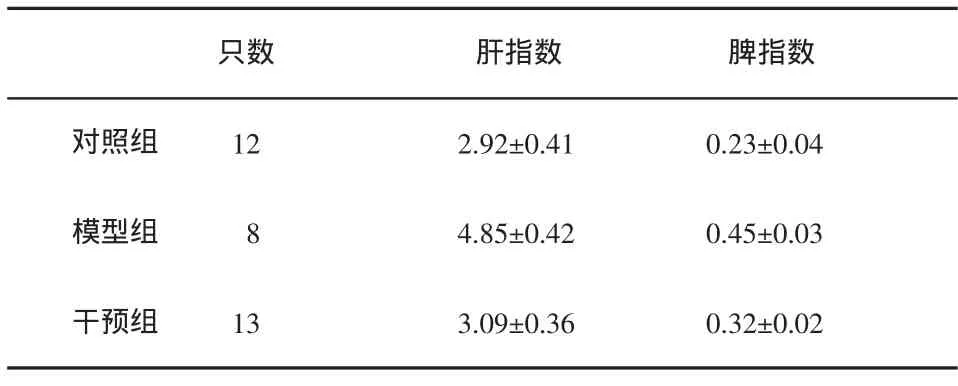
表2 3组大鼠肝/脾指数()的比较
只数 肝指数 脾指数对照组 122.92±0.41 0.23±0.04模型组 84.85±0.42 0.45±0.03干预组 133.09±0.36 0.32±0.02
三、肝组织病理学变化 见表3、4和图2~4。
表3 大鼠肝脏炎症活动度和纤维化半定量计分()的比较
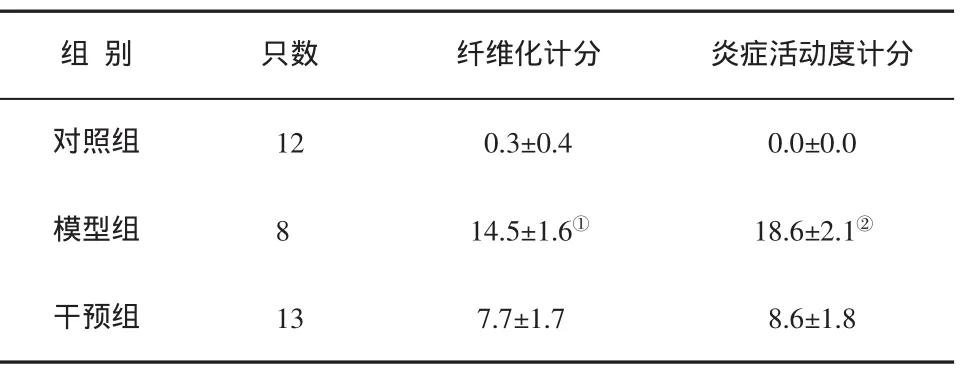
表3 大鼠肝脏炎症活动度和纤维化半定量计分()的比较
与正常组比,①t=28.966,P=0.000;与干预组比,②t=9.268,P=0.000
组 别 只数 纤维化计分 炎症活动度计分对照组 12 0.3±0.4 0.0±0.0模型组 8 14.5±1.6① 18.6±2.1②干预组 13 7.7±1.7 8.6±1.8
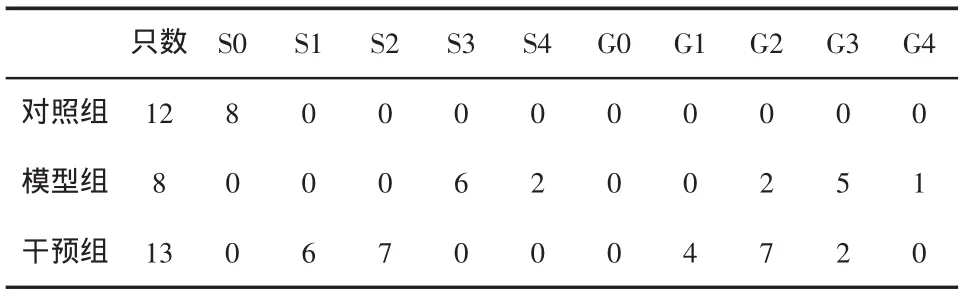
表4 大鼠肝脏炎症分期和分级的变化
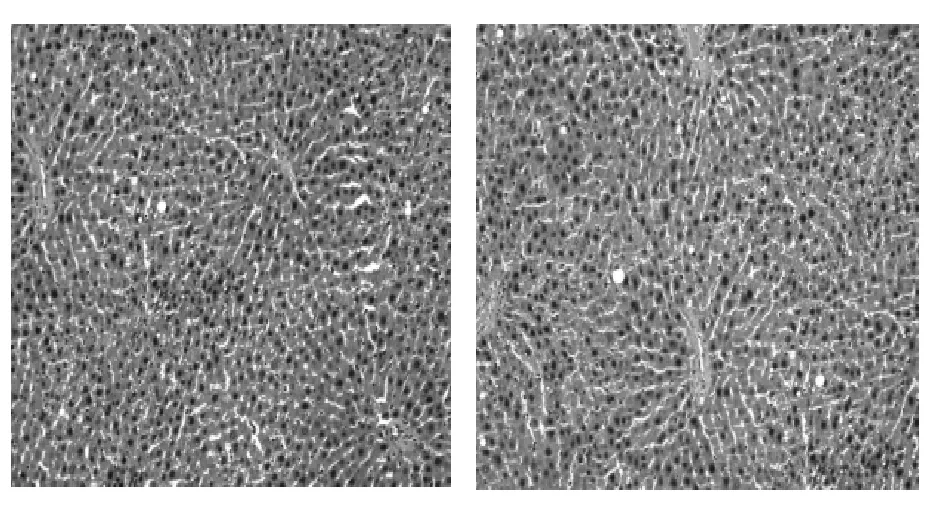
图2 正常组大鼠肝组织(HE,100×)
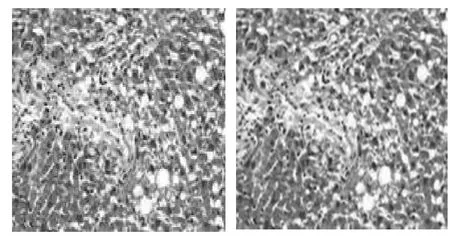
图3 模型组大鼠肝组织(HE,200×)
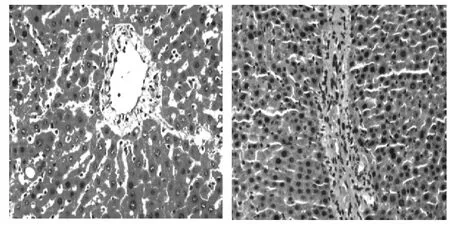
图4 干预组大鼠肝组织(HE,200×)
讨论
肝纤维化是肝脏对反复损伤出现的创伤-愈合的反应[3~5],主要表现为肝脏细胞外基质(ECM)代谢失衡,合成超过降解,最终导致局部组织胶原过度沉积。在损伤肝组织中,活化的肝星状细胞(HSC)是最主要的产ECM细胞[6],同时HSC合成及分泌基质金属蛋白酶抑制剂(TIMPs)增加,使 ECM 降解减少[7,8]。因此,HSC的活化是肝纤维化形成的共同途径和核心环节。在肝损伤过程中,HSC被多种细胞因子如TGF-β1、血管紧张素 П(AngП)、血小板源性生长因子(PDGF)等激活[9],而PPAR-γ激动剂可抑制PDGF诱导的HSC增殖与趋化,可能在维持HSC作为静止状态的表型上具有重要作用[10,11]。
替米沙坦是一种新型的ATl受体阻制剂,兼有血管紧张素Ⅱ受体拮抗剂(ARB)和PPAR-γ激动的双重作用[12,13]。一些研究已证实,ATl受体阻制剂可通过抑制肝星状细胞活化和肝脏TGF-β1的表达明显改善实验性肝纤维化[14,15]。本研究显示,模型大鼠平均体重与正常对照组和替米沙坦干预组比较均有明显的统计学差异。目前,肝活组织病理学检查仍是评估肝纤维化的金标准。本研究在大鼠肝纤维化模型制备成功后,观察了替米沙坦的抗肝纤维化作用,推测替米沙坦因为ARB和PPAR-γ激动的双重作用可能对肝纤维化的防治具有积极的意义,但其作用机制仍有待进一步研究。
[1]中华医学会肝脏病学会肝纤维化学组.肝纤维化诊断及疗效评估共识[J]. 中华肝脏病杂志,2002,10(5):327-328.
[2]SCHWIMMER JB,BEHLING C,NEWBURY R,et a1.Histopathology of pediatric nonalcoholic fatty liver disease[J].Hepatology,2005,42:641-649.
[3]INMACULADA GR,TORRE P,TERESA D.Sp1 and Sp3 transcription factors mediate malondialdehyde-induced collagen al(I)gene expression in cultured hepatic stellate cell[J].J Biol Chem,2002,277(34):30551-30558.
[4]FRIEDMAN SL.Liver fibrosis-from bench to bedside[J].J Hepatol,2003,38(Suppl.1):S38-S53.
[5]BATALLER R.NADPH oxidase signal transduces angiotensin II in hepatic stellate cells and is critical in hepatic fibrosis[J].J Clin Invest,2003,112:1383-1394.
[6]ALONG F,LIU P,BLENDIS L.The mechanism of improved sodium homeostasis of low-dose losartan in preascitic cirrhosis[J].J Hepatol,2002,35(6):1449-1458.
[7]VALKOVA M.Pathophysiology of hepatic fibrosis[J].J Vnitr Lek,2002,48(1):27-33.
[8]KAWADA N,SEKI S,MOUE M,et al.Effect of antioxidants,reseratrol,quercetin,and N-acetylcysteine,on the functions of cultured rat hepatic stellate cells and Kupffer cells[J].J Hepatol,1998,27(10):1265-1274.
[9]YOSHIJI H,KURIYAMA S,FUKUI H.Angiotensin-I-converting enzyme inhibitors may be an alternative anti-angiogenic strategy in the treatment of liver fibrosis and hepatocellular carcinoma.possible role of vascular endothelial growth factor[J].Tumour Biol,2002,23:348-356.
[10]PLANAGUMA A,CLARIA J,MIQUEL R,et a1.The selective cyclooxygenase-2 inhibitor SC-236 reduces liver fibrosis by mechanisms involving non-parenchymal cell apoptosis and PPAR gamma activation[J].FASEB J,2005,19(9):1120-l122.
[11]JANK E,JURGEN A,SCHUP P,et al.Angiotensin type 1 receptor antagonists induce human in-vitro adipogenesis through peroxisome proliferator-activated receptor-[gamma]activation[J].J Hypertension,2006,24(9):1809-1816.
[12]IMAYAMA I,FUKUYAMA K,ONO H,et al.Toshihiro downregulation of angiotensin II type 1 receptor by telmisartan through ppAR gamma:P65[J].Hypertension,2005,46(5):842.
[13]SUGIMOTO K,QI NR,KAZDOVDT L,et a1.Telmisartan but not valsartan increases caloric expenditure and protects against weight gain and hepatic steatesis[J].Hypertension,2006,47:1003-1009.
[14]UEKI M,KODA M,YAMAMOTO S,et al.Preventive and therapeutic effects of angiotensin II type 1 receptor blocker on hepatic fibrosis induced by bile duct ligation in rats[J].J Gastroenterol,2006,41:996-1004.
[15]AFDHAL NH,NUNES D.Evaluation of liver fibrosis:a concise review[J].Am J Gastroenterol,2004,99:1160-1174.
