TaqMan-MGB探针法快速检测对虾Taura综合征病毒的研究
2011-03-14韦信贤童桂香谢宗升黎小正吴祥庆廖永志黄国秋
韦信贤,童桂香,谢宗升,黎小正,吴祥庆,廖永志,黄国秋
(1.广西渔业病害防治环境监测和质量检验中心,广西 南宁 530021; 2.上海海洋大学 水产与生命学院,上海 201306)
对虾TSV是全球范围内广泛流行并严重威胁对虾养殖业的主要病原体,其主要感染西半球对虾养殖品种,如凡纳滨对虾(Litopenaeus vannamei)、大西洋白对虾(Litopenaeus setiferus)、褐对虾(Penaeus aztecus)和桃红对虾(Penaeus duorarum),其中对凡纳滨对虾特别敏感。它引起的对虾Taura综合征(Taura syndrome,简称 TS) 被世界动物卫生组织列为必须申报的疾病[1]。该病在1992年厄瓜多尔Taura河附近的对虾养殖场最早发现,1998年传至中国台湾,自2000年在中国多省市大规模暴发,病死率高达60%~90%,给对虾养殖业造成了严重的经济损失[2]。随着对虾养殖规模的扩大,集约化程度的提高,对虾生活环境日益恶化,TS成为近年来制约对虾养殖业可持续发展的几种病毒性疾病之一。
病毒学研究证实,TSV是一种小的正二十面体无囊膜病毒,直径 30~32 nm,其基因组为单正链RNA,由10205个核苷酸组成[3-4]。传统的TSV检测方法有指示生物法、组织病理学检查、核酸点杂交和原位杂交、免疫组化及RT-PCR等,这些方法只能进行定性检测,不能定量,且操作繁琐。20世纪末发展起来的荧光定量 PCR技术,具有快速、灵敏、可准确定量等特点,被广泛应用于病原体的检测[5]。近几年来荧光定量PCR的各种探针技术得到了快速发展,其中 TaqMan-MGB探针凭借其技术优势在动物病原体的检测中得到了广泛的应用[6-7]。TaqMan-MGB探针即在探针的 3′端连上不发光的淬灭基团MGB(Minor Groove Binder,简称 MGB)结合物,提高探针Tm值,使高Tm值的探针的长度缩短,便于设计,尤其对富含AT序列的探针设计有很大帮助。此外,TaqMan-MGB探针可以提高配对与非配对模板间的 Tm 值差异,且在探针 3′端不 发光的Quencher基团与 Report基团在空间的位置更接近,故 TaqMan-MGB探针杂交的稳定性大大提高,实验的结果更精确,分辨率更高[8]。为了提高 TSV 检测的效率和准确性,缩短检测周期,本研究拟应用TaqMan-MGB探针法建立一种能用于TSV快速定量检测的一步法荧光定量 RT-PCR方法,为 TSV的流行病学及快速诊断等方面提供技术平台。
1 材料和方法
1.1 主要仪器与试剂
Line-Gene荧光定量 PCR检测系统(FQ-33A)为杭州博日科技有限公司产品。pGM-T载体购自北京天根生化科技有限公司; 总RNA极速抽提试剂盒购自上海飞捷生物技术有限公司; One Step PrimeScript® RT-PCR Kit (Perfect Real Time)购自大连宝生物工程有限公司; T7体外转录试剂盒购自Fermentas公司; 质粒小量提取试剂盒、琼脂糖凝胶快速回收DNA试剂盒购自北京博大泰克生物基因技术有限责任公司; DNaseⅠ购自华美生物公司。
1.2 毒株与临床样品
TSV阳性材料为本实验室从北海某养殖场的凡纳滨对虾中鉴定并保存。103份凡纳滨对虾样品采集时间为2009~2010年,其中2010年的样品由广西水产技术推广总站提供。
1.3 荧光定量PCR方法的建立
1.3.1 引物与TaqMan-MGB探针的设计与合成
根据GenBank中发表的TSV序列,并参考本实验室对 TSV广西株的测序结果(EU543262),选取衣壳蛋白基因的保守序列,采用Primer Express 2.0 软件按荧光定量PCR引物和MGB探针设计的基本原则,设计特异的扩增引物和 TaqMan-MGB探针,扩增产物长度为 118bp,探针的 5′端标记荧光染料FAM,3′端标记MGB基团。由上海基康生物技术有限公司合成,临用时稀释至5 μmol/L。其序列为:
上游引物:5′- GATTGGGATATCATTCATCAAGATTGT 3′
下游引物:5′- GCCTGCTAACCCAGTTGAAAT-3′
探针:5′-FAM-ATTAGTCCTCCACTGGTTGTMGB-3′
1.3.2 病毒RNA提取
取 30 mg对虾的鳃组织,按照上海飞捷生物技术有限公司的 RNAfast200总 RNA极速抽提试剂盒说明书进行RNA提取。用核酸蛋白分析仪测定核酸的浓度及纯度,置于-80℃保存备用。
1.3.3 标准品的制备
本研究所用的标准品为本实验室构建的含有目的扩增片段的质粒经体外转录所获得的RNA。用检测TSV 的水产行业标准[9]中的PCR引物(正向引物:5′-ATCGCTGCACTACTCGGA-3′和反向引物5′-TCGTACTGGCTGTTCATC-3′)扩 增 TSV RNA,扩增产物长度为 231 bp。产物经琼脂糖凝胶回收、纯化,连入pGM-T载体,转化到大肠杆菌DH5α,挑取单个克隆子,通过PCR、测序鉴定,证实目的基因正确克隆入pGM-T载体中。提取质粒DNA,37℃SalⅠ单酶切过夜,使质粒线性化,琼脂糖凝胶电泳及试剂盒回收纯化质粒DNA线性化产物,用于体外转录。按试剂盒说明加入反应试剂,37℃作用2 h,加1 μL DNaseⅠ酶消化转录产物中未转录的DNA,37℃20 min,70℃灭活DNaseⅠ酶15 min,用苯酚、氯仿抽提,乙醇沉淀、干燥后加DEPC水溶解转录的RNA,紫外分光光度计测RNA浓度和纯度,D260nm定量浓度,并转换成拷贝数[10]:拷贝数=浓度×阿伏加德罗常数/(一个碱基对的平均分子质量×总长度),阿伏加德罗常数为 6.02×1023。以 10倍梯度稀释的 RNA作为标准品,-80℃保存备用,用已知拷贝数的标准品为模板进行一步法荧光定量RT-PCR。标准品的拷贝数分别为 2×107、2×106、2×105、2×104、2×103、2×102、2×101拷贝/μL。
1.3.4 引物和探针浓度的筛选
应用标准品 RNA作为模板,将引物终浓度在0.1~0.8 μmol/L、探针终浓度在 0.05~0.3 μmol/L 之间进行不同浓度的配比进行一步法荧光定量 RT-PCR,选择引物和探针的最佳浓度组合。
1.3.5 退火温度的优化
退火温度参考引物合成软件计算的Tm值,在引物Tm值~62℃范围内以1℃的梯度进行RT-PCR扩增。以标准品RNA为阳性对照,无菌蒸馏水为空白对照。根据定量RT-PCR扩增曲线Ct值及扩增曲线形状确定最佳退火温度。
1.4 标准曲线的建立与敏感性试验
用含有目的扩增片段的质粒经体外转录所获得的 RNA作标准品,10倍系列稀释后进行荧光定量PCR,每个梯度做3个平行。
1.5 特异性试验
以健康的SPF凡纳滨对虾组织RNA及广西TSV毒株的 RNA为模板,进行一步法荧光定量 RT-PCR扩增,检测引物和探针的特异性。
1.6 重复性试验
以梯度稀释的标准品RNA为模板,每个梯度做3个平行,并在间隔第7天和第14天分别进行重复试验,每次试验记录 Ct值,经过数据分析得到组内及组间的变异系数,检测方法的重现性。变异系数=标准偏差/平均数。
1.7 一步法荧光定量RT-PCR的临床应用
利用建立的一步法荧光定量RT-PCR方法对103份临床样品进行检测,并将检测为阳性的样品送大连宝生物工程有限公司测序验证,评价方法的临床实用性及近年来TS在广西的流行情况。
2 结果
2.1 体外转录RNA标准品的制备
重组质粒经 PCR、测序鉴定(GenBank登录号EU543262),证实目的基因已正确连接入 pGM-T载体,体外转录的标准品RNA用紫外分光光度计测浓度和纯度,D260nm/D280nm为 1.96,能满足标准品的要求。
2.2 引物、探针浓度组合的筛选
应用标准品 RNA作为模板,以引物终浓度为0.5 μmol/L、探针终浓度分别为 0.05、0.1、0.15、0.2、0.25、0.3 μmol/L进行一步法荧光定量RT-PCR,探针终浓度为0.2 μmol/L时Ct值最小,且可获得典型的S状扩增曲线(图1); 以探针终浓度为0.2 μmol/L、引物终浓度分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 μmol/L进行一步法荧光定量RT-PCR,曲线形状及 Ct值均无明显差异,但引物终浓度为0.4 μmol/L时Ct值最小(图2)。综合以上结果,选探针终浓度0.2 μmol/L、引物终浓度 0.4 μmol/L为一步法荧光定量RT-PCR的最佳组合。
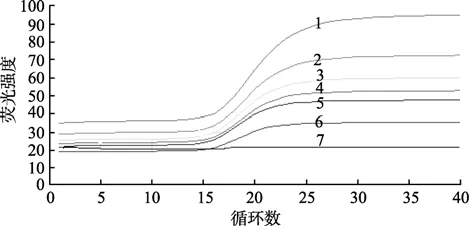
图1 不同探针浓度荧光定量RT-PCR检测TSV的扩增曲线Fig.1 Amplification plot using different concentrations of probe
2.3 退火温度的优化结果
退火温度高于60℃时,定量PCR扩增曲线线形平坦,甚至不出现 PCR扩增的对数增长期; 当退火温度在58~60℃,可以得到较好的PCR扩增曲线,且随着温度的变化曲线变化不大; 温度低于 58℃时,PCR的反应效率下降。因此,考虑到Taq酶在60℃时具有最好的 5′-3′外切酶活性,为确保检测的灵敏性与特异性,退火温度选择60℃。
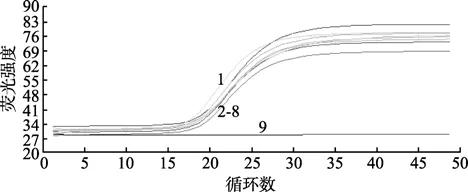
图2 不同引物浓度荧光定量RT-PCR检测TSV的扩增曲线Fig.2 Amplification plot using different concentrations of primer
2.4 荧光定量PCR的反应条件
优化后的反应体系如下:2×one step RT-PCR buffer 12.5 μL,Ex Taq HS 酶(5 U/μL) 0.5 μL,PrimeScript RT Enzyme Mix 0.5 μL,RNase inhibitor 0.5 μL,上、下游引物(10 μmol/L)各 1μL,TaqMan-MGB 探针(5 μmol/L) 1 μL,RNA 2.5 μL,用灭菌DEPC水补足25 μL,同时设不加RNA模板的空白对照。反应条件按照试剂盒说明并进行优化,反转录反应:42℃ 15 min,95℃ 2 min; PCR 反应:94℃预变性30 s; 然后按94℃变性10 s、60℃退火延伸35 s进行45个循环; 最后于30℃结束反应。
2.5 标准曲线的建立与敏感性试验
以 10倍系列稀释的 TSV标准品 RNA(2×107~2×101拷贝/μL)为模板使用优化后的一步法荧光定量RT-PCR进行扩增,标准品的扩增曲线呈现明显的 S型(图 3),而空白对照没有出现任何扩增。反应的动力学范围可以达到7个数量级,标准品RNA为2×107拷贝时,Ct值最小,约为14; 标准品RNA为20拷贝时,Ct值约为35。因此,检测灵敏度为20个病毒粒子,在实际检测中以Ct值35为界限,若检测样品的Ct值≤35,且有“S”型扩增曲线,则检测样品判断为 TSV阳性,否则样品判断为 TSV阴性。利用Line-Gene荧光定量 PCR数据分析软件进行分析可得标准曲线:Ct=-3.40lgX+38.68,横坐标代表起始拷贝数的对数,纵坐标代表 Ct值,相关系数和标准误差分别为0.999和0.011,模板浓度的对数与Ct值之间呈良好的线性关系(图 4)。以上结果显示,本研究建立的标准曲线能够准确地反映目的产物的扩增。

图3 10倍梯度稀释的标准品扩增曲线Fig.3 Amplification plot of 10-fold serially diluted RNA assay for the detection of TSV

图4 TSV定量RT-PCR反应的标准曲线Fig.4 Standard curve for quantification of TSV using real-time RT-PCR
2.6 一步法荧光定量RT-PCR的特异性
以健康的SPF凡纳滨对虾组织RNA及广西TSV毒株的RNA为模板,进行一步法荧光定量RT-PCR扩增,发现仅TSV RNA有“S”型扩增曲线,而SPF凡纳滨对虾组织RNA及空白对照没有出现扩增,表明引物和探针的特异性较好(图5)。
2.7 一步法荧光定量RT-PCR的重现性
以梯度稀释的标准品RNA为模板,每个梯度做3个平行样,共进行3次试验,每次试验记录Ct值,经过数据分析得到组内及组间的变异系数,见表1。组内的实验变异系数为0.32%~1.84%,组间实验变异系数为0.79%~2.71%,表明试验的重复性和重现性都很好,结果稳定可靠。
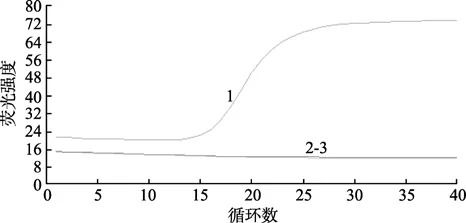
图5 荧光定量RT-PCR法检测TSV特异性的扩增曲线Fig.5 Specificity of real-time RT-PCR assay for the detection of TSV
2.8 临床应用
用一步法荧光定量RT-PCR方法检测2009~2010年收集的103份凡纳滨对虾样品,在检测过程中,分别以TSV 标准品RNA、灭菌DEPC水、SPF对虾组织RNA作为阳性对照、空白对照、阴性对照。结果发现,有 6份样品出现“S”型扩增曲线,其余样品无扩增曲线。6份阳性样品的Ct值介于18.56~33.71,根据标准曲线计算出反应体系中的病毒量约为 8.3×105~29拷贝/反应,计算虾体中的病毒量约为3.3×105~12拷贝/μL RNA。

表1 MGB定量RT-PCR反应的Ct、组内及组间变异系数Tab.1 Ct,intra and inter-assay coefficient values of the real-time RT-PCR for the detection of TSV
3 讨论
TSV自2000年以来一直是严重威胁中国对虾养殖业的主要病原体,其快速诊断方法如普通PCR、套式PCR、多重PCR及定量PCR技术近年来也相继报道[11-15]。相比而言,荧光定量 PCR技术具有快速、灵敏、可准确定量的特点,应用于 TSV的检测具有其他方法不可比拟的优势。Dhar等[14]2002年就报道了采用SYBR GreenⅠ染料法对TSV进行定量检测,但由于SYBR GreenⅠ可以与所有的双链DNA结合,其与双链DNA的结合只具有结构特异性而不具有序列特异性,使试验容易产生假阳性信号会影响定量的精确性。鉴于TSV检测的特异性在口岸进出口对虾快速检验检疫的重要性,岳志芹等[15]随后建立了特异性更高的Taqman探针法检测TSV。近年来,随着荧光定量PCR技术的不断改进与完善以及新的荧光化学物质的不断开发,TaqMan-MGB探针、TaqMan-LAN探针、Allglo探针等各种新型探针技术相继涌现,大大方便了研究工作者在实际的工作中依灵敏度、特异性等方面的不同实验要求选择合适的探针。
鉴于临床诊断及检验检疫实际工作对TSV检测需快速、特异、灵敏的要求,本研究根据 TSV基因组的保守序列,设计了 TaqMan-MGB探针,既继承了靶序列由引物和探针双重控制的探针法优势,保证了特异性; 又提高了探针的 Tm 值和配对与非配对模板间的Tm值差异,使探针的长度缩短、杂交稳定性提高,从而能提高反应的扩增效率及灵敏度。本实验还对反应条件中退火温度、引物浓度、探针浓度等条件进行了优化,确定了一步法荧光定量RT-PCR的最佳反应体系与反应参数; 且标准曲线的制作是以将PCR产物克隆到pGM-T载体中并进行体外转录合成的RNA作为标准品,能准确地反映反转录及扩增的效率。实验表明,该方法对TSV RNA的检测灵敏度高,可达 20个拷贝,在 2×101拷贝/μL≤TSV RNA≤2×107拷贝/μL的范围内具良好的线性关系; 与 SPF对虾组织的 RNA没有反应,特异性好;通过反复对该方法变异系数的检测,证实该方法的重复性和重现性好; RT-PCR和产物分析的全过程均在单管封闭条件下一步完成,减少了交叉污染的风险,且不需要电泳、染色,仅需2 h可观察结果,因此更方便、快速,充分发挥了荧光定量 PCR及TaqMan-MGB探针技术的简便、快速、特异、灵敏、稳定等优势。应用一步法荧光定量 RT-PCR方法对2009~2010年收集的103份来自广西沿海不同对虾养殖场的对虾样品进行检测,结果仅检出6份阳性,说明近年来TSV在广西沿海地区养殖对虾中的流行趋势已有明显减弱。笔者经与广西、广东、上海等地的养殖户交流,得知近年来许多具有红体症状的病虾经检测多为白斑综合征病毒或细菌感染所致,TSV检出率很低,表明近年来 TSV在国内的流行的确有所减弱。
此外,笔者在多年的荧光定量 PCR实验经历中发现,虽然荧光定量PCR为集PCR扩增和产物分析于一体的全封闭反应,无须 PCR后处理,可以减少污染发生的机会; 但如果长期检测某一目的基因或常用目的片段的克隆质粒作为阳性对照时发生 PCR污染的几率将大大增加。因此,为控制污染,在进行荧光定量 PCR试验时,除严格按照相关实验室操作规范进行外,每次试验都应设定阳性对照与空白对照,监控PCR反应体系是否污染。
在定量PCR反应中,Ct值是指每个反应管内的荧光信号到达设定的阈值时所经历的循环数。每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系,起始拷贝数越多,Ct值越小。因此,利用已知起始拷贝数的标准品可做出标准曲线,将未知样品的Ct值代入标准曲线即可计算出该样品的起始拷贝数。在本实验中,标准曲线为:Ct=-3.40lgX+38.68,仪器显示标准曲线的相关系数为-0.999,误差为0.011,根据Ex=10/K-1[16](Ex表示扩增效率,K指标准曲线中的斜率,在此为 3.40),经过计算得到PCR扩增效率约为1.941,表明建立的PCR反应体系条件合适,有较高的扩增效率,能保证定量结果的可靠性。
与原有的TSV检测方法相比,TaqMan-MGB探针一步法荧光定量RT-PCR法具有简便、快速、能定量、特异性强、灵敏度高等优点,对可疑的 TSV样品在2 h内可作出定性和定量的检测和鉴定。该法的建立将为临床快速诊断TSV、TS流行病学调查以及口岸进出口对虾的快速检验检疫提供更加敏感和特异的检测方法,具有重要的临床应用价值。
[1]世界动物卫生组织(OIE).水生动物疾病诊断手册第三版[M].国家质量监督检验检疫总局译.北京:中国农业出版社,2000:165-171.
[2]Lightner D V,Redman R M.Shrimp diseases and current diagnostic methods[J].Aquaculture,1998,164(3):201-220.
[3]Bonami J R,Hasson K W,Mari J,et al.Taura syndrome of marine penaeid shrimp:characterization of the viral agent[J].J Gen Virol,1997,78(2):313-319.
[4]Mari J,Poulos B T,LightnerD V,et al.Shrimp Taura syndrome virus:genomic characterization and similarity with members of the genus cricket paralysislike viruses[J].J Gen Virol,2002,83(4):915-926.
[5]Heid C A,Stevens J,Livak K J,et al.Real time quantitative PCR[J].Genome Res,1996,6(10):986-994.
[6]张秀娥,田夫林,李希友,等.TaqMan MGB探针实时检测兔病毒性出血症病毒[J].中国兽医学报,2007,27(6):814-817.
[7]麻丽丹,巴中华,郝陶光,等.Taqman MGB探针实时PCR快速检测副溶血性弧菌[J].中国国境卫生检疫杂志,2009,32(1):39-42.
[8]Afonina I,Zivarts M,Kutyavin I,et al.Efficient priming of PCR with short oligonucleotides conjugated to a minor groove binder[J].Nucleic Acids Res,1997,25(13):2 657-2 660.
[9]中华人民共和国农业部.SC/T 7204.3-2007,对虾桃拉综合征诊断规程[M].北京:中国农业出版社,2007:2.
[10]Santhosh S R,Parida M M,Dash P K,et al.Development and evaluation of SYBR GreenⅠ-based one-step real-time RT-PCR assay for detection and quantitation of Japanese encephalitis virus[J].Virol Methods,2007,143(1):73-80.
[11]黄新新,莫胜兰,陆承平.RT-PCR法检测我国东南沿海凡纳滨对虾的桃拉综合征病毒[J].中国病毒学,2005,20(5):546-548.
[12]谢芝勋,庞耀珊,邓显文,等.多重RT-PCR同时检测鉴别三种对虾病毒的研究与应用[J].病毒学报,2005,21(5):393-396.
[13]韦信贤,黎小正,吴祥庆,等.Taura综合症病毒RT-PCR检测方法的改进及应用[J].上海水产大学学报,2008,15(5):526-528.
[14]Dhar A K,Roux M M,Klimpel K R.Quantitative assay for measuring the Taura syndrome virus and yellow headvirus load in shrimp by real-time RT-PCR using SYBR Green chemistry[J].Journal of Virological Methods,2002,104(1):69-82.
[15]岳志芹,刘荭,梁成珠,等.对虾 Taura综合症病毒Taqman实时定量 RT-PCR检测方法的建立与应用[J].中国预防兽医学报,2008,30(2):141-144.
[16]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method[J].Methods,2001,25(4):402-408.
